干旱胁迫下黄花苜蓿与蒺藜苜蓿两个抑制性差减杂交文库的构建及分析
2012-04-12王天佐赵敏桂张文浩
王天佐,赵敏桂,张文浩
(中国科学院植物研究所植被与环境变化国家重点实验室,北京100093)
*水资源缺乏是一个全球性的问题,地球上有1/3以上的陆地是干旱和半干旱地区,而中国是主要的干旱国家之一,干旱半干旱土地面积占国土面积的50%以上。水分是植物生存所必需的,干旱胁迫会严重地影响植物的生长发育,造成作物大面积减产[1]。干旱对农业和社会造成的损失相当于其他各类自然灾害造成的损失之和[2]。日益加剧的水资源短缺与植物的正常生长之间形成了激烈的矛盾,因此,通过揭示抗旱植物抵抗胁迫的机理,以寻找提高植物抗旱能力的途径势在必行。
黄花苜蓿(Medicagofalcata)是一种具有突出经济价值和生态功能的多年生优质豆科牧草,在我国分布广泛,内蒙古、新疆分布较多[3]。黄花苜蓿属于耐寒的旱中生植物,抗旱、耐寒、耐盐碱、耐风沙、耐贫瘠、抗病虫害。由于黄花苜蓿具有优异的抗逆性,所以在苜蓿的育种实践中,黄花苜蓿常常作为父本与高产的紫花苜蓿杂交,来培育苜蓿新品种[4-6]。Pennycooke等[7]对黄花苜蓿和蒺藜苜蓿(Medicagotruncatula)冷响应基因的结构进行了分析,发现黄花苜蓿基因组中编码诸如胚胎发育晚期丰富蛋白的同源基因较多,并且其上游具有多个识别低温信号的CRT/DRE元件 (C-repeated/dehydration responsive element motifs),这是黄花苜蓿较蒺藜苜蓿抗冷的分子机理之一。另外,在低温胁迫下,黄花苜蓿体内积累的脯氨酸和可溶性糖比蒺藜苜蓿占优势[8]。黄花苜蓿在低磷胁迫下能通过大量合成植物激素乙烯,调控其根系的水分运输和酸性磷酸酶的活性[9,10],黄花苜蓿还能通过根系大量分泌柠檬酸,活化根际难溶态磷来提高在磷胁迫条件下对磷的吸收[11]。在水分胁迫下,黄花苜蓿具有形态学上的优势:根系发达,入土深度达2 m,侧根沿水平方向扩展;上表皮气孔小,下表皮气孔多[3]。干旱胁迫下,黄花苜蓿较其他品种能够积累更多的可溶性糖,保持较高的光合速率,拥有较强的抗氧化系统[12]。虽然国内外对黄花苜蓿抗旱的生理机理研究已取得一定的成果,但对其抗旱的分子机理研究尚未见报道。因此,对黄花苜蓿抗旱分子调控机制的研究是极其有意义和亟待进行的。但由于黄花苜蓿遗传背景比较复杂,分子生物学研究稀少,直接对其进行抗旱分子机理研究存在一定的困难。由于黄花苜蓿与豆科模式植物蒺藜苜蓿有着紧密的亲缘关系,蒺藜苜蓿基因组小、自花授粉、丰富的基因组信息、完善的转化体系[13]以及现有的对蒺藜苜蓿抗旱的研究[14-16]为研究黄花苜蓿抵抗水分胁迫的机理提供了便利。
抑制性扣除杂交 (suppression subtractive hybridization,SSH)是一种比较和分离不同细胞系、不同组织间或同一细胞系、同一组织在不同条件下有差别表达基因的方法。抑制性消减杂交法是寻找重要功能基因的新方法,它通过单链Tester cDNA的消减均等化,以及两轮抑制性PCR使高低丰度的差异表达基因均能有效地进行分离,并可同时得到多条片段[17]。SSH技术已经成功的用于苜蓿差减文库的构建[18,19],并广泛的运用于筛选干旱相关基因的研究[20,21]。本研究利用SSH技术构建了黄花苜蓿和蒺藜苜蓿的2个差减文库并进行测序,通过比较2个文库序列的差异来分析黄花苜蓿抗旱的原因。
1 材料与方法
1.1 材料
蒺藜苜蓿使用测序种Jemalong A17,黄花苜蓿使用呼伦贝尔野生黄花苜蓿。试验于2008年11月—2009年5月在中国科学院植物研究所植被与环境变化国家重点实验室进行。
1.2 方法
1.2.1 材料栽培 选取均匀一致的黄花苜蓿和蒺藜苜蓿种子,用浓硫酸处理,春化后生根。待根长到1 cm左右时种到直径10 cm的小盆中。每盆4株,为求条件一致,2个品种的苜蓿种于同一盆中,相同品种对角种植。培养土为蛭石∶泥炭土=2∶1,各盆中培养土量一致。控制条件(光照14 h/26℃,黑暗10 h/18℃,相对湿度均为50%),使之正常生长。
1.2.2 干旱处理 当苜蓿在适宜条件下长至4周时开始处理。先将数盆苜蓿浇透水开始干旱处理,以后每隔数天依次进行干旱处理,最后同时取样,干旱处理天数为4,6,8和10 d。收样时,正常生长的为对照,将不同干旱时间地上部样品等量混合为干旱处理,液氮速冻后存放于-70℃超低温冰箱。
1.2.3 差减文库构建 使用RNAiso Plus(Ta KaRa)进行总RNA的提取,总RNA经检验没有降解后,再使用Poly Tract mRNA Isolation systems(Pormega)对其中的mRNA进行磁珠法分离。
然后使用PCR-SelectTMcDNA Subtraction Kit(Clontech),参照其说明书进行操作获得干旱诱导基因的表达序列标签 (expressed sequence tag,EST)。cDNA的合成:提取干旱处理和正常材料的mRNA分别作为检测样本(tester)和参照样本(driver),在反转录酶的作用下将它们的mRNA转录为cDNA;cDNA的酶切:将tester、driver的双链cDNA分别用RcaⅠ酶切,产生较短的平头末端;接头连接:将tester样本经酶切后的cDNA片段分为2份,分别接上接头-1 (Adapter-1)和接头-2R (Adapter-2R),形成 Adapter-1-tester-cDNA,Adapter-2R-tester-cDNA;扣除杂交:用过量的driver加入到 Adapter-1-tester-cDNA 和 Adapter-2R-tester-c DNA 中加热变性后分别退火杂交,再将第1次杂交后的产物混合,加入新制备的变性drive,再次退火杂交,得到干旱胁迫下特异表达基因的片段;PCR扩增:扣除杂交后的产物需2次PCR才能有效地扩增有差别表达的片段。在PCR反应中,只有干旱诱导表达基因的cDNA片段能以指数级扩增。
最后将这些片段纯化后连接p GEM-T Easy载体(Pormega),转化大肠杆菌感受态,菌液PCR鉴定后进行测序。
1.2.4 生物信息学分析 将2个文库测序出的EST片段使用生物序列分析软件DNA Star进行去低质量片段、去接头、去重复、并进行拼接。然后将这些序列使用碱基局部比对检索工具BLAST(http://blast.ncbi.nlm.nih.gov/)、基因语义分类GO(Gene Ontology category,http://www.geneontology.org/)和京都基因与基因组百科全书KEGG(Kyoto Encyclopedia of Genes and Genomes,http://www.genome.jp/kegg/)进行分析。
1.2.5 基因表达模式分析 从筛选出的干旱响应基因中,选取了1个乙烯响应因子(ethylene response factor,ERF)家族的转录因子基因ERN1(EU038802)以及1对同源的胚胎发育晚期丰富蛋白基因Mf CAS30(EU139865)和MtCAS31(EU139871),进行干旱处理下基因表达的半定量分析,ERN1半定量引物为5′-GTTAGGCAAAGGCCATCAGG-3′和5′-GCAGAAGCAACAGCACCATC-3′,黄花苜蓿Mf CAS30的半定量引物为5′-CTTGAGCCAAGGCCAAGTT-3′和5′-CTGTCCCTGTACCATACCC-3′,蒺藜苜蓿MtCAS31的半定量引物为5′-ATCAAACACGTAGGGTTG-3′和5′-GGTTCCACCAATGTCAGT-3′。使用Actin(引物为5′-ACGAGCGTTTCAGATG-3′和5′-ACCTCCGATCCAGACA-3′)作为内标。
2 结果与分析
2.1 2个文库的测序
分别从黄花苜蓿和蒺藜苜蓿差减文库中挑取了667和565个单克隆进行测序,得到了515和547条EST序列。经过DNA Star的处理,黄花苜蓿得到391条非冗余序列,包括78条拼接序列和313条单序列;蒺藜苜蓿得到353条非冗余序列,包括57条拼接序列和296条单序列(表1)。

表1 对照和干旱文库的EST统计结果Table 1 Statistics of ESTs for M.falcata andM.truncatula libraries
2.2 序列的生物信息学分析
Gene Ontology分类包含了基因参与的生物过程,所处的细胞位置,发挥的分子功能三方面信息。在基因表达谱分析中,GO分类常用于提供基因功能分类标签和基因功能研究的背景知识。利用GO数据库的知识体系和结构特点,旨在发掘与基因差异表达现象关联的单个特征基因功能类或多个特征功能基因的组合[22]。GO分类将2个文库的EST序列分成细胞定位、分子功能和生物功能三大部分,每部分又有细化(图1)。
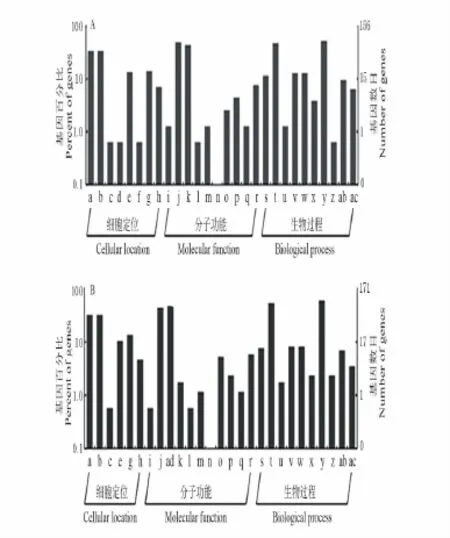
图1 黄花苜蓿和蒺藜苜蓿EST序列的GO分类Fig.1 GO category of ESTs from M.falcata and M.truncatula libraries
KEGG是系统分析基因功能、基因组信息的数据库,它有助于研究者把基因及表达信息作为一个整体网络进行研究。基因组信息包括完整和部分测序的基因组序列,图解的细胞生化过程如代谢、膜转运、信号传递、细胞周期,同系保守的子通路以及关于化学物质、酶分子、酶反应等信息。KEGG提供的整合代谢途径查询十分出色,包括碳水化合物、核苷、氨基酸等的代谢及有机物的生物降解,不仅提供了所有可能的代谢途径,而且对催化各步反应的酶进行了全面的注解。KEGG是进行生物体内代谢分析、代谢网络研究的强有力工具[23]。使用KEGG对干旱胁迫下2种苜蓿的EST进行了分析,KEGG将其分成13个代谢过程(图2)。
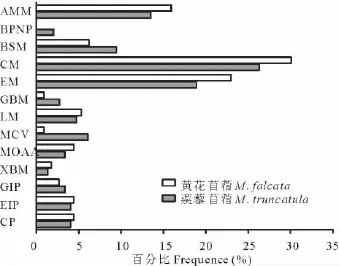
图2 黄花苜蓿和蒺藜苜蓿EST序列的KEGG分类Fig.2 KEGG category of ESTs from M.falcata and M.truncatula libraries
2.3 ERN 1和Mf CAS30/MtCAS31干旱胁迫下的表达
黄花苜蓿和蒺藜苜蓿具有很近的亲缘关系,两者之间的基因具有很高的相似性[24]。基于此点,分析了2种苜蓿同源基因在干旱胁迫下的表达差异。
ERN1是ERF家族的转录因子,通过分析其在2种苜蓿中的表达(图3),表明随着干旱胁迫程度的增加该基因在黄花苜蓿中的表达量逐渐增加,而在蒺藜苜蓿中干旱响应上调后第6天表达量开始下降。
黄花苜蓿的Mf CAS30和蒺藜苜蓿的MtCAS31均在各自的差减文库中被发现,半定量试验表明Mf CAS30和MtCAS31均受干旱诱导上调表达,但是Mf CAS30响应干旱比MtCAS31早,并且表达量高(图3)。
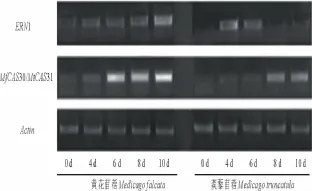
图3 ERN1和MfCAS30/MtCAS31在干旱胁迫下的表达水平Fig.3 The expression level of ERN1 and MfCAS30/MtCAS31 under drought stress
3 讨论
3.1 差减文库的构建
抑制性差减杂交技术已广泛应用于筛选抗性基因的研究中,例如干旱[20,21],低温[25],盐[26],高温[19]以及低磷[27]等。但是这些研究都是就1个物种进行差减文库的构建,而本研究平行构建黄花苜蓿和蒺藜苜蓿2个干旱相关的差减文库,不仅得到了各自干旱响应的基因,而且还可以通过2个文库的比较发现更加抵抗干旱胁迫的黄花苜蓿中的特异基因。
3.2 差异基因的分析
通过比较黄花苜蓿和蒺藜苜蓿EST的GO分类,发现在细胞定位大类中的胞外区(extracellular region)和膜/内膜(membrane/enclosed lumen)是黄花苜蓿所特有的,这些基因编码的是细胞的组成部分,可能在干旱胁迫下对于稳定细胞结构起到了重要作用。在分子功能大类中黄花苜蓿的抗氧化活性(0.36%/0.17%)、分子传导活性(0.36%/0.17%)和转录调控活性(1.28%/0.71%)都比蒺藜苜蓿占的比例高,这可能有利于黄花苜蓿在干旱胁迫下感受信号,激活抗氧化系统,并且在基因转录水平上进行调控以应对干旱胁迫。生物功能大类中黄花苜蓿刺激响应(1.82%/1.06%)较蒺藜苜蓿高,表明黄花苜蓿受到胁迫后更易表达相应的基因以应对干旱。
KEGG分析表明,干旱胁迫下黄花苜蓿的氨基酸代谢、碳水化合物代谢和能量代谢都比蒺藜苜蓿快速。黄花苜蓿氨基酸代谢加速也许是由于脯氨酸对干旱的响应造成的,而更加活跃的碳水化合物和能量的代谢不仅可以为黄花苜蓿在干旱胁迫下提供足够的能量,还可以提供植物其他代谢过程所必需的底物。这些变化都有利于黄花苜蓿可以在适度干旱的情况下保持正常的生长状态。
ERF家族基因在植物抵抗生物胁迫和非生物胁迫过程中起到重要的作用,如调节与植物生物胁迫有关的PR基因和rd29A,rd17等植物的非生物胁迫有关的基因表达[28-30]。超表达苜蓿ERF家族的WXP1基因可以增强植物对干旱的抗性[17]。MtERN1最早被发现对苜蓿根瘤的发育具有重要作用[31],本研究发现该基因也响应干旱胁迫,预测对抵抗干旱胁迫也具有一定的作用。但是2种苜蓿的表达模式不尽相同(图3),蒺藜苜蓿在受到较轻的干旱胁迫时便已经大量表达,黄花苜蓿此时也开始上调表达,但是上调倍数较蒺藜苜蓿小,可能是因为蒺藜苜蓿对干旱胁迫更加敏感。随着干旱的加剧,黄花苜蓿该基因表达量不断上调,而蒺藜苜蓿却出现下降的趋势。黄花苜蓿该基因在较强干旱胁迫的条件下仍能保持较高的表达量,这可能有助于增强其对干旱的抵抗能力。
脱水素属于胚胎发育晚期丰富蛋白的DII家族,在植物中普遍存在,其表达受到干旱、低温、盐和外源ABA等的诱导[32]。黄花苜蓿中的Mf CAS30和蒺藜苜蓿中的MtCAS31是一对同源脱水素蛋白,最早发现受低温诱导,并且Mf CAS30在黄花苜蓿中为多拷贝,而MtCAS31在蒺藜苜蓿中为单拷贝,再加之Mf CAS30上游存在多个识别低温信号的CRT/DRE元件,使得Mf CAS30在受到低温胁迫时能够更快更多的表达[7]。这2个基因都能受水分胁迫的诱导而大量表达,而且趋势与低温胁迫下相似,都是Mf CAS30受胁迫诱导早且表达量高。已将该基因进行拟南芥(Arabidopsisthaliana)和苜蓿的遗传转化,以进一步研究其在非生物胁迫下的功能。
[1] Boyer J S.Plant productivity and environment[J].Science,1982,218:443-448.
[2] 山仑,黄占斌,张岁岐.节水农业[M].北京:清华大学出版社和暨南大学出版社,2000:12-13.
[3] 陶岩.中国东北地区天然草地中豆科植物的分布规律研究[D].长春:东北师范大学,2005.
[4] 温都苏,阿拉塔,于斌.内蒙古野生苜蓿种质资源及其开发利用前景[J].畜牧与饲料科学,2004,25(6):72-74.
[5] 景艳霞,袁庆华.NaCl胁迫对苜蓿幼苗生长及不同器官中盐离子分布的影响[J].草业学报,2011,20(2):134-139.
[6] 刘晓静,郝凤,张德罡,等.抗冻基因CBF2表达载体构建及转化紫花苜蓿的研究[J].草业学报,2011,20(2):193-200.
[7] Pennycooke J C,Cheng H,Stockinger E J.Comparative genomic sequence and expression analyses ofMedicagotruncatulaand alfalfa subspecies falcata COLD-ACCLIMATION-SPECIFIC genes[J].Plant Physiology,2008,146:1242-1254.
[8] Zhang L L,Zhao M G,Tian Q Y,etal.Comparative studies on tolerance ofMedicago truncatulaandMedicagofalcatato freezing[J].Planta,2011,234:445-457.
[9] Li Y S,Gao Y,Tian Q Y,etal.Stimulation of root acid phosphatase by phosphorus deficiency is regulated by ethylene inMedicagofalcata[J].Environmental and Experimental Botany,2011,71:114-120.
[10] Li Y S,Mao X T,Tian Q Y,etal.Phosphorus deficiency-induced reduction in root hydraulic conductivity is mediated by ethylene inMedicagofalcata[J].Environmental and Experimental Botany,2009,67:172-177.
[11] 高艳,田秋英,石凤翎,等.黄花苜蓿与蒺藜苜蓿对土壤低磷胁迫适应策略的比较研究[J].植物生态学报,2011,35(6):632-640.
[12] 吕世杰.黄花苜蓿抗旱、耐盐生理特性及其抗性机理的初步研究[D].呼和浩特:内蒙古农业大学,2007.
[13] Cook D R.Medicagotruncatula-a model in the making!Commentary[J].Current Opinion in Plant Biology,1999,2:301-304.
[14] Zhang J Y,Broeckling C D,Blancaflor E B,etal.Overexpression ofWXP1,a putativeMedicagotruncatulaAP2 domaincontaining transcription factor gene,increases cuticular wax accumulation and enhances drought tolerance in transgenic alfalfa(Medicagosativa)[J].Plant Journal,2005,42:689-707.
[15] 魏臻武,盖钧镒.豆科模式植物——蒺藜苜蓿[J].草业学报,2008,17(1):114-120.
[16] Wang T Z,Chen L,Zhao M G,etal.Identification of drought-responsive microRNAs inMedicagotruncatulaby genomewide high-throughput sequencing[J].BMC Genomics,2011,12:367.
[17] Diatchenko L,Chrislau Y F,Campbell A P,etal.Suppression subtractive hybridization:a method for generating differentially regulatedor tissue-specific cDNA probe[J].Proceedings of the National Academy of Sciences of the United States of A-merica,1996,93:6025-6030.
[18] Puckette M,Peal L,Steele J,etal.Ozone responsive genes inMedicagotruncatula:Analysis by suppression subtraction hybridization[J].Journal of Plant Physiology,2009,166:1284-1295.
[19] 韩明鹏,王彦华,高永,等.高温胁迫下紫花苜蓿抑制消减文库的构建[J].草业学报,2011,20(5):126-132.
[20] Zheng J,Zhao J F,Tao Y Z,etal.Isolation and analysis of water stress induced genes in maize seedlings by subtractive PCR and cDNA macroarray[J].Plant Molecular Biology,2004,55:807-823.
[21] Wang H G,Zhang H L,Gao F H,etal.Comparison of gene expression between upland and lowland rice cultivars under water stress using cDNA microarray[J].Theoretical and Applied Genetics,2007,115:1109-1126.
[22] Ashburner M,Ball C A,Blake J A,etal.Gene Ontology:tool for the unification of biology[J].Nature Genetics,2000,25:25-29.
[23] Kanehisa M,Goto S.KEGG:Kyoto encyclopedia of genes and genomes[J].Nucleic Acids Research,2000,28:27-30.
[24] Zhou C,Han L,Pislariu C,etal.From model to crop:functional analysis of a STAY-GREEN gene in the model legumeMedicagotruncatulaand effective use of the gene for Alfalfa improvement[J].Plant Physiology,2011,157:1483-1496.
[25] 张党权,明付焕,江平,等.绵毛优若藜冷诱导SSH文库构建研究[J].中南林业科技大学学报,2000,30(2):65-69.
[26] 叶武威,赵云雷,王俊娟,等.盐胁迫下陆地棉耐盐品种根系的抑制消减文库构建[J].棉花学报,2009,21(5):339-345.
[27] 张俊红.低磷胁迫大豆SSH文库构建与分析[D].保定:河北农业大学,2001.
[28] Ohmetakagi M,Shinshi H.Ethylene-inducible DNA binding proteins that interact with an ethylene-responsive element[J].Plant Cell,1995,7:173-182.
[29] Zhou J,Tang X,Martin G B.The Pto kinase conferring resistance to tomato bacterial speck disease interacts with proteins that bind a cis-element of pathogenesis-related genes[J].EMBO Journal,1997,16:3207-3232.
[30] 刘强,赵南明.DREB转录因子在提高植物抗逆性中的作用[J].科学通报,2000,45(1):11-16.
[31] Middleton P H,Jakab J,Penmetsa R V,etal.An ERF transcription factor inMedicagotruncatulathat is essential for nod factor signal transduction[J].Plant Cell,2007,19:1221-1234.
[32] 刘广宇,魏令波,陈吉龙,等.植物脱水素研究进展[J].生物工程进展,2001,21(2):24-28.
