苜蓿乙烯应答因子基因的表达特性和生物信息学分析
2012-04-12陈婷婷杨青川张新全康俊梅丁旺张铁军
陈婷婷,杨青川,张新全,康俊梅,丁旺,张铁军
(1.中国农业科学院北京畜牧兽医研究所,北京100193;2.四川农业大学草业科学系,四川 雅安625014)
*AP2/ERF转录因子包含AP2结构域,最早从拟南芥(Arabidopsisthaliana)中分离得到。AP2结构域由高度保守的57~70个氨基酸残基组成,包含YRG区和RAYD区,YRG区的N-端由富含20个氨基酸残基的碱性和亲水性区域组成,对识别各类顺式作用元件并与之相互结合起关键作用;RAYD区位于AP2/ERF结构域的C-端,约含有40个氨基酸残基,其中约18个氨基酸残基组成的核心区可形成双亲性的α-螺旋。DNA结合区与DNA的结合依赖于YRG区,RAYD区通过影响YRG区的构象或与其他蛋白发生相互作用调节AP2结构域与DNA的结合[1,2]。根据AP2结构域的数量可以将 AP2/ERF转录因子分为3个家族[3],分别为 AP2、ERF和RAV家族。AP2家族包含2个AP2结构域,主要调控植物的生长发育;RAV家族包含1个AP2结构域和1个B3结构域;ERF家族蛋白只包含1个AP2结构域,又可分为2个亚家族:CBF/DREB亚家族和ERF亚家族,CBF/DREB在植物应答非生物胁迫的过程中发挥重要作用[4-6],ERF亚家族主要参与生物胁迫应答[7],许多研究表明ERF亚家族成员同时也参与非生物胁迫应答。苜蓿(Medicagosativa)是一种优质的豆科牧草[8,9],研究其乙烯应答因子具有重要意义。本研究以拟南芥AP2结构域为探针搜索NCBI的苜蓿属蛋白质数据库,对苜蓿属ERF蛋白进行鉴定和分析,并通过半定量RT-PCR技术对紫花苜蓿5个ERF基因的组织表达差异性和多种条件下的表达特性进行研究,以期为进一步开展苜蓿ERF蛋白结构和功能的研究提供理论基础。
1 材料与方法
1.1 生物信息学分析
以拟南芥 AP2结构域(Genbank登录号:1GCC_A)为探针,运用BlastP工具(http://blast.ncbi.nlm.nih.gov/)在NCBI的苜蓿属蛋白质数据库中进行比对,获得的氨基酸序列根据ERF蛋白的结构特征进行筛选,筛选的标准为:只含有1个AP2结构域,且不包含B3结构域。剩余的氨基酸序列运用MEGA4.1软件构建系统进化树;运用瑞士生物信息学研究所网站的Protscale软件(http://expasy.org/tools/protscale.html)进行疏水性轮廓预测;PBIL LYON-GERLAND数据库在线预测二级结构;SignalP 3.0软件(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;ProtComp Version 9.0(http://linux1.softberry.com/berry.phtml)软件预测亚细胞定位情况。
1.2 植物材料和处理
紫花苜蓿“中苜1号”由中国农业科学院北京畜牧兽医研究所牧草研究室保存及提供。挑选饱满的种子播种于MS固体培养基,置于光照培养箱中培养。生长2周的幼苗转入分别含有200 mmol/L NaCl、15%PEG6000、60μmol/L Al2(SO4)3、50μmol/L 生长素(IAA)、100μmol/L 脱落酸(ABA)、50μmol/L 赤霉素(GA)、100 μmol/L水杨酸(SA)、40μmol/L乙烯利(Eth)和100μmol/L茉莉酸甲酯(MeJA)的1/2MS液体培养基中进行处理。NaCl、PEG6000和 Al2(SO4)3的处理时间分别为0,1,6,12和24 h,激素处理的时间分别为0,1和12 h,处理完成后分别提取各处理的总RNA保存备用;2011年6月14日在畜牧所试验地中挑选1株生长3年且长势良好的苜蓿植株,分别取根、茎、叶、花蕾和花于液氮中速冻后-80℃保存,用于组织表达特异性分析。实验于2011年6月-2011年8月进行。
1.3 RNA提取及反转录
采用Trizol法分别提取各处理的总RNA,取100 mg幼苗全株于研钵中加入液氮充分研磨,转入1.5 m L离心管中,加入1 m L Trizol试剂(博迈德,北京),漩涡振荡器上剧烈震荡1 min;加入0.2 m L氯仿,剧烈震荡30 s后置于室温3 min,4℃,12 000 r/min离心10 min后将上清转移至另一离心管中,加入与上清等体积的异丙醇,冰上放置5 min,4℃,12 000 r/min离心10 min后弃上清,用75%的酒精悬浮沉淀2次;室温晾干沉淀,加入30 μL焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水溶解沉淀,保存于-80℃备用。提取的总RNA参照M-MLV反转录酶(Takara,大连)说明书进行反转录获得cDNA第一链。
1.4 半定量RT-PCR分析
根据核苷酸序列设计半定量引物,以紫花苜蓿肌动蛋白基因(Actin)作为内参,c DNA第一链为模板,对紫花苜蓿乙烯应答因子基因表达的组织特异性以及不同处理下的表达特性进行研究,所有引物序列见表1。反应体系为:H2O 17.25μL、10×buffer 2.5μL、d NTP 2μL、上下游引物各1μL、Taq DNA 聚合酶0.25μL、模板1 μL;反应程序为:94℃预变性3 min,94℃变性30 s,54℃退火30 s,72℃延伸40 s,29个循环后,72℃延伸5 min。PCR产物经2%琼脂糖凝胶电泳后拍照并进行分析。
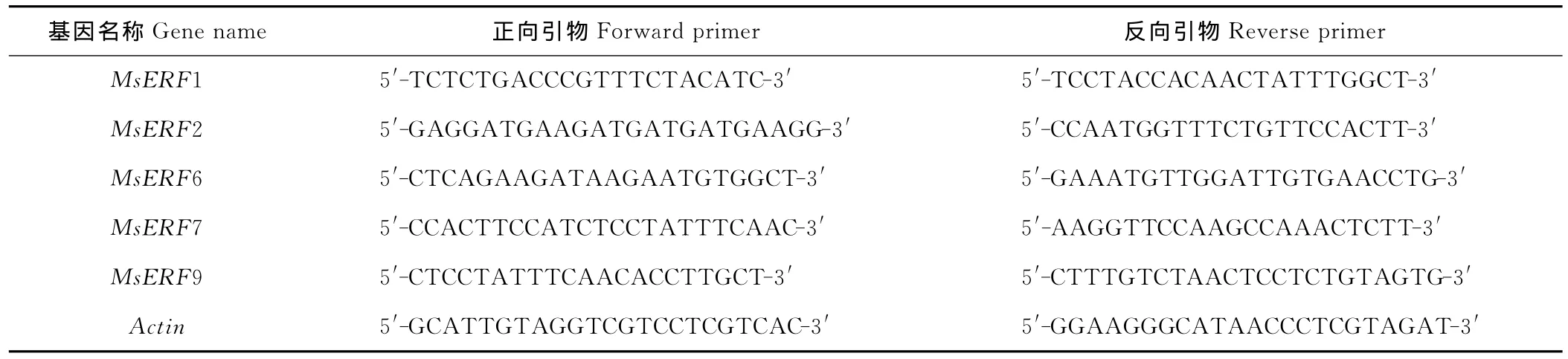
表1 用于乙烯应答因子半定量RT-PCR的引物Table 1 Primers for semi-quantitative RT-PCR
2 结果与分析
2.1 生物信息学分析
以拟南芥AP2结构域为探针搜索苜蓿属蛋白质数据库,获得的氨基酸序列根据ERF家族的结构特征进行筛选,获得41个与探针高度匹配且符合ERF家族结构特征的氨基酸序列,系统进化分析结果表明这41个氨基酸序列又可分为5组(图1)。从每组各选取1个成员(A1:ACJ84901.1;A2:ABO93372.1;A3:ACJ85181.1;A4:ABW06102.2;A5:ACJ84446.1),对它们的二级结构、疏水性轮廓、信号肽和亚细胞定位情况进行预测。结果表明这5个蛋白都包含大量α螺旋和无规卷曲结构(图2),大部分区域表现为亲水性(图3),都没有信号肽,定位于细胞核中。将这5个蛋白编码基因的紫花苜蓿同源序列命名为MsERF1、MsERF2、MsERF6、MsERF7和MsERF9。
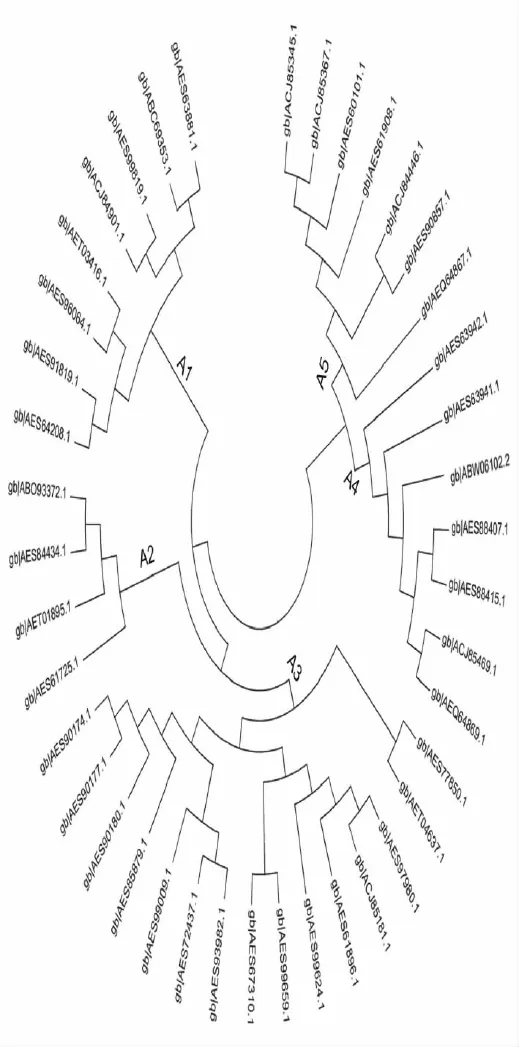
图1 苜蓿乙烯应答因子的进化树Fig.1 Phylogenetic tree of Medicago ethylene response factors
2.2 紫花苜蓿乙烯应答因子基因表达的组织差异性
MsERF1基因在根和叶中的表达量高于茎、花和花蕾(图4);MsERF2在根、叶和花中的表达量最高,茎中的表达量次之,在花蕾中的表达量最低;MsERF6在叶和花蕾中的表达高于其他组织;MsERF7在根、茎、叶和花中高表达,在花蕾中的表达量较低;MsERF9在根、茎和叶中的表达量高于花蕾,在花中没有表达。
2.3 NaCl处理对MsERF基因表达的影响
NaCl处理1 h后,MsERF1、MsERF7和MsERF9的表达量提高(图5),且一直保持高表达水平;MsERF6的表达量在处理1 h后明显升高,随着处理时间的增加,表达量呈下降趋势,处理12 h后表达量恢复到没有处理时的水平,处理24 h后表达量又有轻微上调;NaCl处理对MsERF2的表达没有影响。
2.4 PEG6000对MsERF基因表达的影响
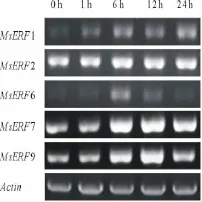
PEG6000处理条件下,随着处理时间的增加,MsERF1的表达量呈上升趋势(图6),在6 h达到最高值并保持高表达;MsERF7和MsERF9的表达量呈上升趋势,在6 h表达量最高并保持一段时间(6~12 h),随后表达量有轻微下降;MsERF6基因的表达量随着处理时间的增加呈上升趋势,在6 h达到最高值后呈下降趋势,并最终下降到没有处理时的表达水平;MsERF2的表达不受PEG6000诱导。
2.5 Al2(SO4)3 处理对 MsERF 基因表达的影响
Al2(SO4)3能诱导这5个基因的表达,MsERF1的表达量随着处理时间的增加而上升(图7),在24 h达到最大值;MsERF2基因的表达呈先上升后降低的趋势,6 h的表达量最高;MsERF6基因的表达随着处理时间的增加而上升,在6 h达到较高水平后呈下降趋势,而后又呈上升趋势;MsERF7和MsERF9的表达量在12 h达到最高,然后呈下降趋势。
2.6 激素处理对MsERF基因表达的影响
脱落酸能诱导MsERF1、MsERF6、MsERF7和MsERF9的表达,其中MsERF1和MsERF6呈先上升后降低的趋势,MsERF7和MsERF9的表达在短时间处理时没有明显变化,在长时间处理条件下才表现上升趋势,MsERF2的表达不受脱落酸诱导(图8);生长素处理条件下,MsERF6的表达量先上升后降低,其他基因的表达量都没有发生变化;茉莉酸甲酯处理条件下,MsERF1、MsERF6、MsERF7和MsERF9的表达量先上升后降低,而MsERF2的表达量呈一直上升的趋势;水杨酸处理条件下,MsERF1的表达量在短时间没有变化,在12 h表达量呈上升趋势,MsERF2和MsERF7的表达呈先上升后下降的趋势,MsERF6和MsERF9的表达量在短时间就表现上升趋势,且一直维持在高表达水平;赤霉素处理条件下,MsERF1的表达量一直上升,MsERF2和MsERF6的表达量先上升后下降;MsERF7和MsERF9的表达量在处理1h后有明显上升,且随着处理时间的增加,其表达一直维持在高水平;乙烯利处理条件下,MsERF1的表达随着处理时间的增加呈一直上升的趋势,MsERF2和MsERF9在短时间处理时表达量有显著上升,然后维持在高水平;MsERF6和MsERF7的表达在短时间没有明显变化,处理12 h后,表达量上升。
3 讨论
在长期的进化过程中,植物逐渐形成由功能蛋白和转录因子组成的分子调控网络以适应环境的变化。内外环境被植物感知后转变为各种信号,通过一系列的信号传导,引起相关基因表达的改变,最终作出适应性反应。通常情况下,基因表达的调控发生在转录水平上,转录因子通过与顺势作用元件结合,从而调控基因的表达。乙烯是五大类植物激素之一,与植物的生长发育和胁迫应答有密切关系,参与植物种子萌发、果实成熟、根生长、花器官形成、叶和花的衰老等植物发育过程的调控,并调控植物应答病害侵染和非生物胁迫等过程。通过对模式植物拟南芥的研究表明,植物体内乙烯信号传导途径为:外界信号→ETR→CTR→EIN2→EIN3→ERF→生理生化反应[10-12],乙烯应答因子在整个乙烯信号通路中占据关键位置。
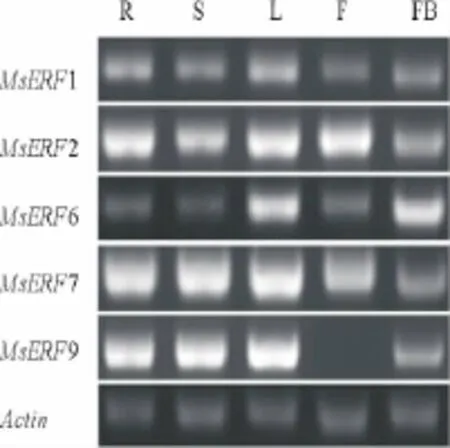
图4 MsERF基因表达的组织差异性Fig.4 Expression analysis of MsERF genes in different tissues
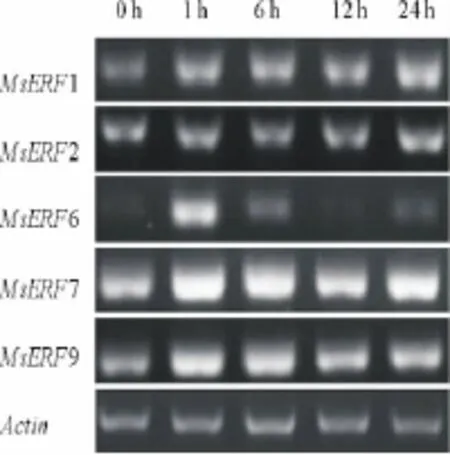
图5 NaCl处理下MsERF基因的表达量变化Fig.5 Expression of MsERF genes under NaCl treatment
转录因子在高等植物的生长发育及其对外界环境的反应中起着重要的调控作用[13]。乙烯应答因子是AP2/ERF转录因子家族成员,只包含1个AP2结构域且不包含B3结构域。本研究以拟南芥AP2结构域为探针,运用BlastP工具在NCBI的苜蓿属蛋白质数据库中进行比对,获得的氨基酸序列剔除AP2家族和RAV家族成员,剩余的序列符合ERF家族的结构特征,即为苜蓿ERF家族成员。同大多数转录因子基因一样,ERF基因的表达受到复杂的调控。大多数ERF基因都是诱导表达的,干旱、低温、盐碱、乙烯、脱落酸、病害、赤霉素、水杨酸等能诱导其表达,但是不同的ERF基因有不同的诱导表达模式,即使是同源性很高,同一条件下它们的表达模式也会有很大的不同。在已发现的同源性较高的ERF转录因子ORCAs中,ORCA2[14]和ORCA3[15]的表达受茉莉素诱导,调控启动子含有茉莉素应答元件基因的表达,而ORCA1则不受茉莉素的诱导,本研究中的5个ERF基因在同一条件下的表达模式有差异,这与以前的研究结果吻合。

图7 Al2(SO4)3处理下MsERF基因的表达量变化Fig.7 Expression of MsERF genes under Al2(SO4)3 treatment

图8 激素处理下MsERF基因的表达量变化Fig.8 Expression of MsERF genes under hormone treatments
植物感知各种外界信号,形成不同的信号传导途径,各种不同的信号传导途径可以形成交互作用[16,17]。由于交互作用的存在,植物在受到不同伤害时,往往会表现出同样的适应性反应,交互作用是通过多个基因之间形成的信号传导网络来实现的。作为植物特有的一类转录因子,乙烯应答因子在植物体内多种信号通路中起着调控下游基因表达的功能,与植物的多种生理生化反应都有密切关系。已有的研究表明,ERF基因参与植物的抗病反应和生长发育,以及对非生物胁迫的应答[18,19]。本研究结果表明同一个ERF基因同时受2种或多种条件的诱导,表明这些乙烯应答因子可能在植物体内信号传导途径的交互作用中发挥作用。
以前的研究表明ERF基因主要参与生物胁迫的应答,也有研究表明它们参与非生物胁迫应答。在拟南芥中超表达Br ERF4基因可以提高转基因植物的抗盐性和抗旱性[20];在水稻(Oryzasativa)中超表达JERF3基因可以提高WCOR413-like,OsEnol和OsSPDS2基因的表达,使转基因水稻的抗旱性和抗渗透胁迫能力提高[21];在水稻中超表达JERF1可以提高转基因植株的抗旱性[22]。本研究结果表明MsERF2基因的表达不受NaCl和PEG6000处理的影响,表明它可能不参与植物对渗透胁迫和Na/Cl离子毒害的应答,而其表达受Al2(SO4)3的诱导,表明它参与铝盐毒害的信号传导途径;脱落酸被称为“胁迫酸”,植物存在依赖脱落酸和不依赖脱落酸的胁迫应答机制,MsERF2的表达不受ABA的诱导,表明它属于非ABA依赖型,其余4个基因都能被NaCl、PEG6000、Al2(SO4)3和ABA诱导,表明它们的胁迫应答都属于依赖ABA型;MeJA、SA、GA和Eth与植物的抗病虫性,5个基因的表达都能被这4种激素诱导,由此可以推测它们极有可能与苜蓿的抗病虫性相关;生长素处理时只有MsERF6基因的表达受轻微影响,其余基因的表达量都没有变化,据此推测它们都不参与到与IAA应答的分子调控网络中。本研究通过半定量RT-PCR的方法对5个紫花苜蓿乙烯应答因子基因的组织表达差异性及各种处理条件下的表达模式进行分析,对进一步开展这些基因功能的研究奠定了基础,同时也为研究植物体内的信号传导和不同信号传导途径的交互作用提供了依据。
4 结论
本研究以AP2结构域为探针搜索NCBI的苜蓿蛋白质数据库,根据乙烯应答因子的结构特征对获得的蛋白序列进行鉴定。系统进化分析表明苜蓿乙烯应答因子可以分为5组,从每组中选取1个成员进行二级结构、疏水性轮廓、信号肽和亚细胞定位情况分析,结果表明这5个蛋白都包含大量α螺旋和无规卷曲结构,大部分区域表现为亲水性,定位于细胞核中,都没有信号肽;运用半定量RT-PCR技术研究5个紫花苜蓿乙烯应答因子基因(MsERF1,MsERF2,MsERF6,MsERF7,MsERF9)表达的组织差异性以及各种处理条件下的表达特性。结果表明,5个乙烯应答因子基因在叶中的表达量都明显高于其他组织,不同基因有不同的组织表达特性;NaCl和PEG6000对MsERF2的表达没有影响,但Al2(SO4)3能诱导其表达,其余基因的表达都受这3种处理的诱导;脱落酸对MsERF2的表达没有影响,能够诱导其他基因的表达;生长素只能影响MsERF6的表达,对其他基因的表达没有影响;赤霉素、茉莉酸甲酯和乙烯利对5个基因的表达都起促进作用。本研究为进一步研究苜蓿蛋白的结构和功能奠定了基础,同时为研究不同信号传导途径之间的交互作用提供了依据。
[1] Liu Q,Zhang G Y,Chen S Y.Structure and regulatory function of plant transcription factors[J].Chinese Science Bulletin,2001,46(4):271-278.
[2] Jack K,Okamur O,Caster B,etal.The AP2 domain of APETALA2 defines a large new family of DNA binding protein inArabidopsis[J].Proceedings of the National Academy of Sciences,USA,1997,94(6):7076-7081.
[3] Nakano T,Suzuki K,Fujimura T,etal.Genome-wide analysis of the ERF gene family inArabidopsisand rice[J].Plant Physiology,2006,140(2):411-432.
[4] Yamaguchi-Shinozaki K,Shinozaki K.A novel cis-acting element in anArabidopsisgene is involved in responsiveness to drought,low-temperature,or high-salt stress[J].The Plant Cell,1994,6(2):251-264.
[5] 王舟,刘建秀.DREB/CBF类转录因子研究进展及其在草坪草和牧草抗逆基因工程中的应用[J].草业学报,2011,20(1):222-236.
[6] 刘晓静,郝凤,张德罡,等.抗冻基因CBF2表达载体构建及转化紫花苜蓿的研究[J].草业学报,2011,20(2):193-200.
[7] Hao D Y,Ohme-Takagi M,Sarai A.Unique mode of GCC box recognition by the DNA-binding domain of ethylene-responsive element-binding factor(ERF domain)in plant[J].The Journal of Biological Chemistry,1998,273(41):26857-26861.
[8] 杨红善,常根柱,周学辉,等.美国引进苜蓿品种半湿润区栽培试验[J].草业学报,2010,19(1):121-127.
[9] 张改娜,贾敬芬.豌豆清蛋白1(PAl)基因的克隆及对苜蓿的转化[J].草业学报,2009,18(3):117-125.
[10] Bleecker A B,Kende H.ETHYLENE:A gaseous signal molecule in plants[J].Annual Review of Cell and Developmental Biology,2000,16:1-18.
[11] Chang C.The ethylene signal transduction pathway in Arabidopsis:an emerging paradigm[J].Trends in Biochemistry Science,1996,21(4):129-133.
[12] Ecker J.The ethylene signal transduction pathway in plants[J].Science,1995,268:667-675.
[13] 江腾,林勇祥,刘雪,等.苜蓿全基因组 WRKY转录因子基因的分析[J].草业学报,2011,20(3):211-218.
[14] Menke F L H,Champion A,Kijne J W,etal.A novel jasmonate-and elicitor-responsive element in the periwinkle secondary metabolite biosynthetic gene Str interacts with a jasmonate-and elicitor-inducible AP2-domain transcription factor,ORCA2[J].The EMBO Journal,1999,18:4455-4463.
[15] Van der Fits L,Memelink J.The jasmonate-inducible AP2/ERF-domain transcription factorORCA3 activates gene expression via interaction with a jasmonate-responsive promoter element[J].The Plant Journal,2001,25(1):43-53.
[16] Zhang G Y,Chen M,Li L C,etal.Overexpression of the soybean GmERF3 gene,an AP2/ERF type transcription factor for increased tolerances to salt,drought,and diseases in transgenic tobacco[J].Journal of Experimental Botany,2009,60(13):3781-3796.
[17] Mauch-Mani B,Mauch F.The role of abscisic acid in plant-pathogen interactions[J].Current Opinion in Plant Biology,2005,8(4):409-414.
[18] Thara V K,Tang X Y,Gu Y Q,etal.Pseudomonas syringae pv tomato induces the expression of tomato EREBP-like genes Pti4 and Pti5 independent of ethylene,salicylate and jasmonate[J].The Plant Journal,1999,20(4):475-483.
[19] Liu Q,Kasuga M,Sakuma Y,etal.Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,inArabidopsis[J].The Plant cell,1998,10:1391-1406.
[20] Seo Y J,Park J B,Cho Y J,etal.Overexpression of the ethylene-responsive factor gene Br ERF4 from brassica rapa increases tolerance to salt and drought inArabidopsisPlants[J].Molecules and Cells,2010,30:271-277.
[21] Zhang H W,Liu W,Wan L Y,etal.Functional analyses of ethylene response factor JERF3 with the aim of improving tolerance to drought and osmotic stress in transgenic rice[J].Transgenic Research,2010,19:809-818.
[22] Zhang Z J,Li F,Li D J,etal.Expression of ethylene response factor JERF1 in rice improves tolerance to drought[J].Planta,2010,232:765-774.
