碱蓬和三角叶滨藜幼苗生长、光合特性对不同盐度的响应
2012-04-12彭益全谢橦周峰万红建张春银翟瑞婷郑青松郑春芳刘兆普
彭益全,谢橦,周峰,万红建,张春银,翟瑞婷,郑青松*,郑春芳,刘兆普
(1.南京农业大学资源与环境科学学院 江苏省海洋生物学重点实验室,江苏 南京210095;2.滨州学院 山东省黄河三角洲生态环境重点实验室,山东 滨州256603;3.南京晓庄学院生物化工与环境工程学院,江苏 南京211171;4.浙江省农业科学院蔬菜研究所,浙江 杭州320021;5.江苏省盐城绿苑海蓬子有限公司,江苏 盐城224002;6.浙江省海洋水产养殖研究所 浙江省永兴水产种业有限公司,浙江 温州325005)
*我国沿海滩涂广阔,大陆岸线全长1.84×104km,海滨盐土达2.0×107hm2[1]。其中江苏省大陆岸线全长888.95 km,海滨未围垦总面积5.0×105hm2,约占全国滩涂总面积的1/4,居全国各省首位[2]。海涂蕴藏着丰富的植被资源,这类植物由于其生境恶劣,生物量偏小,传统的经济效益低下,因而在漫长的历史岁月中一直未被足够重视。实际上,滩涂植被在盐渍土开发利用、维持生态平衡等方面起着非常重要的作用。在其组成种类中,以藜科植物所起的作用最大,是盐生植物群落的建群种[3]。随着当前人口的增长、工业化、城市化的加剧,粮食、资源、环境等问题日益突出,滨海盐土植物资源显示出越来越大的生态、经济和社会等效益,因而日益受到沿海各国的高度重视[4]。其中海水蔬菜成为当前海滨盐土植物一个重要研究和开发方向,其研发虽然起步晚,但作为纯天然绿色保健有机食品,其富含蛋白质、维生素和铁、硒、锌等人体所必需的微量元素,海水蔬菜的研究和开发被誉为农业上的一次革命[5]。
碱蓬(Suaedaglauca)和三角叶滨藜(Atriplextriangularis)是当前研发较多的海水蔬菜,均属藜科(Chenopodiaceae),前者为一年生叶肉质化真盐生草本植物,后者为一年生泌盐型盐生草本植物[6,7]。近几年来,碱蓬和三角叶滨藜在江苏沿海滩涂上被广为种植、利用和开发。盐生植物最显著的特点是具有高度的耐盐性[3,8]。由于盐生植物的经济利用多年来一直未得到充分的重视,有关碱蓬属和滨藜属植物耐盐性的国内外文献报告并不多。且对前者的研究主要集中在其水分关系[9]、渗透调节[10]、离子吸收和运输[11]、抗氧化代谢[12,13]等方面,也有一些关于光合作用[14]、氮素等营养代谢[15,16]方面的文献报告;相对来说,对后者的研究就更少,且主要在其离子吸收和运输机制[17]等方面。具体到本研究中的两品种上研究就更为缺乏,其中关于碱蓬的研究仅在其离子稳态[6]和多胺、脯氨酸代谢[18]等方面有一些文献报告,关于三角叶滨藜的研究报告仅仅在离子稳态[19,20]和甜菜碱代谢[21]上。真盐生植物更多的为专性盐生植物,即在低盐下生长往往被促进,而高盐下则抑制生长;泌盐盐生植物主要为兼性盐生植物,其生长不能被盐分促进[22]。碱蓬和三角叶滨藜作为不同类型的盐生植物,对不同盐度的生长响应理应存在着明显的差异,而这方面的文献报告极为匮缺,作为其生长发育基础的光合作用等方面的研究[23]也鲜有文献报告,主要是因为碱蓬等肉质化植物叶片异型化造成光合测定难度较大的缘故[24]。研究盐胁迫对植物光合作用的影响机理,可以为提高植物耐盐性,改良植物品种提供理论依据。因此,盐胁迫对植物光合作用的影响一直是植物耐盐性研究领域的一大热点[25,26]。本研究以碱蓬和三角叶滨藜为试验材料,比较探讨了不同浓度NaCl处理对其幼苗生长、光合色素含量及其比值、不同光合参数和水分利用等的效应,旨在阐述2种不同类型的盐土植物对盐渍响应的生理机制的异同,期望进一步揭示其不同的耐盐机制,对海水蔬菜开发利用、推进盐土农业可持续发展等提供必要的理论依据。
1 材料与方法
1.1 试验材料
碱蓬和三角叶滨藜种子均由江苏盐城绿苑海蓬子公司提供。
1.2 植物的培养与处理
试验所用种子先用5%次氯酸钠消毒处理,清洗后播种于装有20~40目石英砂的塑料盆(规格225 mm×160 mm)中,用Hoagland培养液培养30 d,间苗以确保齐苗,每盆6株。再培养10 d,转入含不同浓度NaCl(100,400和800 mmol/L)的 Hoagland溶液处理,以不加 NaCl(0 mmol/L)的 Hoagland营养液作为对照(Control),每处理10个重复。为避免盐冲击效应,采用每天递增100 mmol/L的方式提高NaCl处理浓度,到达最终浓度后,再继续处理30 d,然后分别进行采样及分析测定。试验过程中,营养液浇灌方式采用砂面灌法,为减少砂培介质中NaCl浓度变化幅度。处理液浇灌量为砂子持水量的4倍,每天浇灌1次,约有3/4的溶液流出,可将其余的盐分冲洗掉,以保持NaCl的浓度恒定。整个试验过程均在昼/夜(25±2)℃/(20±2)℃左右,温室中自然光照下进行。
1.3 测定方法
1.3.1 株高 全面处理30 d后,用刻度尺测量砂面到最高生长点的高度,每一处理组随机抽取6株进行测定。
1.3.2 植株干重(dry weight,DW)、根冠比(root DW/shoot DW,R/S)、含水量(water content,WC) 用去离子水清洗植株表面,用吸水纸吸干水分,用天平称得其鲜重,再将其根、茎、叶分开装入纸袋,随即置于110℃温度烘箱中杀青15 min,然后在75℃下将植物样品烘干至恒重,称得其干重。按照下列公式计算根冠比和干重含水量[27]:

1.3.3 叶片光合色素含量的测定 按照文献[28]的方法测定。叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)含量根据公式Ca=13.95D665-6.88D649;Cb=24.96D649-7.32D665;Cx·c=(1 000D470-2.05Ca-114.8Cb)/245计算获得。再通过换算获得叶绿素(Chl)含量、叶绿素a含量/叶绿素b含量(Chl a/Chl b)和叶绿素含量/类胡萝卜素含量(Chl/Car)。
1.3.4 植物光合气体交换参数的测定与计算 按照文献[14,24]方法,用Li-6400便携式光合仪(Li-COR,USA)测定其光合指标。于上午8:30-11:00选取植株相同位置一小簇(片)叶(活体叶片),测定并通过换算获得叶片的净光合速率(net photosynthesis rate,Pn)(单位鲜重FW)、气孔导度(stomatal conductance,Gs)(单位鲜重)、细胞间CO2浓度(intercellular CO2concentration,Ci)、蒸腾速率(transpiration rate,Tr)(单位鲜重)等参数,测定后即剪下该部分叶片称得质量。测定时使用红蓝光源叶室,光强为1 000μmol/(m2·s),温度为25℃,空气CO2浓度约为402μmol/mol。叶片水分利用效率(water use efficiency,WUE)计算公式为:WUE=Pn/Tr,气孔限制值(stomatal limitation value,Ls)计算公式为:Ls=1-Ci/Ca(Ca为空气中CO2浓度)[29]。
1.4 数据处理
采用Excel 2003和SPSS 16.0进行数据处理及统计分析。用One-way ANOVA检验差异的显著水平(P),处理间差异的显著水平为P<0.05。
2 结果与分析
2.1 不同浓度盐胁迫对碱蓬和三角叶滨藜幼苗株高、WC、DW和R/S的影响
与对照相比,随着NaCl处理浓度的增加,碱蓬株高先升高后降低,其最大值出现在100 mmol/L NaCl浓度处理,高于对照21%,400 mmol/L NaCl处理时其株高与对照差异不显著,而800 mmol/L NaCl处理下,其株高下降48%;100和400 mmol/L NaCl处理对三角叶滨藜的株高没有显著影响,800 mmol/L NaCl处理下,其株高下降35%(表1)。100和400 mmol/L NaCl处理下,碱蓬和三角叶滨藜根部WC与各自对照差异均不显著,但是100 mmol/L NaCl处理的碱蓬根部WC显著高于400 mmol/L NaCl处理的,800 mmol/L NaCl处理下碱蓬和三角叶滨藜根的WC均显著下降,分别下降18%和45%(表1)。植株地上部 WC的变化更为显著,100 mmol/L NaCl处理的碱蓬地上部WC显著高于其他处理,而400 mmol/L NaCl处理的碱蓬地上部WC与对照差异不显著,800 mmol/L NaCl处理下,其 WC显著下降,下降28%;而NaCl胁迫显著降低三角叶滨藜植株地上部的WC,100,400和800 mmol/L NaCl处理下其分别降低9%,26%和42%(表1)。100和400 mmol/L NaCl处理下,碱蓬幼苗根DW显著上升,分别比对照增加103%和28%,而800 mmol/L NaCl处理下的碱蓬根DW比对照下降51%;而100 mmol/L NaCl处理下,三角叶滨藜幼苗根DW无显著变化,400和800 mmol/L NaCl处理下,其幼苗根DW显著下降,分别比对照降低37%和81%。100 mmol/L NaCl处理的碱蓬地上部DW显著高于其他处理,而400 mmol/L NaCl处理的碱蓬地上部DW与对照差异不显著,800 mmol/L NaCl处理下,显著下降,下降47%;从整株DW水平上看,不同处理间差异和地上部DW相似。而NaCl胁迫显著降低三角叶滨藜植株地上部DW以及整株DW,100,400和800 mmol/L NaCl处理下其整株DW分别降低11%,48%和84%,而800 mmol/L NaCl处理下碱蓬整株DW降低48%(表2)。随盐度的上升,R/S均表现为先增后降,碱蓬在100 mmol/L NaCl处理下达最大值,而三角叶滨藜在400 mmol/L NaCl处理下达最大值。
2.2 不同浓度盐胁迫对碱蓬和三角叶滨藜幼苗叶片Chl、Car含量、Chl a/Chl b和Chl/Car的影响
100 mmol/L NaCl处理下,碱蓬的Chl含量不受影响,而三角叶滨藜的Chl含量显著下降,随着盐度的增加,二者Chl含量均显著下降,400和800 mmol/L NaCl处理下,碱蓬幼苗叶绿素含量分别下降26%和61%,三角叶滨藜幼苗Chl含量分别下降18%和28%(图1A)。与对照相比,100 mmol/L NaCl处理下,碱蓬的Car含量显著增加,而三角叶滨藜的Car含量无显著变化,随着盐度的增加,二者Car含量均显著下降,400和800 mmol/L NaCl处理下,碱蓬幼苗Car含量分别下降19%和71%,三角叶滨藜幼苗Car含量分别下降14%和27%(图1B)。随着盐处理浓度的增加,碱蓬和三角叶滨藜的Chl a/Chl b逐渐显著增加,且三角叶滨藜的Chl a/Chl b增幅要大于碱蓬的(图1C)。随着盐度的增加,碱蓬的Chl/Car呈先降低后升高的趋势,在100 mmol/L NaCl处理下,Chl/Car达到最低值,显著低于对照,而800 mmol/L NaCl处理下,其Chl/Car显著高于对照;不同浓度NaCl处理下对三角叶滨藜的Chl/Car影响不显著(图1D)。
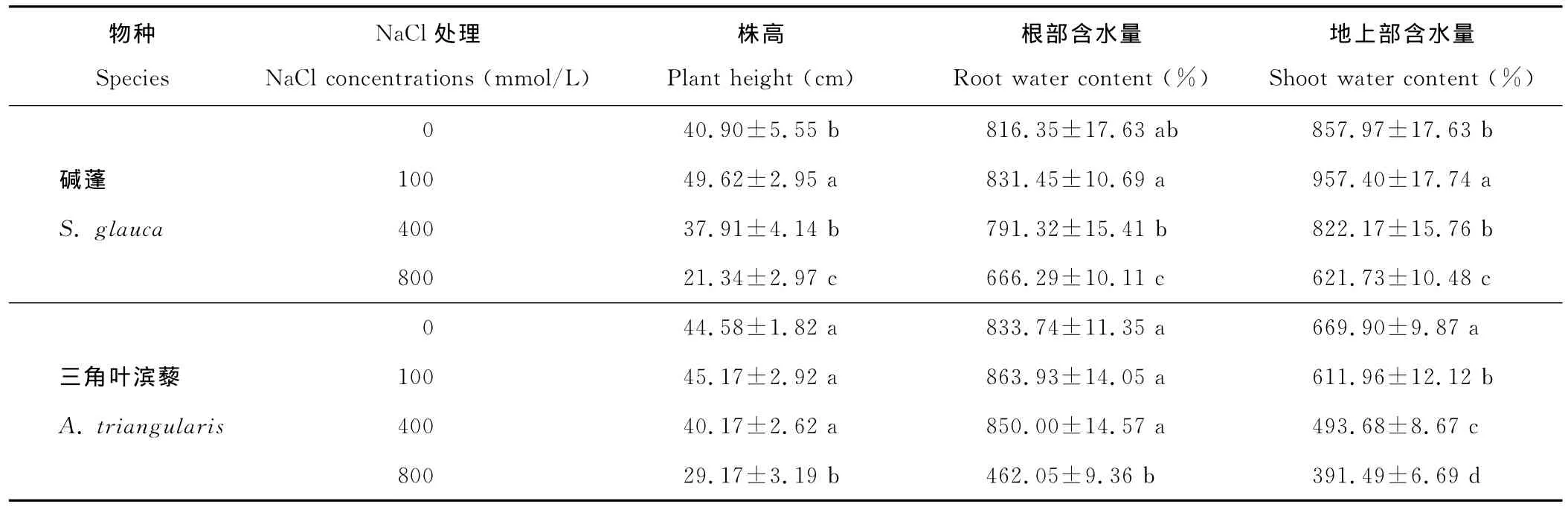
表1 不同浓度NaCl处理30 d对碱蓬和三角叶滨藜幼苗株高、植株WC的影响Table 1 Effects of different concentration of NaCl for 30 d on plant height and WC in S.glauca and A.triangularis seedlings
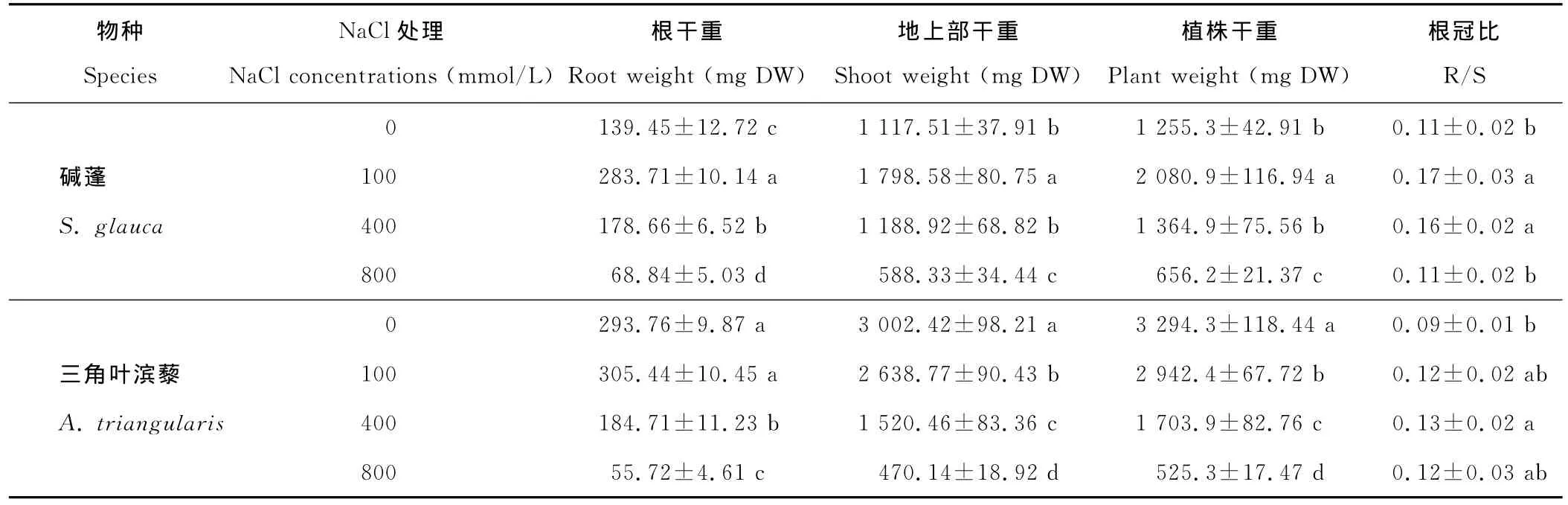
表2 不同浓度NaCl处理30 d对碱蓬和三角叶滨藜幼苗生物量和根冠比的影响Table 2 Effects of different concentrations of NaCl for 30 d on plant biomass and R/S in S.glauca and A.triangularis seedlings
2.3 不同浓度盐胁迫对碱蓬和三角叶滨藜幼苗叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)的影响
100 mmol/L NaCl处理下,碱蓬的Pn、Gs、Tr均显著增加,而三角叶滨藜的Pn、Gs、Tr均显著降低(图2);随着NaCl处理浓度的增加,二者的Pn、Gs、Tr均显著下降,400和800 mmol/L NaCl处理下,碱蓬的Pn分别下降9%和58%,Gs分别降低52%和83%,Tr分别降低23%和70%;而三角叶滨藜的Pn分别下降62%和79%,Gs分别降低74%和77%,Tr分别降低70%和82%。随着NaCl浓度的上升,碱蓬的Ci逐渐显著下降,400和800 mmol/L NaCl处理下,其下降30%和49%;三角叶滨藜在100和400 mmol/L NaCl处理下,Ci下降26%和35%,但是800 mmol/L NaCl处理下三角叶滨藜的Ci显著上升,比对照上升19%。
2.4 不同浓度盐胁迫对碱蓬和三角叶滨藜幼苗水分利用效率(WUE)和气孔限制值(Ls)的影响
与对照相比,100 mmol/L NaCl处理下,碱蓬的WUE显著下降,而三角叶滨藜的WUE显著上升。随着盐度的增加,碱蓬的WUE逐渐显著上升,而三角叶滨藜的WUE逐渐显著下降(图3A)。随着盐度的增加,两植物叶片Ls均逐渐显著上升,但是三角叶滨藜的Ls在800 mmol/L NaCl处理下急剧下降,显著低于对照(图3B)。
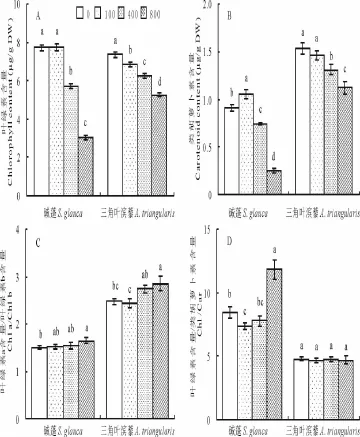
图1 不同NaCl浓度(0,100,400和800 mmol/L)溶液处理30 d对碱蓬和三角叶滨藜幼苗叶绿素含量(A)、类胡萝卜素含量(B)、叶绿素a/叶绿素b(C)和叶绿素/类胡萝卜素(D)的影响1 Effects of different concentrations of NaCl(0,100,400,800 mmol/L)on chlorophyll content(A),carotenoid content(B),chlorophyll a/chlorophyll b(C)and chlorophyll/carotenoid(D)for 30 days in S.glauca and A.triangularis seedlings
2.5 盐处理下碱蓬和三角叶滨藜幼苗植株生物量与其他指标的相关性分析
碱蓬植株干重与Tr、Pn、地上部WC、Car含量、根WC、Gs、根冠比、株高、Chl含量、Ci呈现极显著正相关,而与Chl/Car、Ls呈极显著负相关,与WUE显著负相关,与Chl a/Chl b无显著的相关性(表3);三角叶滨藜生物量与地上部WC、Chl含量、Pn、Car含量、Tr、Gs、根 WC、株高呈极显著正相关,与Chl a/Chl b呈极显著负相关,与根冠比、Chl/Car、Ci、WUE和Ls无显著相关性。
3 讨论
3.1 碱蓬和三角叶滨藜幼苗的耐盐性比较
生物量是植物对盐胁迫反应的综合体现,也是评价植物耐盐性的首要指标[25,27,30,31]。淡土植物如玉米(Zea mays)[32]、大麦(Hordeumvulgare)[33]、菊芋(Helianthustuberosus)[34]、水稻(Oryzasativa)[35]等的生物量在盐胁迫下显著下降,显示对高盐的敏感性;而盐生植物则具有较高的耐盐性,其中真盐生植物往往具有植株特定器官肉质化的特点,其生长具有低盐促进、高盐抑制这样的特点,低浓度盐分促进其生长的作用主要与渗透调节有关,生长在无NaCl环境下植株会因失去渗透调节能力而受到伤害[3]。Aghaleh等[30]研究表明,100 mmol/L NaCl处理波斯海蓬子(Salicorniapersica)和欧洲海蓬子(Salicorniaeuropaea)幼苗45d,显著地促进其生长。而番杏科植物海马齿(Sesuviumportulacastrum)外植体在含有不同盐度的MS培养基上培养30 d[36],散枝海蓬子(Salicorniabrachiata)10周大的幼苗在含有不同盐度的Hoagland营养液培养21 d[37]以及木碱蓬(Suaeda fruticosa)在不同盐度下砂培90 d[38]的最适生长促进盐度均为200 mmol/L NaCl,而盐地碱蓬(Suaedasalsa)幼苗在不同盐度下培养46 d发现,50,100和200 mmol/L NaCl处理间生长差异不明显,但均显著高于对照[39],上述植物均为肉质化的真盐生植物。而泌盐盐生植物的生长往往不能被盐分显著促进,但也表现出高度的耐盐性的特点[3]。大洋洲滨藜(Atriplexnummularia)为典型囊泡泌盐植物,其幼苗在不同盐度下培养28 d,发现低盐对其生长无明显抑制[17]。本研究中,真盐生肉质化植物碱蓬和囊泡泌盐植物三角叶滨藜幼苗生长也具有这样的特点,碱蓬幼苗盐处理30 d,100 mmol/L NaCl处理显著促进株高、地上部含水量和植株生物量,而三角叶滨藜幼苗生长对盐度的响应反映了泌盐盐生植物的特点,100 mmol/L NaCl处理对株高、根部含水量、根干重等没有明显的促进,相反,100 mmol/L NaCl处理对地上部含水量和地上部干重有轻微的下降,800 mmol/L NaCl胁迫下30 d,碱蓬和三角叶滨藜植株幼苗存活均没有问题,且其完整植株干重生物量分别维持在对照水平的52%和16%,表现出盐生植物高耐盐性的典型特点,且前者的耐盐性要显著优于后者。
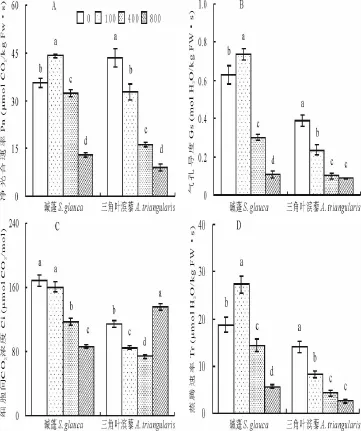
图2 不同NaCl浓度(0,100,400和800 mmol/L)溶液处理30天对碱蓬和三角叶滨藜净光合速率(Pn)(A)、气孔导度(Gs)(B)、细胞间CO2 浓度(Ci)(C)和蒸腾速率(Tr)(D)的影响Fig.2 Effects of different concentrations of NaCl(0,100,400,800 mmol/L)on net photosynthetic rate(Pn)(A),stomatal conductivity(Gs)(B),intercellular CO2 concentration(Ci)(C)and transpiration rate(Tr)(D)for 30 d in S.glauca and A.triangularis seedlings
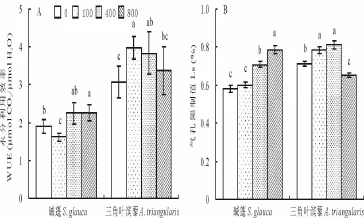
图3 不同NaCl浓度(0,100,400和800 mmol/L)溶液处理30 d对碱蓬和三角叶滨藜幼苗水分利用效率(WUE)(A)和气孔限制值(Ls)(B)的影响Fig.3 Effects of different concentrations of NaCl(0,100,400,800 mmol/L)on water use efficiency(WUE)(A)and stomatal limitation values(Ls)(B)for 30 d in S.glauca and A.triangularis seedlings efficiency(WUE)
3.2 根冠比与耐盐性
植物地上部分和地下部分之间是相互依赖又相互制约、协调平衡的关系。根冠比是植物体光合作用产物分配的重要体现[40,41]。不同植物根冠比对盐度的响应有差别,如多年生耐旱型木本植物麻疯树(Jatrophacurcas)幼苗在不同盐度(0,30,60,90,120和150 mmol/L NaCl)处理下40 d,其根冠比变化不显著[42]。和对照相比,200 mmol/L NaCl处理13周,多年生肉质草本盐生植物海马齿根冠比变化不明显,而在400 mmol/L NaCl处理下根冠比明显降低;藜科芭菲尔鞋兰属植物Tecticorniaindica根冠比则在200和400 mmol/L NaCl处理下有显著下降[43]。在本研究中,低盐浓度下,碱蓬根冠比随着NaCl浓度的升高有一定的增大,这很可能是低盐下,植株水分状况得到改善,刺激了根部的生长所致[3],盐度上升到800 mmol/L NaCl,这一刺激作用消失,根冠比显著下降,但依然不低于对照。而三角叶滨藜随着NaCl浓度的升高,其根冠比变化不大,有较小的增幅,也说明其地上部分对盐度的敏感性要高于根部。在高盐下,根部始终具有出奇的耐盐性[40],从而维持地上部的光合作用,以求得生存,这一特性,在盐生植物上表现尤为显著,本研究中碱蓬和三角叶滨藜的根冠比在高盐下维持的都比较高。而地上部的生物量往往对盐度较为敏感,作为盐渍对盐生植物生长影响的评价指标比较合适[3,22]。
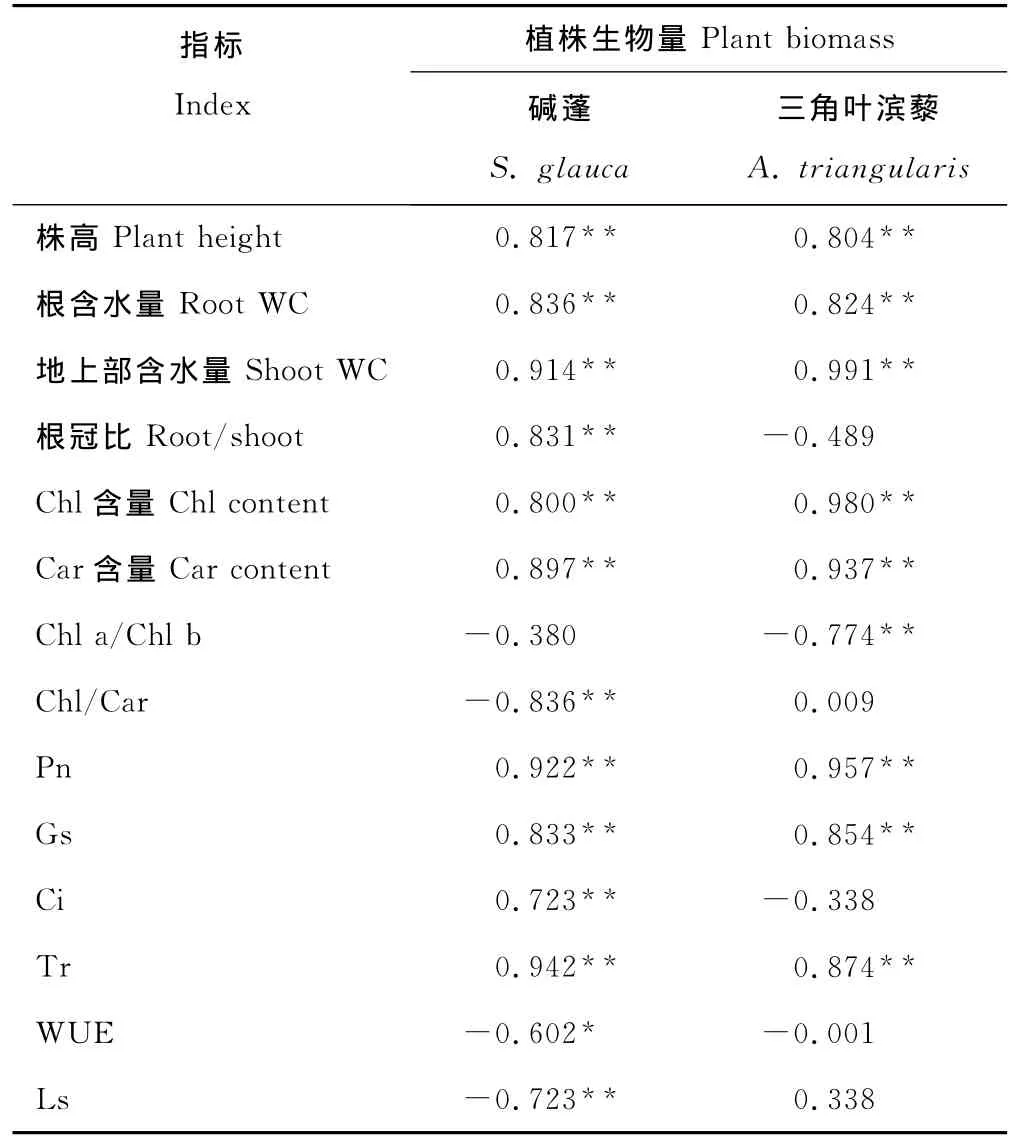
表3 碱蓬和三角叶滨藜幼苗植株生物量与其他指标间的相关性分析Table 3 Correlative coefficients between plant biomass and the other indexes of S.glauca and A.triangularis seedlings
3.3 光合色素和耐盐性
植物在盐逆境和干旱条件下,其Chl随之降解,叶片黄化,光合效率降低,从而抑制植物生长和发育。Car也是光合系统中的基本组件之一,在光吸收、维持类囊体膜稳定性、能量分配、色素-蛋白复合物的降解以及光保持等方面起到重要作用[44]。盐胁迫下Chl含量下降的主要原因是盐胁迫下NaCl提高了叶绿素酶的活性,加速了叶绿素降解,同时抑制了Chl的合成[45]。碱蓬在100 mmol/L NaCl处理下,叶片的Chl含量变化不显著。随着盐浓度的上升,由于受到盐胁迫,植株体内的叶绿素酶等活性增强,从而促进Chl降解。而碱蓬Car含量在100 mmol/L NaCl处理下有一定增加,随着盐度进一步增大,其含量也随之降低。而三角叶滨藜Chl与Car均随着盐度的上升而逐渐下降。环境因子对植物叶片中光合色素含量和比例的任何影响都会影响到植物体对光能的吸收转化和利用[34]。叶片中Chl含量、Chl a/Chl b和类囊体膜蛋白含量下降,是光合作用盐敏感的主要原因之一[33]。Chl a/Chl b代表类囊体的垛叠程度,类囊体的垛叠程度越小,光抑制越强[45]。生殖生长期的水稻在不同盐度(0,25,50,100和200 mmol/L NaCl)处理,其Chl a/Chl b随着盐度升高而增大,作为其对盐胁迫应答的积极响应[46],黑藻(Hydrillaverticillata)在1.5%的盐度处理下9 h,其Chl a/Chl b与对照相比明显下降,其生长也显著抑制[47],碱蓬与三角叶滨藜的Chl a/Chl b随着盐度增加,均逐渐上升,可以认为是高盐胁迫下的一种积极响应,这与高奔等[48]对盐地碱蓬的研究结果一致。
有研究认为Chl/Car对盐处理的响应与植物耐受性有一定的关联,随着盐度升高,最耐盐拂尾藻(Najas gramenia)、较耐盐的度茨藻(Najasindica)和盐敏感的黑藻(Hydrillaverticillata)的Chl/Car均逐渐显著增加,但是越是耐盐的增幅越小[49]。红树林树种对叶榄李(Lumnitzeraracemosa)在高盐胁迫下Chl/Car变化不大[50],2种海滩灌木蜡杨梅(Myricacerifera)和香根菊(Baccharishalimifolia)在不同盐度处理下,Chl/Car变化均不明显[51]。本研究发现,碱蓬和三角叶滨藜的Chl/Car均随着盐度增加而逐渐上升,其中更耐盐的碱蓬增幅较小,与Rout和Shaw[47]的研究结果相类似。
3.4 气体交换参数和耐盐性
盐分胁迫会影响植物的光合作用,导致光合速率的降低,且随着胁迫程度的增强光合速率降低的幅度增大[3,11,25]。盐胁迫下光合作用受抑制是多因素共同作用的结果,包括由气孔关闭引起的气孔限制和抑制酶活力而导致的碳同化能力降低的非气孔限制,或者由组织低盐浓度下气孔关闭和组织内高盐浓度对光合活性的干扰共同作用[52]。目前有关盐胁迫对光合速率的影响针对一些农作物如水稻、玉米和大豆(Glycinemax)等所做的研究较多,结果大都是证实其光合速率都是随着盐浓度的加大而逐渐降低[35,53]。在盐处理下其Pn和Gs一般都会下降;NaCl处理下Pn下降,可能是由于渗透势下降产生的盐度效应使得气孔关闭,和/或NaCl直接产生的对不受气孔关闭影响的光合器官的非气孔抑制[54]。
盐胁迫对植物光合作用的抑制有着多方面的原因,既包括对CO2的吸收、运输及固定的影响,也包括对光能的吸收、转化和电子传递的影响;同时还可能影响原初产物的利用、转运和分配。但由于不同研究者所使用的材料、实验方法的不同,目前还没有一个统一的机理可以解释光合作用下降的原因[55]。本试验结果显示,在高浓度盐胁迫下2种盐生植物碱蓬和三角叶滨藜的净光合速率、气孔导度和蒸腾速率均有所下降,而在低盐浓度处理下,其光能利用能力和二氧化碳同化能力不但不受影响,反而有一定程度的升高,这与王丽燕和赵可夫[53]在美洲海蓬子(Salicorniabigelovii)上的研究相似,其蒸腾速率也与净光合速率有着同样的趋势。在本研究中,碱蓬在100 mmol/L NaCl条件下,Pn、Gs和Tr比对照均有所升高,且植物的株高、干重在该处也达到最大值,说明适当的盐分能促进碱蓬的光合作用。而Chl含量、Car含量、Pn、Gs、Ci和Tr随盐浓度的进一步增大而降低,而Ls随着盐度的增大而上升,说明高盐下影响碱蓬光合作用主要是气孔因素;而三角叶滨藜Ci随着盐度升高先降后升,Ls变化则与Ci相反,表明随着盐度的上升,气孔因素在抑制光合作用中的地位逐渐下滑,而非气孔因素所占比重逐渐上升。
4 结论
综上所述,作为盐生植物,碱蓬和三角叶滨藜幼苗均具有高度的耐盐性,且前者在高盐下具有更高的光合效率和水分利用效率,因而其耐盐性高于后者。相关分析表明,可作为优先评价碱蓬耐盐性的指标依次是Tr、Pn、地上部 WC、Car含量、根 WC、Chl/Car、Gs、根冠比、株高、Chl含量、Ci、Ls和 WUE,而可作为评价三角叶滨藜耐盐性的指标依次为地上部 WC、Chl含量、Pn、Car、Tr、Gs、根 WC、株高和Chl a/Chl b;高盐下碱蓬Pn的下降主要是气孔限制的结果,而三角叶滨藜Pn下降则主要是由于非气孔限制导致的。
[1] 钦佩,周春霖,安树青,等.海滨盐土农业生态工程[M].北京:化学工业出版社环境科学与工程出版中心,2002.
[2] 江苏省908专项办公室.江苏近海海洋综合调查与评价总报告[M].北京:海洋出版社,2012.
[3] 赵可夫,范海.盐生植物及其对盐渍生境的适应生理[M].北京:科学出版社,2005.
[4] Lieth H.Concepts for different uses of halophytes[A].In:Tasks for Vegetation Science-43 Mangroves and Halophytes:Restoration and Utilisation[EB/OL].Springer,2008,43:3-5.
[5] Wagner G N,Balfry S K,Higgs D A,etal.Dietary fatty acid composition affects the repeat swimming performance of Atlantic salmon in seawater[J].Comparative Biochemistry and Physiology-Part A:Molecular &Integrative Physiology,2004,137(3):567-576.
[6] Yang C W,Shi D C,Wang D L.Comparative effects of salt and alkali stresses on growth,osmotic adjustment and ionic balance of an alkali-resistant halophyteSuaedaglauca(Bge.)[J].Plant Growth Regulation,2008,56:179-190.
[7] 柏新富,朱建军,蒋小满,等.盐胁迫下三角叶滨藜根系超滤特性的分析[J].土壤学报,2009,46(6):1121-1126.
[8] 梁飞,田长彦,张慧.施氮和刈割对盐角草生长及盐分累积的影响[J].草业学报,2012,21(2):99-105.
[9] 李圆圆,郭建荣,杨明峰,等.KCl和NaCl处理对盐生植物碱蓬幼苗生长和水分代谢的影响[J].植物生理与分子生物学学报,2003,29(6):576-580.
[10] Song J,Shi G W,Xing S,etal.Effects of nitric oxide and nitrogen on seedling emergence,ion accumulation,and seedling growth under salinity in the euhalophyteSuaedasalsa[J].Journal of Plant Nutrition and Soil Science,2009,172:544-549.
[11] 高奔,宋杰,刘金萍,等.盐胁迫对不同生境盐地碱蓬光合及离子积累的影响[J].植物生态学报,2010,34(6):671-677.
[12] 管博,于君宝,陆兆华,等.黄河三角洲滨海湿地水盐胁迫对盐地碱蓬幼苗生长和抗氧化酶活性的影响[J].环境科学,2011,32(8):2422-2429.
[13] 闰留华,彭建云,陈敏,等.潮间带生境下两种表型盐地碱蓬的抗氧化系统比较[J].植物生理学通讯,2008,44(1):109-111.
[14] Lu C M,Qiu N W,Wang B S,etal.Salinity treatment shows no effects on photosystem II photochemistry,but increases the resistance of photosystem II to heat stress in halophyteSuaedasalsa[J].Journal of Experimental Botany,2003,54:851-860.
[15] 段德玉,刘小京,李存桢,等.N素营养对 NaCl胁迫下盐地碱蓬幼苗生长及渗透调节物质变化的影响[J].草业学报,2005,14(1):63-68.
[16] Yuan J F,Feng G,Ma H Y,etal.Effect of nitrate on root development and nitrogen uptake ofSuaedaphysophoraunder NaCl salinity[J].Pedosphere,2010,20(4):536-544.
[17] Ramos J,López M J,Benlloch M.Effect of NaCl and KCl salts on the growth and solute accumulation of the halophyteAtriplexnummularia[J].Plant and Soil,2004,259:163-168.
[18] 赵福庚,孙诚,刘友良,等.ABA和NaCl对碱蓬多胺和脯氨酸代谢的影响[J].植物生理与分子生物学学报,2002,28(2):117-120.
[19] 卜庆梅,柏新富,朱建军,等.盐胁迫条件下三角滨藜叶片中盐分的积累与分配[J].应用与环境生物学报,2007,13(2):192-195.
[20] 邹日,柏富新,朱建军.盐胁迫对三角叶滨藜根选择性和反射系数的影响[J].应用生态学报,2010,21(9):2223-2227.
[21] 何晓兰,侯喜林,吴纪中,等.三角叶滨藜甜菜碱醛脱氢酶(BADH)基因的克隆及序列分析[J].南京农业大学学报,2004,27(1):15-19.
[22] Flowers T J,Colmer T D.Salinity tolerance in halophytes[J].New Phytologist,2008,179:945-963.
[23] 谭永芹,柏新富,朱建军,等.等渗盐分与水分胁迫对三角叶滨藜和玉米光合作用的影响[J].生态学杂志,2010,29(5):881-886.
[24] 邱念伟,孔甜甜.不规则植物材料单位鲜重光合速率的测定[J].植物生理学报,2011,47(4):406-408.
[25] Parida A K,Das A B.Salt tolerance and salinity effects on plants:a review[J].Ecotoxicology and Environmental Safety,2005,60:324-349.
[26] Ashraf M,Mc Neilly T.Salinity tolerance in Brassica oilseeds[J].Critical Reviews in Plant Sciences,2004,23(2):157-174.
[27] Zheng Q S,Liu L,Liu Z P,etal.Comparison of the response of ion distribution in the tissues and cells of the succulent plantsAloeveraandSalicorniaeuropaeato saline stress[J].Journal of Plant Nutrition and Soil Science,2009,172:875-883.
[28] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2001.
[29] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
[30] Aghaleh M,Niknam V,Ebrahimzadeh H,etal.Salt stress effects on growth,pigments,proteins and lipid peroxidation inSalicorniapersicaandS.europaea[J].Biologia Plantarum,2009,53(2):243-248.
[31] 李珊,陈静波,郭海林,等.结缕草属草坪草种质资源的耐盐性评价[J].草业学报,2012,21(4):43-51.
[32] 彭云玲,李伟丽,王坤泽,等.NaCl胁迫对玉米耐盐系与盐敏感系萌发和幼苗生长的影响[J].草业学报,2012,21(4):62-71.
[33] 刁丰秋,章文华,刘友良.盐胁迫对大麦叶片类囊体膜组成和功能的影响[J].植物生理学报,1997,23(2):105-110.
[34] 王磊,隆小华,孟宪法,等.水杨酸对NaCl胁迫下菊芋幼苗光合作用及离子吸收的影响[J].生态学杂志,2011,30(9):1901-1907.
[35] 王仁雷,华春,刘友良.盐胁迫对水稻光合特性的影响[J].南京农业大学学报,2002,25(4):11-14.
[36] Lokhande V H,Nikam T D,Patade V Y,etal.Effects of optimal and supra-optimal salinity stress on antioxidative defence,osmolytes and in vitro growth responses inSesuviumportulacastrumL.[J].Plant Cell,Tissue and Organ Culture,2011,104:41-49.
[37] Parida A K,Hari Kishore C M,Jha B.Growth,ion homeostasis,photosynthesis and photosystem II efficiency of an obligate halophyte,Salicorniabrachiata,under increasing salinity[J].Plant Biology,2010,13:1-8.
[38] Khan M A,Ungar I A,Showalter A M.The effect of salinity on the growth,water status,and ion content of a leaf succulent perennial halophyte,Suaedafruticosa(L.)Forssk[J].Journal of Arid Environments,2000,45:73-84.
[39] Mori S,Yoshiba M,Tadano T.Growth response ofSuaedasalsa(L.)Pall to graded NaCl concentrations and the role of chlorine in growth stimulation[J].Soil Science and Plant Nutrition,2006,52:610-617.
[40] Munns R.Comparative physiology of salt and water stress[J].Plant,Cell and Environment,2002,25:239-250.
[41] 耿浩林,王玉辉,王风玉,等.恢复状态下羊草(Leymuschinensis)草原植被根冠比动态及影响因子[J].生态学报,2008,28(10):4629-4634.
[42] Díaz-López L,Gimeno V,Lidón V,etal.The tolerance ofJatrophacurcasseedlings to NaCl:An ecophysiological analysis[J].Plant Physiology and Biochemistry,2012,54:34-42.
[43] Rabhi M,Castagna A,Remorini D,etal.Photosynthetic responses to salinity in two obligate halophytes:SesuviumportulacastrumandTecticorniaindica[J].South African Journal of Botany,2012,79:39-47.
[44] Merzlyak M N,Solovchenko A E.Photostability of pigments in ripening apple fruit:a possible photoprotective role of carotenoids during plant senescence[J].Plant Science,2002,163:881-888.
[45] Aro E M,McCaffery S,Anderson J M.Photoinhibition and D1 protein degradation in peas acclimated to different growth irradiances[J].Plant Physiology,1993,103:835-843.
[46] Sultana N,Ikeda T,Itoh R.Effect of NaCl salinity on photosynthesis and dry matter accumulation in developing rice grains[J].Environmental and Experimental Botany,1999,42(3):211-220.
[47] Rout N P,Shaw B P.Salt tolerance in aquatic macrophytes:possible involvement of the antioxidative enzymes[J].Plant Science,2001,160:415-423.
[48] 高奔,宋杰,刘金萍,等.盐胁迫对不同生境盐地碱蓬光合及离子积累的影响[J].植物生态学报,2010,34(6):671-677.
[49] Rout N P,Shaw B P.Salt tolerance in aquatic macrophytes:ionic relation and interaction[J].Biologia Plantarum,2001,44(1):95-99.
[50] Sobrado M A.Leaf characteristics and gas exchange of the mangroveLagunculariaracemosaas affected by salinity[J].Photosynthetica,2005,43(2):217-221.
[51] Zinnert J C,Nelson J D,Hoffman A M.Effects of salinity on physiological responses and the photochemical reflectance index in two co-occurring coastal shrubs[J].Plant and Soil,2012,345:45-55.
[52] Ashraf M.Some important physiological selection criteria for salt tolerance in plants[J].Flora,2004,199:361-376.
[53] 王丽燕,赵可夫.NaCl胁迫对海蓬子(SalicorniabigeloviiTorr.)离子区室化、光合作用和生长的影响[J].植物生理与分子生物学学报,2004,30(1):94-98.
[54] Kao W Y,Tsai T T,Shih C N.Photosynthetic gas exchange and chlorophyll a fluorescence of three wild soybean species in response to NaCl treatments[J].Photosynthetica,2003,41(3):415-419.
[55] 张娟,姜闯道,平吉成.盐胁迫对植物光合作用影响的研究进展[J].农业科学研究,2008,29(3):74-80.
