昆虫美洲大蠊天然产物的研究及其化学分类学意义
2012-04-05尹卫平姜亚玲李鹏飞李文渊
尹卫平,姜亚玲,李鹏飞,李文渊,高 婷
(河南科技大学化工与制药学院,河南洛阳471003)
0 前言
相对于植物化学和海洋生物化学,昆虫次生代谢物是发现天然产物药物来源的一个更为珍稀的研究资源,具有独特的生物活性和多样性特征[1-2]。美洲大蠊(Periplaneta americana)为昆虫纲有翅亚纲蜚蠊目蜚蠊科大蠊属昆虫,俗称蟑螂(见图1)。该蜚蠊科蜚蠊属昆虫,据统计全世界有70多种,热带和亚热带地区比较常见,中国有近30种[1]。中国蜚蠊,已知重要种类有:美洲大蠊、黑褐大蠊、日本大蠊、澳洲大蠊、德国小蠊,均为常见的室内害虫[3]。其中,美洲大蠊在中国分布极广,喜欢在温暖潮湿的场所孳生。前胸、背板淡黄色,背板中部有赤褐至黑褐色的蝶形大斑[4]。

图1 美洲大蠊成虫
大部分的蟑螂都是杂食性,与人类的食性重叠,食物种类非常广泛。部分蟑螂对人类的家居都有很强的入侵性,它们繁殖力强,在人类家居栖身及觅食的同时,蟑螂可携带致病的细菌、病毒、原虫、真菌以及寄生蠕虫的卵,传播多种病原体,可人工感染导致亚洲霍乱、肺炎、白喉、鼻疽、炭疽以及结核等病的细菌,又称病媒害虫。因此,蟑螂是一种世界性卫生害虫,与人类关系密切,危害甚笃。虽然蟑螂携带多种病原体,但一般认为病原体在它们体内不能繁殖,属于机械性传播媒介[5]。
作者在最近有关昆虫化学抗菌活性的研究中[6],发现美洲大蠊的提取物对枯草杆菌表现出抑菌活性。在前期生物活性研究的指导下,本文以美洲大蠊为研究对象,从美洲大蠊的抗菌活性组分中分别分离得到一个新的异黄酮化合物和两个已知的次生代谢化合物,包括一个异黄酮化合物和一个甾醇类化合物,其中,新化合物对革兰氏阳性菌枯草芽孢杆菌(ATCC strain 6633)有明显抗菌活性。并对这些昆虫次生代谢物中的化学分类学意义做了简要讨论。
1 试验材料、仪器与试剂
1.1 仪器与试剂
冷冻干燥机(德国Martin Christ,ALPHA 1-2LD plus);净化工作台(苏州净化,SW-CJ-2G);Waters 600E高效液相色谱仪:梯度二元泵,2487紫外检测器;分析柱:4.6 mm×150 mm,C18,5μm Sunfire;制备柱:10 mm×150 mm,C18,10μm Sunfire柱;Waters自动馏分收集仪。
1.2 试验材料
1.2.1 试验用昆虫
干燥的美洲大蠊成虫,系2010年4月购于安徽亳州人民大药房,由洛阳梓生科技开发有限公司王忠东总工鉴定,样品标本(No:IPA2010-B)存放于河南科技大学天然产物研究室。
1.2.2 分离柱及填料硅胶
柱层析硅胶(试剂级,粗孔zcx-II,200~300目,100~200目,青岛海洋化工厂分厂),薄层层析硅胶(化学纯,HG/T2354—92,GF254,青岛海洋化工厂分厂)。柱规格根据样品的质量进行选择,以达到最佳的分离目的,本试验所用到的层析柱规格有5 cm×100 cm、3 cm×75 cm和2.5 cm×42 cm。
1.2.3 供试菌种和培养基
枯草芽孢杆菌(B.subtilis)ATCC strain 6633和大肠杆菌(E.coli)O157:H7。
2 方法
2.1 粗提物抗菌活性测定
2.1.1 细菌的培养
按照培养基配方称取相应成分的质量,加入到合适的容器中,而后加入蒸馏水搅拌至物质完全溶解,测量pH值,根据测得的pH值大小,加入稀NaOH或稀HCl调节培养基的pH值至7.5。高温灭菌30 min后待用。固体培养基的方法同液体培养基配方,在液体培养基内加入1.2%的琼脂即得。
2.1.2 试验样品及对照品的配制
各种昆虫分别以二氯甲烷浸泡2次,每次2 d,滤出虫体,合并滤液,减压回收溶剂,得昆虫脂溶性成分虫蜡。滤渣虫体被干燥,再次用体积分数为70%的甲醇浸泡2次,每次2 d,合并滤液冷冻干燥后得到昆虫粗提物。将粗提物置超低温(-60℃)冰箱保存备用。
2.1.3 粗提物抑菌活性测定
将上述昆虫粗提物,即70%(体积分数)的甲醇浸膏分别配制成15 mg/mL和30 mg/mL,分别以革兰氏阳性枯草芽孢杆菌(B.subtilis)ATCC strain 6633和革兰氏阴性大肠杆菌(E.coli)O157:H7为受试菌种,70%甲醇溶剂作为空白对照,以青霉素钠盐(浓度分别为1 mg/mL和10 mg/mL)为阳性,测定昆虫提取物抗菌活性,观察并记录抑菌圈大小。
粗提物药敏试验发现,70%甲醇浸膏对革兰氏阳性菌枯草芽孢杆菌(ATCC strain 6633)有抑菌活性,当最小抑菌浓度值分别为30 mg/mL和15 mg/mL时,抑菌圈的直径分别为12 mm和7 mm。美洲大蠊粗提物对革兰氏阴性菌均无敏感性。
2.2 美洲大蠊70%甲醇部位分离纯化
以粗提物抗革兰氏阳性菌活性测定结果为依据,在生物活性的指导下,取70%甲醇提取物5.2 g进行硅胶柱层析分离,依次用CHCl3和CH3OH洗脱剂(w(CHCl3)∶w(CH3OH)=10∶0,9∶1,7∶3,1∶1,3∶7,1∶9,0∶10)进行梯度洗脱,收集每个馏分为30 mL。对各馏分进行薄层色谱分析,合并相同组分,最终得到PⅠ~PⅧ共8个组分。其中PVI组分有固体析出,过滤后,固体用CHCl3-(CH3)2CO重结晶,最终得到一淡黄色无定形粉末,记为化合物1(14 mg)。对组分PⅢ再次进行硅胶柱色谱分离,以EtOAC-CH3OH进行梯度洗脱,至EtOAC-CH3OH(4∶6)时获得经TLC和高效液相色谱分析得到一淡黄色固体化合物2 (12 mg)。对组分PⅠ再次进行硅胶柱色谱分离,当洗脱剂至w(CHCl3)∶w(CH3OH)=9∶1时,得到一白色粉末状物质,记为化合物3(18 mg)。
3 结果与讨论
3.1 纯品化合物的鉴定
化合物1:淡黄色无定形粉末,C26H28O6,HRESI-MSm/z[M+H]+436.188 6(calcd 436.188 2)。核磁共振氢谱信号显示,该化合物在芳区共有7个氢,其中有2个邻偶的dd分裂峰,分别在δH6.66 (dd,2H,J=8.4 Hz)和7.04(dd,2H,J=8.4 Hz);δH7.22(dd,1H,J=6.6 Hz)和7.28(dd,1H,J=6.6 Hz)。另外,有一个孤立的氢信号在δH7.27处,上述氢谱特征揭示该化合物是一个黄酮类的化合物。13C NMR在δC176.9(C-4),153.4(C-2),123.6(C-3)和157.0(C-5)显示可能是一个7,8位取代基的异黄酮结构[7],而且δC130.2(×2,C-2’,C-6’),115.1(×2,C-3’,C-5’)和δC159.2 (C-4’)证明分子中含有对位甲氧基苯在C-1(δC122.0,C-1’)[8-9]与异黄酮的3位相连接。核磁共振二维谱揭示,在HMBC谱图的Me-19到C-12(δC128.3)相关交叉,及Me-20到C-12 (δC128.3)的相关交叉信号,验证了C-7和C-8上取代基的存在。分子中其他相关交叉峰在H-11到C-7,C-8,C-12和C-14示意在C-7和C-8位有一含氧环烷取代基的存在。从H-6到 C-5,C-7和C-8在C-12(δC128.3)相关交叉信号,进一步确证为异戊醇基的存在。
另外,在1HNMR高场区δH4.32~0.82的信号范围,共有10余个氢,显示含有一个含氧环烷取代基的存在[7]。相应的核磁共振碳谱信号在δC72.5(C-O)和δC29.2,29.0(CH3×2),δC129.8和128.3 (-C =C-),可以判断为一个环氧二甲基单环烯碎片的基团的存在[10]。羟基取代的异戊烯取代基信号被归属为δC35.9(CH2),24.1(CH2),63.0(C-OH),24.7(CH3)和20.6(CH3)。因此,比较该类黄酮类化合物骨架结构和文献数据[8,10],确定化合物1的结构,见图2。化合物1被命名为12-(16-羟基,17,18-二甲基)-异戊醇基-13-氧代(19,20-二甲基)-骈[7-8]环氧己烯基-△11,12-3-(4’-甲氧基)-苯基-5-羟基异黄酮。
化合物2:淡黄色固体,C15H10O5,HRESI-MSm/z[M+H]+270.182 0(calcd 270.182 2)。根据数波谱和质谱数据分析,确定化合物2为黄酮类化合物。1H NMR和13C NMR与已知化合物高金雀花碱的光谱数据一致,经过查阅文献并与标准图谱对照,鉴定化合物2为高金雀花碱[8,11],化合物2的结构见图3。该化合物的化学名称为5,7-二羟基-4’-羟基苯基异黄酮。
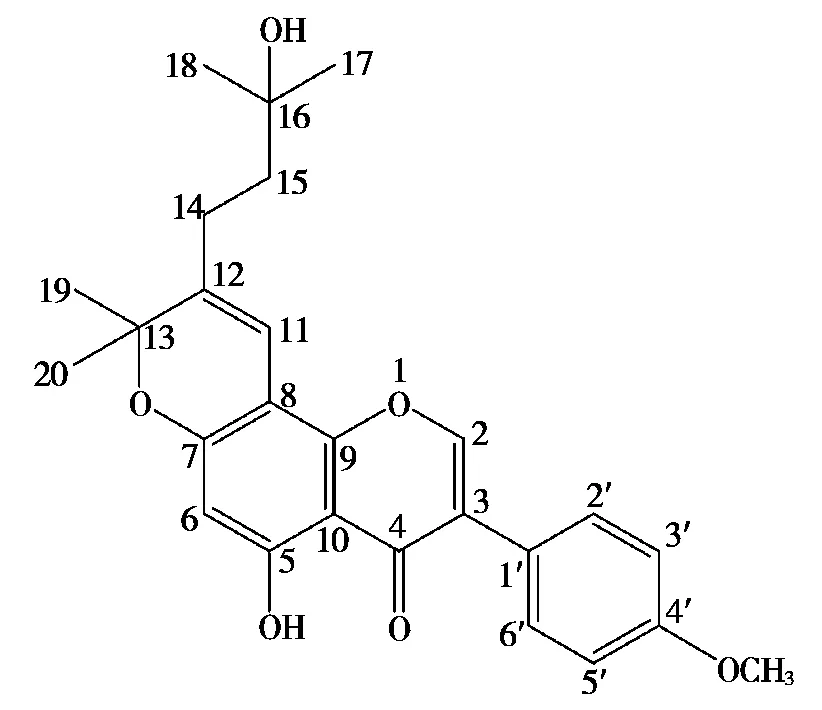
图2 化合物1的结构
化合物3:淡黄色固体,质谱分析HRESI-MS m/z[M+H]+428.432 8(calcd 428.432 6)。确定该化合物分子式为C30H52O。核磁共振氢谱显示1H NMRδH5.35 (d,H-6,H),3.50(m,1H,H-3),1.02(3H,s,H-19),0.68 (3H,s,H-18)揭示出具有典型的甾体化合物的骨架。核磁共振碳谱13CNMR信号在δC140.8(C-5),121.7(C-6),71.8(C-3),11.9(C-18),19.4(C-19),18.8(C-21)与已知3β-OH胆甾-5-烯化合物波谱数据一致[8]。最终确定该化合物为25-甲基-3β-羟基-胆甾-5-烯。该化合物结构见图4。
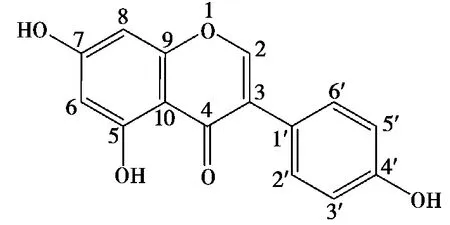
图3 化合物2的结构
3.2 纯品化合物的生物活性测试
对上述3种化合物分别进行药敏抗菌试验。结果发现化合物1对革兰氏阳性菌枯草芽孢杆菌(ATCC strain 6633)有抑菌活性,最小抑菌浓度值为10 mg/mL,抑菌圈的直径为9 mm。3个化合物对革兰氏阴性菌均无敏感性。
3.3 昆虫次生代谢物的化学分类学意义

图4 化合物3的结构
本文从昆虫美洲大蠊中共分离得到3个化合物,他们分别是异黄酮类(化合物1和化合物2)和甾醇类(化合物3)化合物。两个异黄酮化合物中,化合物1是新化合物。作为异黄酮类化合物组分是植物化学研究中较常见的一类化合物。该类化合物尤其在被子植物中分布广泛,包括苋科,桑科,豆科,蔷薇科等植物中。化合物2(高金雀花碱)通常存在于豆科植物中,具有雌激素样作用[12]。此外据报道,高金雀花碱也可以从海洋微生物中获得。甾醇类化合物3也广泛分布于植物中。然而作为昆虫次生代谢物研究,这些化合物均首次在蟑螂中分离得到,也是首次从蜚蠊科昆虫中获得。
基于化合物基源分析调查,众所周知,蟑螂是一种植食性昆虫。综上研究结果表明:从蟑螂中得到的这3个化合物,其分子骨架结构与植物中的次生代谢物是一样的。不可否认,这些小分子代谢物也可能是昆虫从植物中摄取的。在目前阶段,无法证明新的异黄酮衍生物(化合物1)是否存在于植物中,还是由蟑螂自身代谢所产生。然而,此研究有助于阐明植物和昆虫在自然条件下得以共同进化的原理,从而证明昆虫与植物次生代谢物在生态和生物活性上,既具有部分作用或反作用关系,又有与其各自生命活动相关而产生的独特活性物质的修饰表达和衍生的新化合物与植物化学的相关关系。但是作为化学分类学被应用于昆虫学的分类,仍在探索之中。昆虫化学的进一步研究,将分析昆虫天然产物的起源、功能及其次生代谢物的重要生态学,有助于揭示昆虫天然产物分子的生物学分子相关机制和昆虫次生代谢物的生物起源问题。
致谢:感谢郑州大学测试中心的朱卫国教授,对本文中所有化合物的波谱数据的测定。
[1] Aaron T D.Insects and Their ChemicalWeaponry:New Potential for Drug Discovery[J].Nat Prod Rep,2010,27:1737-1757.
[2] Bode H B.Insect-Associated Microorganisms as a Source for Novel Secondary Metabolites[J].Insect Biotech,2011,9:77-79.
[3] Wu F Z.Several Kinds of Cockroach in Chinese Periplaneta Genus and Their Distribution,Growth Characteristics and Economic Importance[J].Acta Entomologica Sinica,1982,25(4):416-422.
[4] Yang H J,Zhang J,Luo W X,et al.Construction and Application of an Efficient,Stable Secretion Prokaryotic Expression Vector[J].Letters in Biotechnology,2003,14(6):494-498.
[5] Lv H S.Insect Viruses and Insect Viruses Diseases[M].Beijing:Science Press,1982:125-128.
[6] Song Z W,Liu P,Yin W P,et al.Isolation and Identification of Antibacterial Neo-compounds From the Red Ants of ChangBai Mountain,Tetramorium sp[J].Bio Med Chem Lett,2012,22:2175-2181.
[7] Chari V M,Wagner H,Neszmelyi A.Flavonoids and Bioflavonoids[M].Amsterdam:Eisevier Publishing Co,1977:49.
[8] 于德泉,杨俊山.分析化学手册第七分册,核磁共振波谱分析[M].北京:化学工业出版社,1999.
[9] Patra A,Mitra A K.Carbon-13 NMR Signals of Some Natural Coumarins and Their Derivatives[J].Org Magn Reson,1981,17:222-224.
[10] Iinuma M,Yokoyama J,Ohyama M,et al.Eight Phenolic Compounds in Root of Sophora Exigua[J].Phytochemistry,1994,35(3):785-789.
[11] Jha H C,Zilliken F,Breitmaier E.Carbon-13 NMR Shifts and Carbon-hydrogen Coupling Constants of Deoxybenzoins and Related Acetophenones[J].Can JChem,1980,58:1211-19.
[12] 史芳,李清,陈晓辉,等.黄芩配伍知母后黄芩中主要黄酮类成分的含量变化[J].中国实验方剂学杂志,2011,17 (17):84-87.
