EPO对Aβ1-42所致AD样大鼠空间记忆的影响及作用机制
2012-03-20尚俊杰李宜培
尚俊杰,李宜培,王 黎,△
(1.郑州大学基础医学院,郑州450052;2.河南职工医学院,郑州451191)
阿尔茨海默病(Alzheimer’s disease,AD)是老年人常见的中枢神经退行性疾病,随着我国老龄化社会的到来[1],此病得到越来越多的重视。其主要临床表现为认知障碍与记忆力减退,病理改变主要为细胞外的老年斑沉积、细胞内神经原纤维缠结以及胆碱能神经元数目减少等。关于AD的发病机制目前仍不清楚,但大多数学者认为神经细胞外Aβ沉积是引起AD的重要机制之一,因此在实验中常采用在动物海马或脑室注射Aβ的方法复制病理模型。促红细胞生成素(erythropoietin,EPO)是哺乳动物调节红细胞生成的主要调控因子,近年来,发现其除了造血功能作用外,还有其他许多重要作用,尤其是在神经保护方面的作用近年来得到越来越多的证实,但关于其对阿尔茨海默病的保护机制方面的研究还鲜见报道。本研究通过海马部位注射Aβ的方法建立动物模型,探讨EPO对AD样大鼠学习记忆能力的影响及其可能的分子机制。
1 材料与方法
1.1 材料 动物与分组:健康成年雄性Wistar大鼠48只,体质量270~320克,清洁级,批号 XCXK (豫)2010-0002,河南省实验动物中心提供。将其按随机数字表法分为4组:生理盐水组、AD模型组、EPO治疗组及脑复康对照组。每组各12只。
1.2 主要仪器与设备 Morris水迷宫测试系统(中国医学科学院);脑立体定位仪(淮北正华生物仪器厂);分光光度计(北京普析通用仪器有限公司);电泳仪及图像采集分析系统(Bio-Rad公司);高速冷冻离心机(eppendorf公司);Aβ1-42(Sigma公司); rHu-EPO(上海凯茂生物医药有限公司);脑复康注射液(山东威高药业有限公司);兔抗synapsin1多克隆抗体(Santa Cruz公司);兔抗β-actin多克隆抗体(Santa Cruz公司);动物组织总蛋白抽提试剂(Pierce公司);ECL化学发光试剂盒(Pierce公司);辣根过氧化物酶标记的二抗(Santa Cruz公司);显影定影试剂盒(武汉博士德公司)。
2 实验方法
2.1 Aβ孵育 将1 mgAβ1-42溶于200μL PBS,稀释为5μg/μL的浓度,置于37℃恒温箱中连续孵育12 d,使蛋白充分伸展形成聚合态,然后4℃保存使用,忌反复冻融。
2.2 AD模型建立 用6%水合氯醛腹腔注射麻醉大鼠(300~360 mg/kg),然后将其固定于脑立体定位仪上。头顶部备皮,依次用碘伏和75%乙醇消毒。晾干后以眼眶后缘连线为起点,用手术刀片沿颅骨正中线向后切开头皮约1~1.5 cm。用眼科镊分离皮下骨膜,找到前囟,参照Pellegrino和Cushman合著的《大鼠脑立体定位图谱》[2]定位。定位方法为:以前囟为原点,向后4.0mm,中线旁2.0~2.5mm,颅骨面下进针3.0~3.5 mm。用微量进样器施行注射,每只大鼠注射2μL,缓慢注射10 min,然后原位留针10 min,使溶液充分弥散后缓慢撤针,骨蜡封闭针孔,缝合消毒。生理盐水组按照AD模型组方法在海马注射生理盐水2μL。rHu-EPO治疗组及脑复康对照组则是在大鼠模型的基础上,术后分别腹腔注射EPO和脑复康,剂量为rHu-EPO 5 000ΙU/kg,隔日一次;脑复康为40 mg/kg,每日一次。
2.3 Morris水迷宫测试 术后第二周进行行为学测试。Morris水迷宫[3]由一个不锈钢圆柱形水池和一个可移动的有机玻璃站台组成,测试数据由水迷宫图像采集和分析系统采集完成。迷宫水池高60cm,直径120 cm,人为将其分为I、Ⅱ、Ⅲ、Ⅳ四个象限。有机玻璃站台直径15cm,高40cm,测试水位深度以高出平台约2 cm为宜。测试时以布包裹平台,以使大鼠在找到后能顺利爬上平台。测试水温保持在(28±2)℃,平台居于其中一个象限的中央位置,实验在光线柔和的安静环境中进行,全部试验条件在测试过程中应始终保持不变。每天定时从第Ⅰ象限开始,按顺时针顺序依次从4个象限入水各测试一次,大鼠入水瞬间立即打开图像采集软件记录游泳轨迹和时间。当大鼠找到并且爬上平台时停止记录。大鼠寻找平台的时间为潜伏期。每次测试时间为60 s。若大鼠在60 s内找不到平台,则记录为60 s。测试连续进行5 d,以每只大鼠毎天四个象限测试的平均时间长短反映其学习记忆能力。
2.4 Western blot蛋白印迹实验 水迷宫第五天测试结束后,随机从每组取6只大鼠,麻醉后立即断头,在冰上剥离海马,称重。按照重量的9倍体积加入动物组织总蛋白提取试剂、酶蛋白抑制剂PMSF (10μmol/ml)、磷酸化酶抑制剂NaF进行充分匀浆。然后进行离心(12 000 r/min,4℃,10 min),取上清,利用bradford法测定蛋白含量。加入5×上样缓冲液加热变性10 min上样,每孔加样5μL(约30 μg)进行SDS PAGE凝胶电泳(5%浓缩胶,12%分离胶),电泳约2 h。然后将分离的蛋白转移至硝酸纤维素膜(NC膜)上,Western封闭液37℃封闭1 h。加一抗(抗体稀释液用Western封闭液,1∶1 000),4℃孵育18 h。PBS漂洗10 min 3次。然后加HRP标记二抗(稀释液用TBS,1∶4 000),室温孵育过夜。ECL发光液显色,X光胶片显影。Western blot蛋白印迹图像分析使用QuantityOne1.D分析软件(Bio-Rad ChemiDoxXRS凝胶成像系统)。
3 统计学处理
由于数据为非正态资料,故用多个独立样本的非参数检验(Kruskal-Wallis检验),采用SPSS 11.0软件进行统计学处理。进一步两两比较采用排秩后单因素方差分析,以(P≤0.05)有统计学意义。
4 结果
4.1 AD大鼠Morris水迷宫空间记忆能力测试从表l可见各组大鼠随着学习次数的增加,寻找平台潜伏期均有所减少。在第2、3、4、5天的成绩中,AD模型组潜伏期时间与生理盐水组、rHu-EPO治疗组及脑复康对照组相比均明显延长,差异均有统计学意义(P<0.05)。rHu-EPO治疗组与脑复康对照组相比差异无统计学意义。第5天与第l天相比,各组大鼠的潜伏期时间都明显缩短,但AD模型组的潜伏期时间从第2天开始不再发生明显变化,而生理盐水组、rHu-EPO治疗组及脑复康对照组均逐步下降。由于大鼠第l天迷宫测试对环境生疏,为减少由此造成的误差,故选用相对稳定的第2天成绩做对照。从表l可见,第5天与第2天的潜伏期时间相比较,AD模型组无明显差异,而生理盐水组、rHu-EPO治疗组及脑复康对照组第5天的潜伏期时间较第2天明显缩短,差异均有统计学意义(P<0.05)。如图1上方显示第5天各组大鼠寻找平台的轨迹图,与AD模型组相比,生理盐水组、rHu-EPO治疗组及脑复康对照组寻找路线均明显缩短。

图1 与组内第2天与第5天相比P<0.05
表1 各组大鼠Morris水迷宫测试结果(±s,t/s,n=12)

表1 各组大鼠Morris水迷宫测试结果(±s,t/s,n=12)
注:与生理盐水组比较,1)P<0.05;与模型组比较,2)P<0.05。
组别 第1天 第2天 第3天 第4天 第5天 χ2 P值生理盐水组 21.49±7.37 20.36±8.04 7.24±5.44 11.38±9.357.80±2.72 22.49 0.005模型组 21.46±5.38 30.19±18.14 12.44±8.431) 14.56±17.361) 16.68±17.271) 7.28 0.063 rHu-EPO组 16.94±6.33 16.93±5.89 5.42±2.512) 6.68±4.362) 5.65±8.222) 14.77 0.002脑复康组 16.83±13.40 16.33±11.50 5.02±4.002) 6.30±3.272) 5.26±3.032) 20.49 0.000 χ2 4.69 6.33 7.90 10.44 13.33 P值0.196 0.096 0.048 0.015 0.004
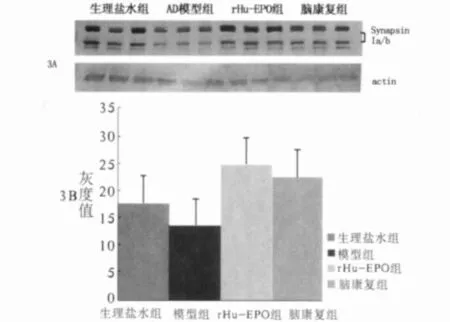
图3 各组大鼠海马神经元中synapsinl蛋白表达Western blot检测结果rHu-EPO治疗组、脑复康对照组、生理盐水组三者之间比较,P>0.05;rHu-EPO治疗组及脑复康对照组与AD模型组比较,P<0.05 3A:Western blot条带;3B:Synapsin1蛋白表达的柱状图
4.2 Western blot检测synapsinl蛋白的表达变化如图3所示:各组海马组织中均可见synapml蛋白表达。与生理盐水组相比,AD模型组表达略减少,但差异无统计学意义;与AD模型组相比,rHu-EPO治疗组及脑复康对照组synapsinl蛋白表达明显增加,差异有统计学意义(P<0.05)。
5 讨论
本实验采用国内外常用的AD模型制作方法[4-5],即利用脑立体定位仪向海马部位注射凝聚态Aβ1-42,在术后第八天做Morris水迷宫试验。结果显示:与生理盐水组相比,AD模型组潜伏期明显延长,说明AD模型组的学习记忆能力受损。生理盐水组大鼠通过连续5 d的学习,使找到平台的潜伏期持续缩短,表明具有策略性、定位准确,轨迹图由环绕型变为直线型。AD模型组第5天的潜伏期与第2天相比没有差异,轨迹图显示在第5天搜索平台路线还是环绕型,缺乏策略性、定位不准确,说明其学习记忆能力下降。
关于rHu-EPO神经保护作用的研究国内外已经有一定的报道[6-13],但其在实验动物中的神经保护机制还不明确。本实验发现rHu-EPO治疗组及脑复康对照组与AD模型组相比潜伏期时间显著缩短,搜索策略性强,定位明确,说明rHu-EPO可以改善由Aβ1-42所致AD大鼠的空间记忆能力的损害,推测rHu-EPO具有一定的提高学习记忆能力的作用。synapsinl是一种神经元特异的磷蛋白,分为synapsinla和synapsinlb两种亚型。synapsinl蛋白表达不仅在海马结构的形成及功能可塑性起到一定作用[14],而且在突触发生、突触囊泡运输及神经递质释放过程中也起到重要的调节作用。研究证实AD患者新皮层和海马神经元轴突及树突萎缩,突触减少是患者出现痴呆的主要原因。本实验研究发现:与生理盐水组相比,AD模型组海马组织中synapsinl蛋白表达降低,是由于Aβ1-42对神经元的毒性作用,间接抑制了synapsin1蛋白表达。rHu-EPO治疗组与AD模型组相比synapsin1蛋白表达显著增加,说明rHu-EPO具有拮抗Aβ1-42对神经元毒性作用,增加synapsinl蛋白表达,引起递质释放增加,提高突触传递能力,这可能是rHu-EPO改善AD大鼠学习记忆能力的另一个机制;另外rHu-EPO治疗组与生理盐水组相比,rHu-EPO治疗组synapsinl蛋白表达增加,提示rHu-EPO对正常大鼠也有促进synapsinl蛋白表达的作用。rHu-EPO可以改善大鼠由Aβ1-42引起的学习记忆障碍,提高学习记忆能力,这与增加synapsinl蛋白表达促进突触发生有关,其深层机制仍有待进一步探索。
[1] 程 琦,程晓娟,姜国鑫.我国阿尔茨海默病流行病学研究[J].内科理论与实践,2007,2(02):70-74.
[2] Pellegrino LJ,Cushman AJ,Pellegrino AS.A stereotaxic atlas of the rat brain[J].1967.
[3] 陈罗西,郭玲玲,李 亮.Morris圆形水迷宫的应用及其相关检测指标分析[J].辽宁中医药大学学报,2008,10(08):55-57.
[4] Frautschy SA,Yang F,Calderon L,et al.Rodent models of Alzheimer's disease:rat A beta infusion approaches to amyloiddeposits[J].Neurobiol Aging,1996,17(2):311-321.
[5] Dodart JC,May P.Overview on rodentmodels of Alzheimer's disease[J].Curr Protoc Neurosci,2005,Chapter 9:Unit9.22.
[6] 曾 志,周卓妍,宋燕燕,等.促红细胞生成素对新生大鼠缺氧缺血性脑损伤神经保护作用的研究[J].2011,76(2):155-159.
[7] 陈 涛,章军建,余 芬,等.促红细胞生成素对慢性脑缺血大鼠空间学习记忆能力的影响[J].武汉大学学报(医学版),2006,49(02):225-228+279.
[8] 陈 达,王斯闻,朱 杰,等.促红细胞生成素对脑出血神经生长因子表达的影响[J].中国医学工程,2010,9(04):41-42.
[9] Morishita E,Masuda S,Nagao M,etal.Erythropoietin receptor is expressed in rat hippocampal and cerebral corticalneurons,and erythropoietin prevents in vitro glutamate-induced neuronal death[J].Neuroscience,1997,76(1):105-116.
[10] Sinor AD,Greenberg DA.Erythropoietin protects cultured cortical neurons,but not astroglia,fromhypoxia and AMPA toxicity[J].Neurosci Lett,2000,290(3):213-215.
[11] Siren AL,Fratelli M,Brines M,et al.Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress[J].Proc Natl Acad Sci U SA,2001,98(7):4 044-4 049.
[12] Digicaylioglu M,Lipton SA.Erythropoietin-mediated neuroprotection involves cross-talk between Jak2 andNF-kappaB signalling cascades[J].Nature,2001,412(6 847):641-647.
[13] Villa P,Bigini P,Mennini T,et al.Erythropoietin selectively attenuates cytokine production and inflammation incerebral ischemia by targeting neuronal apoptosis[J].Exp Med,2003,198 (6):971-975.
[14] Holgado A,Ferreira A.Synapse formation proceeds independently of dendritic elongation in culturedhippocampal neurons[J].Neurobiol,2000,43(2):121-131.
