饲粮中添加海南霉素对奶牛瘤胃发酵及甲烷产量的影响
2012-03-14段春宇张永根辛杭书王志博李富国
段春宇 张永根 辛杭书 王志博 夏 科 李富国
(东北农业大学动物科学学院,哈尔滨 150030)
甲烷是反刍动物瘤胃正常消化的产物,瘤胃内排放的甲烷量占甲烷排放总量的15%~25%,由此引起的温室效应约占全球温室效应的2%[1];瘤胃内甲烷的排放也会造成能量的浪费,据报道,反刍动物甲烷排放损失的能量占到饲料摄入能量的2% ~12%[2]。因此,如何减少反刍动物瘤胃内甲烷的生成已成为反刍动物营养学研究的重点。
调控瘤胃甲烷生成的因素较多,应用比较广泛的是在饲粮中添加离子载体,如莫能菌素、拉沙里霉素等,它们可以改变瘤胃发酵模式,增加丙酸产量,降低乙酸与丙酸的比值,并能有效降低甲烷产量,从而有效提高饲料的能量利用率[3-4]。海南霉素是中国科学院上海药物研究所近年研制的国内第1个羧基型聚醚类离子载体,它与瘤胃素、盐霉素结构相似,与莫能菌素有许多共同之处,是一种新型的反刍动物饲料添加剂[5]。据报道,海南霉素具有保护瘤胃肽和可溶性蛋白质的作用[6],并能改变山羊瘤胃发酵类型,显著提高丙酸比例,抑制饲料蛋白质在瘤胃内的降解[7];在体外发酵试验中,有效减缓瘤胃pH下降,减少产气量,减少氨态氮(NH3-N)的浓度,降低乙酸与丙酸比值等[8]。但海南霉素在奶牛生产中的应用效果还鲜有报道,基于此,本试验旨在通过研究奶牛饲粮中添加海南霉素对其瘤胃发酵模式及甲烷产量的影响,为海南霉素在反刍动物饲养中的有效利用提供理论依据。
1 材料与方法
1.1 试验动物与饲粮组成
试验选用3头体重约为500 kg、安装有永久性瘤胃瘘管的健康荷斯坦奶牛。基础饲粮组成及营养水平见表1,基础饲粮精粗比为50∶50。海南霉素:纯度≥90%(山东胜利股份有限公司);莫能菌素:纯度≥90%(美国礼来公司)。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet(DM basis) %
1.2 试验设计
试验采用3×3拉丁方试验设计。试验设负对照组(不添加任何添加剂)、正对照组(添加10 mg/kg莫能菌素)和海南霉素组(添加7.2 mg/kg海南霉素)。每期试验预试期10 d,正试期 5 d,共 15 d。
1.3 饲养管理
试验于东北农业大学香坊试验基地进行。试验牛拴系饲养,每天饲喂2次(08:00和20:00),先粗后精,自由饮水。将海南霉素和莫能菌素分别添加在精料中,混匀饲喂,每天观察并记录牛只采食情况。
1.4 样品采集
试验期第 1、2 天晨饲后0、2、4、6、8 和10 h 采集瘤胃液,2层纱布过滤,一部分采集后用于pH及NH3-N的测定,另外准确量取4 m L采集的瘤胃液和1 m L 25%偏磷酸于10 m L的离心管中,用于测定挥发性脂肪酸(VFA)的浓度,样品均置于-20℃冷冻保存。试验期第4、5天用呼吸面罩收集呼出的气体,每日于晨饲后 0、2、4、6、8和 10 h测定6次,每次10 m in,气体总量用 SAILSORS V10FC-VM流量计(北京塞尔瑟斯仪表科技有限公司)计数[9-11]。用气相色谱仪分析气体中甲烷的含量。
1.5 样品分析
1.5.1 pH 的测定
取出瘤胃液后,用Sartorius PB-10型酸度计(赛多利斯科学仪器北京有限公司)立即测定pH。
1.5.2 瘤胃液NH3-N的测定
取出瘤胃液后,用奥立龙ORION EA-940双通道专业型离子浓度(ISE)测定仪(上海硕光电子科技有限公司)测定瘤胃液中NH3-N的浓度。
1.5.3 瘤胃VFA 的测定
用岛津GC-2010气相色谱仪进行测定。以Erw in等[12]建立的方法为依据,并对色谱柱的选择和色谱操作条件进行了优化。
1.5.3.1 样品处理
将冷冻保存的样品放在4℃冰箱中解冻,离心(5 400 r/m in,10 m in)去除饲料颗粒和杂质,在1.5 m L离心管内加入1 m L离心上清液,再次离心(10 000 r/m in,10 m in),去除样品中蛋白质沉淀物,取上清液待用。
1.5.3.2 色谱条件
汽化室参数:载气为N2,分流比40∶1,进样量0.4μL,温度 220 ℃;色谱柱参数:HP-INNOW ax毛细管色谱柱恒流模式,流量2.0 m L/min,平均线速度38 cm/s;柱温箱参数:程序升温120℃(3 m in)—10℃/m in—180℃(1 m in);检测器参数:H2流量40 m L/m in,空气流量450 m L/m in,柱流量+尾吹气流量45 m L/m in,氢火焰离子化检测器(FID)温度250℃。
1.5.4 气样成分的检测
用岛津GC-14C气相色谱仪测定[13]。色谱条件为检测器:热导检测器(TCD);色谱柱:填充柱TDX-01;测定条件:柱温 150℃,检测器180℃,进样口温度 180℃,载气为 N2,流速30 m L/m in,进样量200μL。测定气袋收集的气体中甲烷含量。
1.6 数据统计
所有数据经Excel整理后,采用SAS 9.1软件包进行数据统计分析,并用混合模型(m ixed procedure)进行多重比较,P<0.05为差异显著。
2 结果
2.1 饲粮中添加海南霉素对奶牛瘤胃发酵模式的影响
2.1.1 饲粮中添加海南霉素对奶牛瘤胃pH的影响
由表2可见,与负对照组相比,海南霉素和莫能菌素只在采食后2 h显著提高了奶牛瘤胃内pH(P <0.05),其余时间影响均不显著(P >0.05)。各组试验牛的瘤胃pH都呈现相似的变化趋势,即采食后pH开始逐渐下降,降至最低点后缓慢上升,到饲喂后10 h pH基本接近饲喂前水平。在整个试验期内,各组试验牛的瘤胃pH维持在6.38~6.69。

表2 饲粮中添加海南霉素对奶牛瘤胃pH动态变化的影响Table 2 Effects of dietary hainanmycin on dynam ic changes of rumen pH in dairy cows
2.1.2 饲粮中添加海南霉素对奶牛瘤胃内NH3-N浓度的影响
由表3可见,各组NH3-N浓度在饲喂后2 h达到最高值,随着时间的延长,NH3-N浓度先下降后上升。在采食后0、2、8、10 h,海南霉素组和正对照组的NH3-N浓度均显著低于负对照组(P<0.05);在采食后6 h,海南霉素和莫能菌素均有抑制NH3-N释放的趋势,但差异不显著(P=0.06)。

表3 饲粮中添加海南霉素对奶牛瘤胃NH 3-N浓度动态变化的影响Table 3 Effects of dietary hainanm ycin on dynam ic changes of rumen ammonia concentration in dairy cows mg/dL
2.1.3 饲粮中添加海南霉素对奶牛瘤胃内VFA的影响
由表4可知,海南霉素和莫能菌素对瘤胃总挥发性脂肪酸浓度的影响不显著(P>0.05);海南霉素组和正对照组的奶牛在采食后0、2、4和6 h,乙酸浓度及乙酸与丙酸的比值都显著低于负对照组(P<0.05),丙酸浓度显著高于负对照组(P<0.05),但在采食后8 h,以上指标均无显著差异(P>0.05),在采食后10 h,除海南霉素组丙酸浓度比负对照组显著提高外(P<0.05),其他指标均无显著影响(P>0.05);除采食后0 h,莫能菌素显著降低了丁酸浓度(P<0.05)外,海南霉素和莫能菌素对瘤胃内丁酸浓度无显著影响(P>0.05)。
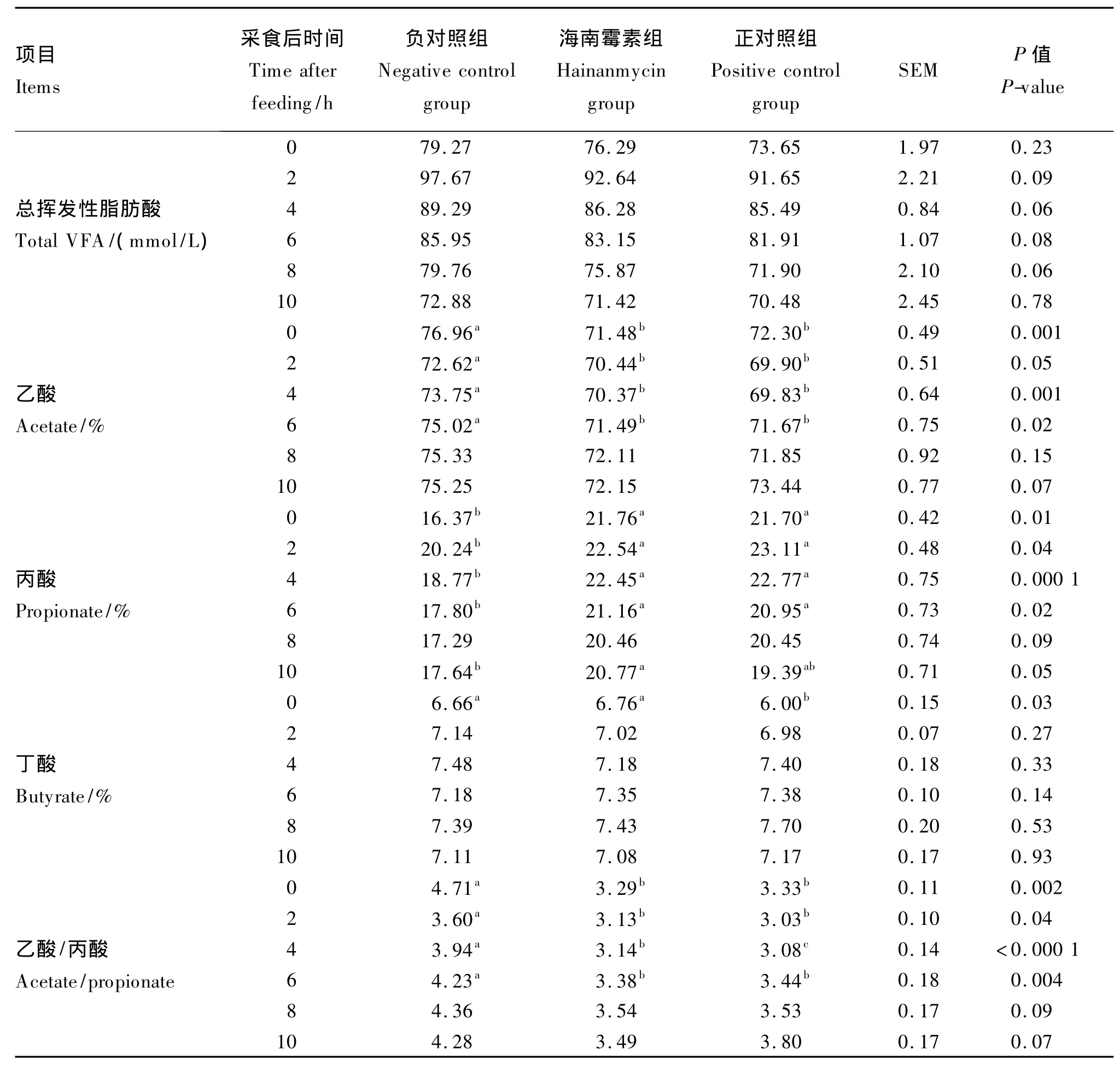
表4 饲粮中添加海南霉素对奶牛瘤胃VFA浓度动态变化的影响Table 4 Effects of dietary hainanm ycin on dynam ic changes of volatile fatty acid(VFA)concentration in rumen of dairy cows
2.2 饲粮中添加海南霉素对奶牛瘤胃甲烷产量的影响
从表5可以看出,3个组的甲烷排放量以负对照组最高为251.83 L/d,海南霉素组和正对照组显著低于负对照组(P<0.05),分别比负对照组降低14.03%和16.98%,但二者之间无显著差异
(P>0.05)。甲烷排放损失的能量与每天甲烷的产生量有相同的变化趋势,负对照组甲烷排放损失的能量最多,占奶牛摄入能量的7.63%,而海南霉素组和正对照组分别比负对照组降低13.50%和16.64%。每采食1 kg干物质的甲烷排放量(L/DM I)以负对照组最高为34.06 L,海南霉素组居中为 29.46 L,正对照组最少为28.39 L,海南霉素组和正对照组之间差异不显著(P>0.05),与负对照组差异显著(P<0.05)。

表5 饲粮中添加海南霉素对奶牛瘤胃甲烷产量的影响Table 5 Effects of dietary hainanmycin on rumen methane production of dairy cow s
3 讨论
3.1 饲粮中添加海南霉素对奶牛瘤胃发酵模式的影响
3.1.1 饲粮中添加海南霉素对奶牛瘤胃 pH的影响
相对稳定的瘤胃内环境是瘤胃微生物发挥正常功能的必要条件,pH的高低均可影响瘤胃微生物的生长、发育和发酵类型。卢德勋[14]指出促进纤维消化的适宜瘤胃液pH范围为6.0~6.8,低于6.2时,纤维分解菌的生长就会受到抑制。本试验奶牛在饲喂后10 h内,瘤胃pH变化范围为6.38~6.69,均处于正常值范围内。并且在饲喂后2 h,海南霉素组和莫能菌素组的瘤胃pH都显著高于负对照组,这说明海南霉素与莫能菌素相似均能减缓瘤胃pH的降低,这与先前的体外试验结果相似[8];同时,有研究表明,在高精料饲粮条件下,莫能霉素通过影响VFA的浓度来改变瘤胃pH,在一定程度可缓解高峰期奶牛饲喂高精料饲粮造成的酸中毒[15];李炯明[16]指出,海南霉素可以提高山羊瘤胃液的pH,本研究表明海南霉素只在采食后2 h pH高于负对照组,海南霉素对奶牛瘤胃pH的影响与对山羊瘤胃pH的影响有一定的不同。
3.1.2 饲粮中添加海南霉素对奶牛瘤胃内NH3-N的影响
反刍动物瘤胃内的NH3-N是瘤胃内饲料蛋白质、内源性蛋白质和非蛋白氮等分解的终产物,在能量和碳源充足的情况下,它是瘤胃微生物合成菌体蛋白质的主要氮源[17]。从本试验的结果来看,海南霉素与莫能菌素均显著降低了瘤胃中NH3-N的浓度,这与李炯明等[8]的体外试验结果相一致,也与李炯明[16]和任明强等[18]的试验中海南霉素对山羊瘤胃发酵的影响的结果一致。Whetstone等[19]在阉公牛饲粮中加入33 mg/kg的莫能菌素可显著增加过瘤胃蛋白质的量,氨气产生量也大幅度减少。Martineau等[20]也发现莫能菌素能降低瘤胃NH3-N的浓度,提高粗蛋白质的消化率。离子载体能减少瘤胃中氨的产生,增加非NH3-N的产量,部分原因是一些产氨菌对离子载体敏感并受到抑制,其产氨作用受到限制[21]。
本试验中各组NH3-N的浓度先升高,然后缓慢降至最低,最后又略有升高,由于在采食后,饲料消化产生大量的NH3-N,致使其浓度迅速上升至最高,但随着瘤胃微生物的利用,NH3-N的浓度逐渐降低至最低,之后又开始上升,可能是因为当NH3-N的浓度降到一定程度时,不足以维持瘤胃细菌的生长和维持,使其发生自身裂解,释放出一些NH3-N,所以使NH3-N的浓度又略有回升。
3.1.3 饲粮中添加海南霉素对奶牛瘤胃内VFA的影响
VFA的产量和组成比例是评述瘤胃发酵方式和发酵能力的直接指标。VFA是反刍动物能量利用的主要形式,其主要由乙酸、丙酸和丁酸组成。其中丙酸在VFA中所占比例对反刍动物生产性能有重要影响[8]。在本试验中,海南霉素和莫能菌素均降低了乙酸浓度,增加了丙酸生成,使瘤胃发酵趋向于丙酸型发酵,却没有改变总挥发性脂肪酸的浓度,这与李新建等[22]、Guan 等[23]和欧宇等[24]报道的结果一致,其原因是莫能菌素改变了瘤胃微生物区系,主要是产乙酸的革兰氏阳性菌特异性减少,产丙酸的革兰氏阴性菌数量增加,从而导致了较高的丙酸与乙酸的比例[11];李炯明[16]和任明强等[18]的试验结果表明海南霉素可降低山羊瘤胃乙酸浓度,提高丙酸浓度,降低乙酸与丙酸的比值,本试验结果与以上结果相同。
3.2 饲粮中添加海南霉素对奶牛瘤胃甲烷产量的影响
甲烷的产生主要来源于瘤胃发酵,它由瘤胃碳水化合物发酵产生的CO2和H2所合成。甲烷的产生和排放既会加剧温室效应又会造成饲料能量的浪费。因此,降低瘤胃甲烷的生成非常重要,本试验结果表明,在奶牛饲粮中添加海南霉素可以显著降低甲烷的生成,且与莫能菌素相比,二者在抑制甲烷生成上没有差异。众多报道表明,莫能菌素能显著降低反刍动物瘤胃甲烷的生成[25-27]。莫能菌素抑制瘤胃中甲烷产生的原因有以下2点,其一是它使瘤胃发酵趋向于丙酸型发酵,丙酸的生成竞争性地消耗了甲烷生成的前体物质CO2和H2,随着丙酸的增加,合成甲烷的前体物质减少,从而间接减少了甲烷的生成[28-29];其二是它通过抑制瘤胃中产 CO2和 H2的细菌,减少了生成甲烷的主要反应物,从而间接抑制甲烷的产生[30]。
本试验中,海南霉素显著降低了甲烷的产生量,因而也显著降低了甲烷排放损失的能量,显著提高了能量的利用率。
4 结论
①饲粮中添加海南霉素使奶牛的瘤胃发酵类型更趋向于丙酸型发酵。
②饲粮中添加海南霉素能显著降低奶牛甲烷的产量,有效地提高了能量的利用率。
[1] JOHSON D E,HILL T M,CARMEAN B R,et al.New perspectives rum inantmethane em issions[M]//WENK C,BOESSINGER M.Energy metabolism of farm animal.Sw itzerland:EAAP Publication,1991:376-379.
[2] JOHSON K A,JOHSON D E.Methane em issions from cattle[J].Journal of Animal Science,1995,73(8):2483-2492.
[3] GOODRICH R D,GARRETT J E,GAST D R,et al.Influence of monensin on the performance of cattle[J].Journal of Animal Science,1984,58(6):1484-1485.
[4] 宁豫昌,陈忠杰,郭宏伟,等.莫能菌素的应用现状[J].郑州牧业工程高等专科学校学报,2007,27(3):21-24.
[5] 陈杰,陆天水,朱祖康.海南霉素调控反刍动物消化代谢提高生产性能的研究[G]//动物生理生化学分会第八次学术会议暨全国反刍动物营养生理生化第三次学术研讨会论文摘要汇编.长春:中国畜牧兽医学会动物生理生化学分会,2004:6.
[6] 沈赞明,陈杰,任明强.海南霉素对山羊瘤胃内肽的保护作用[J].南京农业大学学报,2004,27(4):73-76.
[7] M INGQIANG R,ZANM ING S,RUQIAN Z,et al.Effects of novel polyether ionophore hainanmycin on nutrient digestion,metabolism and rum inal characteristics of goats[J].Journal of Animal and Feed Sciences,1998,7(1):21-28.
[8] 李炯明,庄苏,王恬,等.海南霉素对人工瘤胃体外发酵调控的影响[J].家畜生态学报,2007,28(1):41-46.
[9] 韩兴泰,谢敖云,胡令浩.牦牛甲烷气的产量[J].动物营养学报,1996,8(2):62.
[10] 韩永样,石永春,姜宗尧,等.黑白花奶牛生长期能量代谢测试初报[J].吉林农业大学学报,1982(4):11-18.
[11] ODONGO N E,BAGG R,VESSIE G,et al.Longterm effects of feeding monensin on methane production in lactating dairy cows[J].Journal of Dairy Science,2007,90(4):1781-1788.
[12] ERW IN E S,MARCO G J,EMERY E M.Volatile fatty acid analyses of blood and rumen fluid by gas chromatography[J].Journal of Dairy Science,1961,44(9):1768-1771.
[13] 张元庆,魏吉安,孟庆翔.不同植物细胞壁的体外发酵特征及其对甲烷产生的贡献[J].畜牧兽医学报,2006,37(10):992 -998.
[14] 卢德勋.系统动物营养学导论[M].北京:中国农业出版社,2004:132-133.
[15] 欧宇,李胜利.莫能霉素对反刍动物的影响[N].中国畜牧兽医报,2008-10-7(7).
[16] 李炯明.海南霉素和Nisin对瘤胃体外发酵及山羊瘤胃体内发酵的影响[D].硕士学位论文.南京:南京农业大学,2006:47-59.
[17] 张永根.瘤胃脉酶抑制剂氢醒对反刍动物作用的研究[D].博士学位论文.哈尔滨:东北农业大学,2001:42.
[18] 任明强,沈赞明,赵茹茜,等.不同浓度海南霉素对山羊瘤胃消化代谢的影响[J].南京农业大学学报,1998,21(3):76 -79.
[19] WHETSTONE H D,DAVIS C L.Effect of monensin on breakdown of protein by rum inal m icroorganisms in vitro[J].Journal of Animal Science,1983,53(3):803-807.
[20] MARTINEAU R,BENCHAAR C,PETIT H V,et al.Effects of lasalocid or monensin supplementation on digestion,rum inal fermentation,blood metabolites and m ilk production of lactating dairy cows[J].Journal of Dairy Science,2007,90(12):5714 -5725.
[21] RUSSELL J B,ROBINSON P H.Com position and characteristics of strains of streptococcus bovis[J].Journal of Dairy Science,1984,67(7):1525 -1531.
[22] 李新建,高腾云.影响瘤胃内甲烷气产量的因素及其控制措施[J].家畜生态,2002,23(4):67 -69.
[23] GUAN H,W ITTENBERG K M,OM INSKI K H,et al.Efficacy of ionophores in cattle diets form itigation of enteric methane[J].Journal of Animal Science,2006,84(7):1896-1906.
[24] 欧宇,李胜利.莫能霉素在反刍动物中的应用[J].中国畜牧兽医,2003,30(2):18 -20.
[25] TEDESCHIL O,FOX D G,TYLUT T P.Potential environmental benefits of ionophores in rum inant diets[J].Journal of Environment Quality,2003,32(5):1591-1602.
[26] DELLINGER C A,FERRY JG.Effect of monensin on grow th and methanogenesis of methanobacterium form icicum[J].Applied and Environmental M icrobiology,1984,48(3):680-682.
[27] MCGINN SM,BEAUCHEM IN K A,COATES T,et al.Methane em issions from beef cattle:effects of monensin,sunflower oil,enzymes,yeast,and fumaric acid[J].Journal of Animal Science,2004,82(11):3346-3356.
[28] BHATTA R,UYENO Y,TAJIMA K,et al.Difference in the nature of tannins on in vitro rum inalmethane and volatile fatty acid production and onmethanogenic archaea and protozoal populations[J].Journal of Dairy Science,2009,92(11):5512-5522.
[29] VAN KESSEL JA S,RUSSELL JB.The effect of pH on rum inalmethanogenesis[J].FEMSM icrobiology Ecology,1996,20(4):205-210.
[30] CHEN M,WOLIN M J.Effect of monensin and lasalocid-sodium on the grow th ofmethanogenic and rumen saccharolytic bacteria[J].Applied and Environmental M icrobiology,1979,38(1):72-77.
