长时间大强度运动对大鼠骨骼肌BMP6 mRNA表达及铁贮存的影响
2012-02-27孙娟王海涛刘玉倩李海洲程康康张乐嘉
孙娟王海涛刘玉倩李海洲程康康张乐嘉
1河北师范大学体育学院(石家庄050024)
2北京师范大学体育与运动学院
骨形态发生蛋白 (bone morphogenetic proteins,BMPs)具有诱导间充质细胞定向分化为成骨细胞,促进新骨形成的能力[1]。骨形态发生蛋白6(BMP6)为BMPs家族中的成员,作用于骨形成的初期。大量研究发现,BMP6除具有调节成骨细胞和成软骨细胞分化、促进骨折愈合的作用外,还参与调节多种细胞的增殖、分化和凋亡等生理过程[2-4]。最新研究表明,BMP6是铁调素(Hepcidin)的内源调节子,可以上调Hepcidin表达,而高表达的Hepcidin可抑制肠铁吸收,改变机体的铁状态[5,6]。因此,BMP6对维持机体铁的动态平衡有重要的调控作用。Kautz等通过铁强化饮食诱导大鼠铁超载,发现BMP6在mRNA以及蛋白水平上都有表达,还发现铁超载诱导BMP6 mRNA在肝脏而不是小肠表达[7]。Gkouvatsos等在Hfe2基因被破坏的大鼠中发现,维持体内铁平衡除了骨骼肌铁调素调节蛋白(hemojuvelin,HJV)之外,肝脏也参与其中。Hfe2编码HJV与BMPs信号分子的共受体有关,可以增加肝脏铁调节激素Hepcidin的表达[8]。而在运动方面骨骼肌BMP6的调节机制尚不清楚,尤其是运动性低血色素形成中,骨骼肌BMP6通过何种途径如何调节铁代谢,还需进一步研究。因此,本研究通过观察长时间递增负荷跑台运动后,运动性低血色素形成中大鼠骨骼肌BMP6表达的变化,为改善运动性铁缺乏,防止运动性低血色素发生提供实验和理论依据。
1 材料与方法
1.1 实验动物
雄性Wistar大鼠12只,体重(250±10)g,购自河北医科大学动物养殖中心,动物生产许可证号:SCXK(冀)2008-1-003。实验动物使用许可证号:SYXK(冀)2008-0026。选用国家标准啮齿类动物干饲料分笼喂养,铁含量为100 mg/kg,自由饮水。环境温度22~25℃,相对湿度为50±5%。每日自然光照。所有动物实验前均无跑台运动史。
1.2 运动方案
随机分为对照组和运动组,每组6只。对照组不运动,常规饲养。运动组大鼠进行坡度为0的递增负荷跑台训练[9],共运动4周,6 d/w,速度30 m/min。前2周每天训练1次,时间从1 min开始,每天递增2 min,从第3周开始,每天训练2次,时间每次递增2 min,最后1次训练时间为71 min。
1.3 取材
于4周末运动后36 h取材,以避免急性运动的影响。两组大鼠称重后用1%戊巴比妥钠(1 ml/100g)麻醉,剪开胸腔暴露心脏,于左心室取全血1.5 ml测血常规和血清铁。用去离子水配制4℃生理盐水从升主动脉快速灌流,冲净血液。迅速剪取腓肠肌和肝脏,分别装入EP管,迅速投入液氮以备RT-PCR测定。取大鼠股骨,用骨钳截断后,用大镊子撬开股骨,然后用消过毒的牙签刮取股骨骨髓,用原子吸收法测定骨髓总铁含量 (原子吸收分光光度计:AA240FS,VARIAN)。上述指标的测定均在河北师范大学生命科学学院铁代谢分子生物学实验室完成。
1.4 RT-PCR(逆转录PCR)检测大鼠骨骼肌BMP6 mRNA和肝组织Hepcidin mRNA表达[6]
取 100 μg腓肠肌和肝组织加 1 ml Trizol Reagent(Invitrogen,USA)匀浆器匀浆,提取总RNA。测浓度及纯度后用反转录试剂盒(PrimeScirptTM RT reagent Kit,TaKaRa) 在 PCR仪 (Eppendorf AG 22331,Gene company Limited)中进行反转录(37℃15 min,85℃5 s),总体系为20 μl,反转录产物在冰上配制PCR反应液。在RT-PCR管中加入2 μl反转录后的cDNA,上下游引物(上海生工)各1μl,10% PCR Buffer 2μl,10 mM DNTP 2μl,Taq酶 0.2 μl(TaKaRa),DEPC水补至20 μl。设定BMP6 mRNA扩增反应循环条件为:95℃4 min;94℃45 s,56℃45 s,72℃1 min(34个循环);72℃10 min。Hepcidin的反应条件为94℃4 min,94℃30 s,57℃40 s,72℃60 s,βactin26个循环,Hepcidin24个循环。放置PCR仪中进行扩增。取5 μl扩增产物用于1.2%琼脂糖凝胶电泳分析 (溴化乙锭EB染色),PCR引物见表1,PCR引物碱基序列参考Zhang等的报道[10]。以β-actin为内参,用凝胶成像系统(Fujifilm Las-4000)扫描图像,Multi Gauge V3.1分析软件分析,最终统计BMP6和Hepcidin与β-actin的亮度比值。
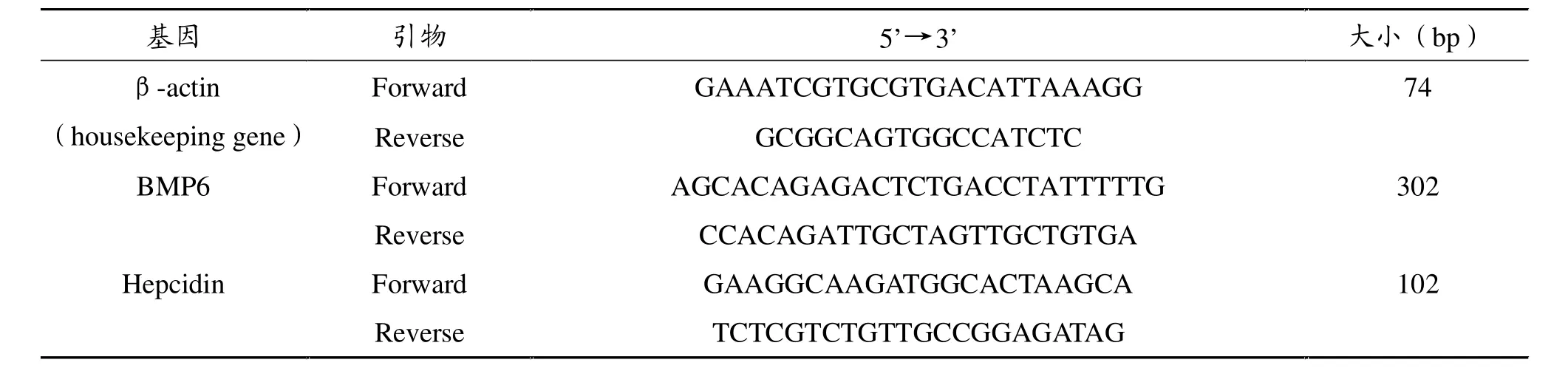
表1 Real Time-PCR引物序列
1.5 统计学分析
所有数据采用SPSS18.0进行独立样本t检验,实验结果以平均数±标准差(±s)表示,显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果
2.1 血常规及贮存铁含量
运动组大鼠Hb、RBC均显著低于其对照组(P< 0.05),Hb合成降低,大鼠出现运动性低血色素,造模成功[11]。运动组大鼠WBC与对照组相比显著增加(P<0.05),血清铁和骨髓铁含量与对照组相比均显著降低(P<0.05,P<0.01)。见表2。

表2 两组大鼠血常规和骨髓铁比较
2.2 骨骼肌BMP6 mRNA和肝脏Hepcidin mRNA表达
结果显示:运动组大鼠骨骼肌BMP6 mRNA表达 (0.87±0.11)明显高于对照组 (0.52±0.06),P< 0.05。运动组大鼠肝脏hepcidin mRNA表达 (1.06± 0.01)与对照组(0.97±0.01)相比稍增加,但无统计学意义(P>0.05)。
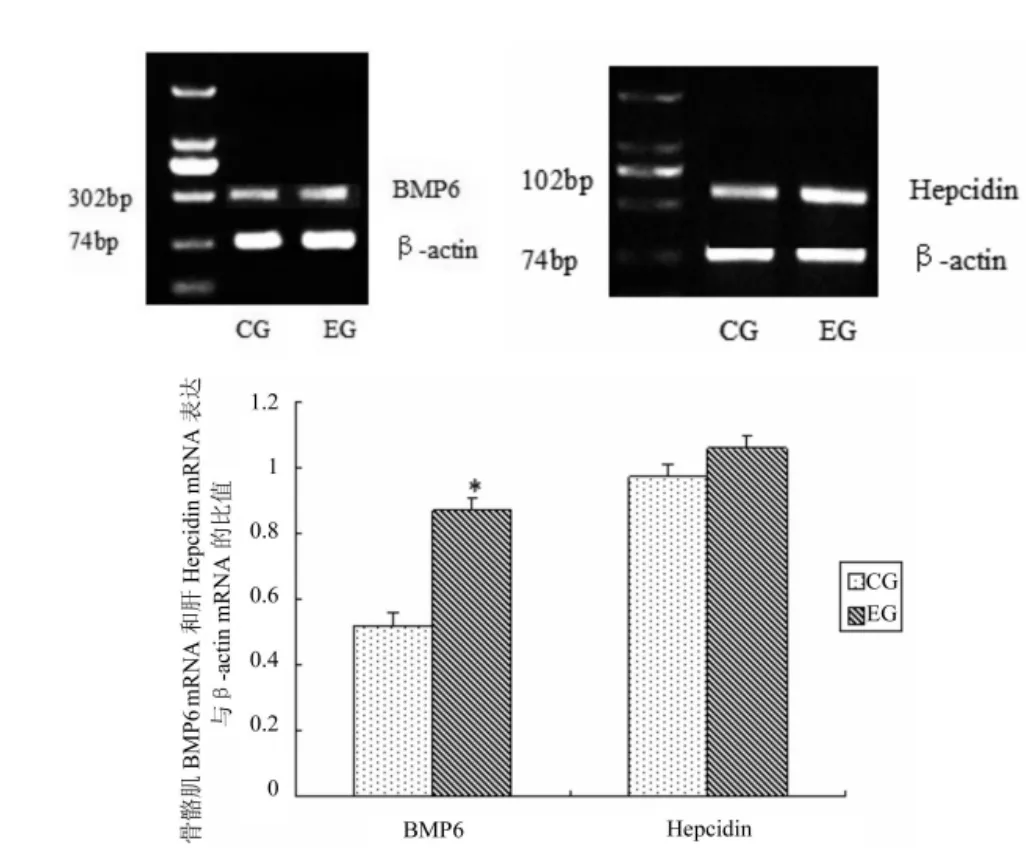
图1 两组大鼠骨骼肌BMP6 mRNA和肝脏Hepcidin mRNA表达比较(n=6)
3 讨论
3.1 长时间大强度运动对大鼠血常规及骨髓铁贮存的影响
Hb具有运载氧的能力,对提高从事周期性耐力项目如中长跑运动员的运动能力尤其重要。本实验结果表明,运动组大鼠Hb、RBC、血清铁和骨髓铁含量均较对照组显著降低,说明长时间大强度运动导致红细胞数目减少、血红蛋白水平降低、机体铁储存减少以及运铁能力显著下降。另外,运动组大鼠WBC与对照组相比显著增加,说明长时间大强度运动还导致白细胞数量增加,可能引发炎症反应,从而降低机体运氧和运铁能力,降低血清铁含量,最终导致运动能力下降。
3.2 长时间大强度运动对大鼠骨骼肌BMP6 mRNA及肝脏Hepcidin mRNA表达的影响
运动组大鼠骨骼肌BMP6 mRNA表达明显高于对照组。运动组大鼠肝脏hepcidin mRNA表达与对照组相比稍有增加但无统计学意义。本实验室前期研究发现,4周长时间大强度运动后大鼠小肠铁吸收未发生明显变化,运动时间延长至第5周时,铁吸收下降[12]。上述结果表明,长时间大强度运动导致机体铁大量消耗,但铁吸收未相应增加,为满足运动机体需求,贮存铁被大量动员,骨髓铁含量显著降低,而铁不充足影响Hb合成,导致Hb下降,发生运动性低血色素。另外,运动时间延长,运动强度加大后,机体肝分泌Hepcidin增加[13]。Hepcidin表达升高,与位于十二指肠吸收细胞基底膜上的膜铁转运蛋白1(ferroportin 1,FPN1)及巨噬细胞膜上的靶分子FPN1结合,引起其内吞并降解,使FPN1表达降低,从而抑制小肠吸收细胞和巨噬细胞中的铁释放进入血液,血清铁水平下降[14,15]。
3.3 BMP6对Hepcidin的影响及其调控机制
新近研究表明,BMP6是Hepcidin的内源调节子,可以上调Hepcidin表达,从而调节机体铁代谢。在这一调控中,BMP6-SMAD信号传导途径是中枢调节器。BMP6首先与BMP的II型受体(BMPR-II)结合,引起BMPI型受体(BMPR-I)磷酸化,然后BMPR-I与BMPR-II结合成具有高亲和力的异四聚体,成为丝氨酸/酪氨酸激酶的受体,激活的受体复合物使Smad1、Smad5及Smad8蛋白进一步磷酸化,全面激活Smad1/5/8信号传导通路,形成Smad1/5/8复合物,该复合物在Smad4介导下移动到细胞核,与Hepcidin基因的调控序列结合,促进Hepcidin转录。BMP6通过与其受体结合,激活BMP6-SMAD信号传导途径,最终上调Hepcidin的表达[16]。Ishizaki等研究镁缺乏对小鼠Hepcidin表达的影响时发现,镁缺乏组肝脏铁浓度显著升高,发生铁超载,通过转录激活BMP6上调Hepcidin,从而调节铁代谢[17]。本实验结果显示,长时间大强度运动后,骨骼肌BMP6 mRNA表达显著增加,肝脏Hepcidin mRNA表达无显著变化。但我们在后续实验(第5周)取材时,发现肝脏Hepcidin明显增加,可能是BMP6通过BMP6-SMAD信号传导途径上调Hepcidin表达。此外,越来越多的证据表明,BMP6异常会引起各种疾病,如肿瘤、肝癌、肺癌、肠炎等[18]。研究发现,血清铁过低引起的贫血经常伴随炎症性肠病,这是由于BMP6过表达,导致Hepcidin表达增加,引起炎症反应[19]。研究还发现,肾脏细胞癌中,BMP6II型受体低表达可降低BMP6对细胞的抑制作用[20]。Armitage等在人类肝癌细胞中发现,效应细胞因子IL-22和细胞外感染有关,其调节通路可使IL-22引起STAT3磷酸化,促进BMP6和IL-6表达增加,从而上调Hepcidin[21]。另外,肾脏内源BMP6表达减少会加剧肾损伤和纤维化[22]。最新研究发现,巨噬细胞通过BMP6/IL-6循环诱导前列腺癌细胞分泌分化[23]。因此,长时间大强度运动引发的炎症反应可通过BMP6增加Hepcidin,改变机体铁稳态。
3.4 长时间大强度运动骨骼肌BMP6对机体铁代谢的调控
最新研究显示,BMP6可感应铁的变化,通过Hepcidin调节铁代谢。Arndt等研究发现,BMP6(-/-)小鼠肝脏出现了严重铁积累,随着年龄增长,肝脏Hepcidin表达降低;而BMP6(+/+)小鼠增加铁补充诱导小肠BMP6表达明显上调[24]。Ramos等用单次和长期高铁饲料喂养敲除基因小鼠发现,单次高铁引起Hfe(-/-)小鼠Hepcidin表达增加,而BMP6(-/-)小鼠Hepcidin表达几乎无增加,而长期高铁饲养,HFE和Tfr2突变小鼠Hepcidin表达增加,但BMP6(-/-)和HJV(-/-)小鼠Hepcidin表达上升不明显[25]。说明BMP6(-/-)小鼠阻断了BMP/Smad途径,几乎检测不到Hepcidin合成。Meynard等用高铁和低铁饲料喂养基因敲除小鼠,发现Smad4(-/-)基因敲除小鼠和Hamp1(-/-)基因敲除小鼠肝脏出现严重铁超载,而且这些小鼠的BMP6 mRNA表达明显升高[26]。Corradini等研究了BMP6-Smad通路激活对循环铁、组织铁以及Hepcidin表达的影响,发现肝铁含量与肝脏BMP6 mRNA表达呈正相关,并且全面激活Smad1/5/8信号传导通路[27]。本实验结果显示,长时间大强度运动使骨骼肌BMP6 mRNA表达升高,可能是通过BMP/Smad途径上调Hepcidin,抑制小肠铁转运蛋白吸收和释放铁,最终导致血清铁降低。这是引发运动性低血色素的重要原因之一。
4 总结
长时间大强度运动大鼠白细胞显著增加,机体引起炎症反应,骨骼肌BMP6mRNA表达增加,上调Hepcidin表达,机体铁稳态被破坏,而骨髓铁贮存降低导致合成Hb减少,可能是长时间大强度运动导致运动性低血色素的重要原因之一。
[1]Urist M R.Bone formation by autoinduction.Science,1965,150(698):893-899.
[2] Li JZ,Li H,Sasaki T,et al.Osteogenic potential of five different recombinant human bone morphogenetic protein adenoviral vectors in the rat.Gene Therapy,2003,10(20):1735-1743.
[3]Kang Q,Sun MH,ChengH,et al.Characterization of the distinct orthotopic bone-forming activity of 14 BMPs using recombinant adenovirus-mediated gene delivery.Gene Therapy,2004,11(17):1312-1320.
[4]Vukicevic S,Grgurevic L.BMP-6 and mesenchymal stem cell differentiation.Cytokine Growth Factor Rev,2009,20(5):441-448.
[5]Corradini E,Rozier M,Meynard D,et al.Iron regulation of Hepcidin despite attenuated Smad1,5,8 signaling in mice without Transferrin Receptor 2 or Hfe.Gastroenterology,2011,141(5):1907-1914.
[6]刘玉倩,王海涛,赵斌,等.不同强度运动对大鼠肝hepcidin mRNA表达和血清IL-6、铜蓝蛋白(CP)含量的影响.体育科学,2009,29(5):66-69.
[7]Kautz L,Besson-Fournier C,Meynard D,et al.Iron overload induces BMP6 expression in the liver but not in the duodenum.Haematologica,2011,96(2):199-203.
[8]Gkouvatsos K,Wagner J,Papanikolaou G,et al.Conditional disruption of mouse Hfe2 gene:Maintenance of systemic iron homeostasis requires hepatic but not skeletal muscle hemojuvelin.Hepatology,2011,54(5):1800-1807.
[9]赵杰修,田野,曹建民,等.不同运动方式对大鼠血红蛋白浓度的影响——大鼠运动性贫血模型建立方法探讨.中国运动医学杂志,2004,23(4):436-440.
[10]Zhang AS,Gao J,Koeberl DD,et al.The role of hepatocyte hemojuvelin in the regulation of bone morphogenic protein-6 and hepcidin expression in vivo.Biol Chem,2010,285(22):16416-16423.
[11]刘树欣,王海涛,刘玉倩,等.运动性低血色素形成过程中大鼠肝脏HJV mRNA表达及血清Hepcidin含量的变化.体育科学,2011,31(3):53-57.
[12]孙娟,王海涛,刘玉倩,等.运动性低血色素形成中大鼠十二指肠铁吸收蛋白HCP1、DMT1及FPN1表达的动态变化.中国运动医学杂志,2011,30(9):741-746.
[13]刘玉倩,常彦忠,王海涛,等.不同强度运动对大鼠十二指肠DMT1、FP1蛋白和肝Hepcidin mRNA表达的影响.体育科学,2006,26(9):68-71.
[14]刘玉倩,王海涛,赵斌,等.运动性低血色素大鼠小肠铁吸收蛋白DMT1和FPN1表达的变化.中国运动医学杂志,2009,28(5):515-517.
[15]孔卫娜,张彩云,段相林,等.单核巨噬细胞铁代谢相关蛋白的表达调控.生物物理学报,2010,26(4):275-284.
[16]Anderson GJ,Frazer DM.Iron metabolism meets signal transduction.Nat Genet,2006,38(5):503-504.
[17]Ishizaki N,Kotani M,Funaba M,et al.Hepcidin expression in the liver of rats fed a magnesium-deficient diet. Nutr,2011,106(8):1169-1172.
[18]Grcevic D,Kusec R,Kovacic N,et al.Bone morphogenetic proteins and receptors are over-expressed in bone-marrow cells of multiple myeloma patients and support myeloma cells by inducing ID genes.Leuk Res,2010,34(6):742-751.
[19]Wang L,Trebicka E,Fu Y,et al.The bone morphogenetic protein-hepcidin axis as a therapeutic target in inflammatory bowel disease.Inflamm Bowel Dis,2012,18(1):112-119.
[20]Kim IY,Lee DH,Lee DK,et al.Decreased expression of bonemorphogenetic protein(BMP)receptor type II correlate swith insensitivity to BMP-6 in human renal cell carcinoma cells.Clin Cancer Res,2003,9(16):6046-6051.
[21]Armitage AE,Eddowes LA,Gileadi U,et al.Hepcidin regulation by innate immune and infectious stimuli.Blood,2011,118(15):4129-4139.
[22]Dendooven A,van Oostrom O,van der Giezen DM,et al. Loss of endogenous bone morphogenetic protein-6 aggravates renal fibrosis.Pathol,2011,178(3):1069-1079.
[23]Lee GT,Kwon SJ,Lee JH,et al.Macrophages induce neuroendocrine differentiation of prostate cancer cells via BMP6-IL6 Loop.Prostate,2011 Mar 3.doi:10.1002/pros. 21369.[Epub ahead of print]
[24]Arndt S,Maegdefrau U,Dorn C,et al.Iron-induced expression of bone morphogenic protein 6 in intestinal cells is the main regulator of hepatic hepcidin expression in vivo.Gastroenterology,2010,138(1):372-382.
[25]Ramos E,Kautz L,Rodriguez R,et al.Evidence for distinct pathways of hepcidin regulation by acute and chronic iron loading in mice.Hepatology,2011,53(4):1333-1341.
[26]Meynard D,Kautz L,Darnaud V.Lack of the bonemorphogenetic protein BMP6 inducesmassive iron overload.Nature Genet,2009,41(4):478-481.
[27]Corradini E,Meynard D,Wu Q,et al.Serum and liver iron differently regulate the bone morphogenetic protein 6(BMP6)-SMAD signaling pathway in mice.Hepatology,2011,54(1):273-284.
