草甘膦对大豆根尖细胞损伤的彗星试验初探
2012-02-05李广领刘英杰管文芳陈锡岭
李广领,刘英杰,管文芳,陈锡岭
(河南科技学院,河南新乡453003)
单细胞凝胶电泳(single cell gel electrophoresis,SCGE)又称慧星试验(comet assay),该技术最初是由Ostling和Johansos于1984年在Cook、Rydberg和Johanson方法基础上进行改进而建立的中性慧星试验技术[1],Singh于1988年又在此基础上又对该试验方法进行改进,开发出了碱性条件下的SCGE技术,进一步提高了DNA损伤检出的灵敏度[2].该技术可以定量检测真核细胞中的单链断裂、双链断裂、碱性不稳定位点、不完全切除修复位点和DNA交联等多种DNA伤害情况[3].在以前的研究中,彗星试验多是利用动物细胞DNA的损伤来检测环境污染物的致突变性和基因毒性,1996年Koppen第一次报道了利用植物为试验材料进行彗星试验[4],此后不断有人利用植物彗星试验进行深入研究,使该技术扩展至环境监测[5-7]和生态评估[8-10]等领域.草甘膦(glyphosate)作为有划时代意义的广谱性和灭生性除草剂,目前已成为世界上应用最广、产量最大的农药品种[11].近年来,随着转基因抗草甘膦作物的发展,草甘膦用量还在逐年增加.本研究以转基因抗草甘膦大豆育种材料为试验材料,利用SCGE技术检测草甘膦对其遗传物质的损伤情况,旨在为抗草甘膦转基因大豆品种选育提供技术支持.
1 材料与方法
1.1 试验仪器
10 mL玻璃匀浆器(海门市华凯实验玻璃仪器有限公司),DYY-10型电泳仪(北京市六一仪器厂),JY-SPFT潜水式电泳槽(北京君意东方电泳设备有限公司),HH-2数显恒温水浴(金坛市汉康电子有限公司),BCD-195KAN冰箱(青岛海尔股份有限公司),MP120-2型电子分析天平(上海奕宇仪器仪表有限公司),BS-1EA数显培养箱(金坛市杰瑞尔电器有限公司),NikonE600荧光显微镜及数码成像系统(日本尼康公司),彗星图像分析软件为CASP软件(casp1.2.2)等.
1.2 试剂与材料
1.2.1 试剂和药品果胶酶和纤维素酶(上海研拓生物科技有限公司);正常熔点琼脂糖(NMA)和低熔点琼脂糖(LMA)(上海佳和生物科技有限公司产品);十二烷基肌氨酸钠和十六烷基三甲基溴化铵(CTAB)(Sigma产品);Tricine、Tris-HCl和Triton-X-100(Solarbio产品);溴化乙锭(EB)(北京鼎国生物技术有限责任公司产品);蔗糖、氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、乙二胺四乙酸二钠、氢氧化钠、二甲基亚砜和盐酸等.
1.2.2 缓冲液
STN缓冲液:136.8 g蔗糖、0.6 gNaCl、4.0 gTricine,蒸馏水定容至1000 mL.
细胞裂解液:20.0 g CTAB、81.8 g NaCl、100 mL Tris-Cl、0.5 mol/L pH 8.0的EDTA 40 mL;蒸馏水定容至1000 mL.
PBS:8.0 gNaCl、3.56 gNa2HPO4、0.2 gKH2PO4、0.2 gKCl加入蒸馏水1000 mL.碱性电泳缓冲液:0.3 gEDTA、12 gNaOH,加入蒸馏水1000 mL.
1.2.3 试验材料转基因大豆育种材料(DA30),河南科技学院大豆育种教研室提供.
1.3 试验方法
1.3.1 大豆根尖原生质体制备挑选大小一致的健康种子,双氧水表面消毒,蒸馏水室温浸泡24 h,置于发芽盒中保湿发芽,待根长至1.5~2.0 cm时,分成4组(10株/组),分别置根于盛有250 mL质量浓度为0、40、80和160 mg/L草甘膦溶液中染毒处理8 h,自来水修复培养24 h;剪取根尖1 g浸于加有10 mL 1%纤维素酶和2%果胶酶的酶解液中28℃处理3 h,200目纱布过滤,5000 rpm离心3 min,沉淀用STN溶液洗2次,显微镜下观察并用PBS调整原生质体密度为每视野20~40个原生质体,供SCGE.
1.3.2 单细胞凝胶电泳电泳所用“三明治”胶板参照Rojas等法制备[12],其中0.5%NMA铺底,体积比为1∶2的0.5%LMA和根尖细胞原生质体混合液夹心,外层为0.5%LMA.外层胶凝固后,去盖玻片后放入4℃细胞裂解液中避光裂解1.5 h,用PBS冲洗2次,将载玻片置于水平电泳槽,解旋处理20 min;25 V、300 mA条件下电泳20 min,用Tris-HCl中和15 min,于每片载玻片胶面中央滴加20 μg/mL的EB溶液50 μL,避光染色20 min.
1.4 数据处理
每个视野随机选择100个细胞,计数拖尾细胞数,计算拖尾率;每张片子上随机选择50个细胞,显微拍照,记录电泳图谱,用Comet Assay Software Pect(CASP 1.2.3 beta 1)软件对彗星尾长(TL)、彗星尾部DNA含量(TDNA%)、尾矩(TM)和Olive尾距(OTM)等指标进行单因素方差分析,评价细胞DNA的受损程度.
2 结果与分析
2.1 不同浓度草甘膦处理下大豆根尖细胞的彗星图像
不同浓度草甘膦处理下大豆根尖细胞的彗星图像见图1.

图1 不同剂量草甘膦染毒处理8 h引起大豆根尖细胞DNA损伤的彗星图像Fig.1 DNAdamage comet images soybean root tip cells after 8 hours treated with different dosages glyphosate
由图1可知,对照组(蒸馏水处理组)细胞头部DNA致密,边缘较光滑,尾部不明显.所试验的草甘膦40、80和160 mg/L处理组细胞均呈不同程度的彗星形状,其头部DNA集中,亮度细较强,尾部由DNA断片组成,呈扫帚状,且随着处理浓度的加大,拖尾现象越明显.
2.2 草甘膦对大豆根尖细胞DNA拖尾率的影响
草甘膦染毒处理造成大豆根尖细胞拖尾的情况见表1.
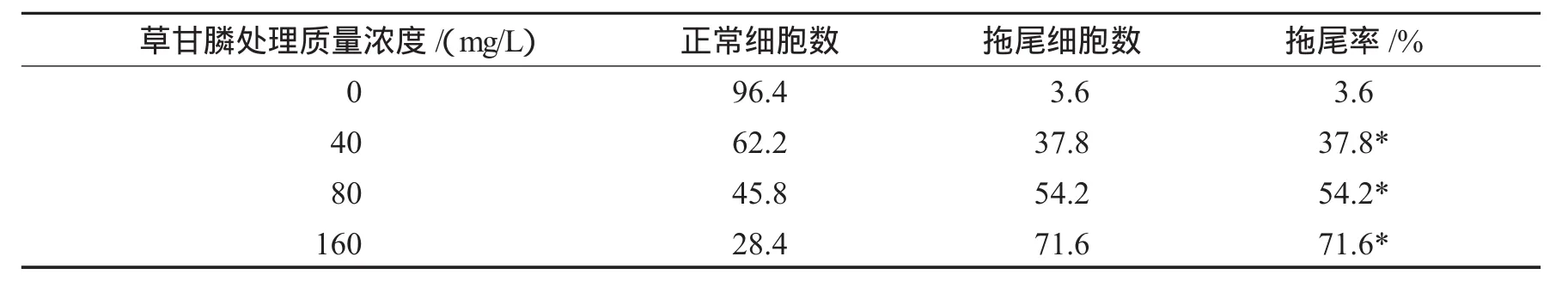
表1 草甘膦对大豆根尖细胞DNA拖尾率的影响(n=100)Tab.1 Effect ofcomet rate on soybean root tip cells induced byglyphosate
由表1可知,不同的草甘膦处理浓度在8 h的染毒处理时间内,对照组与3个药剂处理组的DNA拖尾率分别为3.6%、37.8%、54.2%和71.6%,随着草甘膦处理质量浓度的增高DNA拖尾率呈显著上升趋势,且呈明显的剂量-效应关系.
2.3 草甘膦对大豆根尖细胞DNA的损伤
草甘膦染毒处理造成大豆根尖细胞DNA的损伤见表2.

表2 草甘膦对大豆根尖细胞DNA的损伤Tab.2 DNAdamage ofsoybean root tip cells induced byglyphosate
由表2可知,除对照组,各草甘膦处理组根尖细胞的DNA均受到明显损伤,彗星尾长、尾部DNA含量、尾距和Olive尾距显著高于对照组.且随着处理剂量的增高,尾长、尾部DNA含量、尾距和Olive尾距均显著增加,且根尖细胞DNA损伤程度与草甘膦的处理浓度呈显著的剂量-效应关系.
3 结论
一些化学、物理和生物诱突变剂或诱癌剂往往可引起DNA的损伤,DNA链断裂是细胞DNA损伤的主要类型之一.由Singh等改进和建立的单细胞凝胶电泳技术与传统方法相比,不仅操作简便、快速、灵敏,所需细胞少,适于体内、外不同类型实验和各种类型细胞DNA损伤的研究,而且能够对单个细胞的DNA损伤进行研究,从而避免了只能对细胞群体的DNA改变进行测定的不足,近年来在相关研究领域广泛应用.本研究以草甘膦对制备的大豆根尖细胞原生植体进行染毒处理,并进行了碱性单细胞凝胶电泳实验,初步证明了3个不同剂量草甘膦无论对大豆根尖细胞DNA均有不同程度的损伤,且呈明显的剂量-效应关系,但不同处理时间引起的效应还需进一步研究,同时确定大豆田的草甘膦安全施用量还有待更深入的研究.
[1] Ostling O,Johanson K J.Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells[J].Biochemical and Biophysical Research Communications,1984,123(1):291-298.
[2] Singh N P,McCoy M T,Tice R R,et al.ASimple technique for quantization of low levels of DNA damage in individual cells[J].Experimental Cell Research,1988,175(1):184-191.
[3] Navarrete M H,Carrera P,Miguel M,et al.A fast comet assay variant for solid tissue cells:the assessment of DNA damage in higher plants[J].Mutation Research,1997,389(2/3):271-277.
[4] Koppen G,Verschaeve L.The alkaline comet test on plant cells:Anewgentoxicitytest for DNAstrand breaks in Viafaba root cell[J].Mutation Research,1996,360(3):193-200.
[5] 陈颖,王磊,王子健.用彗星实验技术检测环境遗传毒性物质[J].土壤学报,2006,43(4):673-678.
[6] 钟远,封少龙,苏庆,等.应用蚕豆根尖微核技术和彗星试验监测扬中地表水遗传毒物污染的研究[J].癌变·畸变·突变,2000,12(1):18-23.
[7] Gichner T,Plewa M J.Induction of somatic DNA damage as measured by single cell gel electrophoresis and point mutation in leaves of tobacco plants[J].Mutation Research,1998,401(1/2):143.
[8] Gichner T,Ptacek O,Stavreva D A,et al.A comparison of DNA repairs usingthe comet as sayin to baccosee dlings after exposure to alkylatingagents or ionizingradiation[J].Mutation Research,2000,470(1):1-9.
[9] Masoomi J R,Mohammadi S H,Amini M,et al.High background radiation areas of Ramsar in Iran:Evaluation of DNA damage by alkaline single cell gel electrophoresis(SCGE)[J].Journal of Environmental Radioactivity,2006,86(2):176-186.
[10] Saghirzadeh M,Gharaati MR,Mohammadi S,et al.Evaluation of DNA damage in the root cells of Allium cepA Seeds growing in soil ofhigh background radiation areas of Ramsar Iran[J].Journal of Environmental Radioactivity,2008,99(10):1-5.
[11] 苏少泉.草甘膦述评[J].农药,2005,44(4):145-149.
[12] Rojas E,Lopez MC,Valverde M.Single cell gelelectrophoresis assay:methodology and applications[J].Journal of Chromatography:B,1999,722(1/2):225-254.
