人肿瘤干细胞异种移植模型进展
2012-02-01丁利军
余 飞,丁利军
(南京大学医学院附属鼓楼医院,南京 210008)
自从肿瘤干细胞(cancer stem cells,CSCs)是肿瘤发生与发展之源这一观点被提出,人们对肿瘤有了更加深刻的认识。建立筛查肿瘤干细胞的临床方法以及寻找以肿瘤干细胞为靶点的新药成为肿瘤研究的新热点。但是,目前鉴别和评价肿瘤干细胞特性的唯一工具是CSCs异种移植至免疫缺陷小鼠后的成瘤模型[1]。完善CSCs异种移植小鼠模型并利用这一模型筛选新的 CSCs是药物筛查的前提,其需要考虑移植免疫和微环境等相关问题。本文就人CSCs异种移植模型的新进展及面临的问题等作简要综述。
1 肿瘤干细胞概念
早在19世纪,研究已经发现肿瘤具有明确的组织学异质性。1937年,Furth和 Kahn[2]的实验证实来自小鼠肿瘤的单个细胞可以在受体鼠体内诱发形成新的肿瘤。在白血病和实体瘤的研究中也发现能够诱发形成肿瘤的细胞在肿瘤细胞中比率很低,仅103~107的肿瘤诱发细胞即可在受体鼠内形成新的继代肿瘤[3-5]。
随后Pierce[6]的研究证实恶性畸胎瘤中含有高致瘤性细胞,这些高致瘤性细胞作为单个细胞可以分化成多个不同类型的非致瘤性细胞。在此之前,Leblond等[7-8]已结合放射自显影技术,完成了组织内的细胞增殖、存活期和细胞构成检测。1971年Pierce[9]在鼠鳞状细胞癌研究中采用这种方法获得重要发现:早期,放射性标记几乎全部出现在未分化区域;随后,这些标记出现在分化良好区域。这证实未分化的细胞经过衍生形成不同的分化细胞。与未分化的高致瘤性细胞不同,分化的细胞移植到合适的宿主体内并未形成肿瘤。通过上述实验,Pierce[10]提出了肿瘤干细胞概念:“基于发育生物学和肿瘤学规律的肿瘤概念,其本质是组织自我更新的紊乱,它由在正常稳定的内环境下具有显著增殖能力和有限分化能力的肿瘤干细胞以及分化的肿瘤细胞后代组成。”
CSCs概念的核心是肿瘤中并非所有的细胞都是均等的。它假定肿瘤生长与正常增生组织如骨髓、皮肤或肠上皮的生长类似,是通过能够自我更新、数量有限的专一干细胞来实现的。一个肿瘤主要由快速增殖的肿瘤干细胞以及干细胞有丝分裂、分化衍生的细胞构成。分化细胞没有自我更新能力,对肿瘤的长期维持作用可以忽略。CSCs具有正常干细胞的特征:可以自我更新,一生维持,抵御放射和化学损伤,能够长时期休眠或是迁移至身体其他部位[11]。
2 肿瘤干细胞与肿瘤治疗
由于肿瘤具有难以根治及复发率高等特点,CSCs概念自提出以来,作为抗癌战略的新靶点受到关注。肿瘤细胞株的皮下移植几十年来被广泛应用于细胞毒素和抗增殖药物以及复方药物的临床前筛选。尽管在肿瘤靶向药物开发及靶向药物载体研究方面取得许多进展,但经典化疗药物在愈后不复发方面的效果有限以及能够揭示自发肿瘤进展的细胞株不足这些都限制了肿瘤治疗的进展。肿瘤干细胞概念的出现是一种新的模式,它为药物发现和临床前筛查提供了新的思路[12]。
与普通肿瘤细胞相比,CSCs表现出对细胞毒性药物[13-15]和辐射[16]有更高的抗性。经典的抗癌治疗方法是通过优先杀死更多的分化细胞而暂留CSCs来诱发肿瘤的快速萎缩。然而少数CSCs的存活随后就会导致后续的肿瘤再生和疾病复发。Gleev ec等人临床实验的成功给肿瘤-特异性通路靶向治疗提供了一个有力的证据,同时发现了几种新靶向因子。CSCs的存活、自我更新和/或分化的靶向作用提示了实现长效根除肿瘤所需的策略。近来许多学者正在开展识别CSCs并以其作为靶向目标的研究[17,18]。此外,已证明靶向因子治疗癌症患者的疗效与因子本身靶向肿瘤干细胞的能力密切相关[19]。同时,CSCs具有模仿肿瘤体内发育的独特能力,与肿瘤细胞株相比它是更好的临床肿瘤模型。
3 人肿瘤干细胞异种移植模型
CSCs可以诱发体内肿瘤,这些体内瘤包括了原发肿瘤所有分化的细胞群,它们可以被连续移植且不损耗致瘤潜力,即 CSCs具有自我更新的潜能。目前,潜在CSCs群的筛选依赖于其在免疫缺陷动物体内启动肿瘤的能力。如人急性髓性白血病(AML)CSCs的首个证据是通过重度联合免疫缺陷(SCID)鼠的移植实验获得的,其证实白血病是通过CD34+细胞而不是CD34-细胞传递给模型鼠的[20]。后续研究证实移植 CD34+的白血病细胞可以导致非肥胖糖尿病重度联合免疫缺陷鼠(NOD-SCID)产生一系列不同分化级别的白血病细胞[21]。
实体瘤CSCs的研究由于技术原因相对滞后,主要是由于组织解离困难,膜标记物缺乏难以分离细胞核心亚群。近年来,研究发现乳腺癌 CSCs是CD44+CD24-的核心细胞亚群,它们能够诱发肿瘤,这些肿瘤在组织学上与乳腺脂肪垫移植患者相似[22],而胶质母细胞瘤的 CSCs能够在颅内注射后诱发肿瘤,它们表达CD133[23]。现在通过异种移植已经在几种人实体瘤内发现了CSCs。人的CSC群如前列腺癌[24],结肠癌[25],脑癌[26],胰腺癌[27],肺癌[13],卵巢癌[28],膀胱癌[29]等均通过异种移植获得。结肠癌 CSCs的鉴定是借助于肾被膜下移植CD133+细胞实验完成的[30],移植效率约比皮下移植的效率高10倍[25]。Morrison等[31,32]研究表明已分选出的一系列标记阳性和特定标记阴性的 CSC可以稳定的复制最初的标记表达模式,即这些标记可以在肿瘤干细胞中稳定传递。其研究说明,现有的CSC标记(表1)是显著特异的,且异质性表达的流式细胞技术(FACS)标记,可用于分选标记阳性和标记阴性细胞群体。
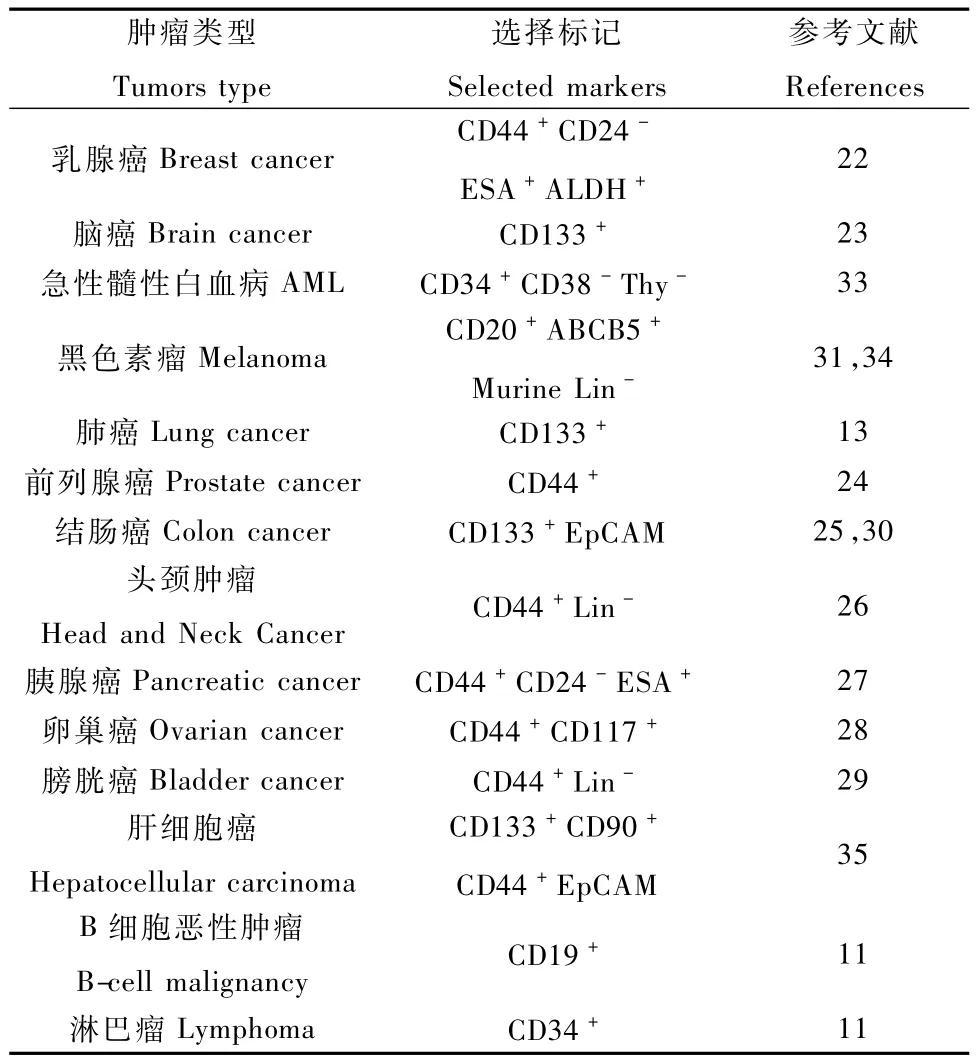
表1 常见CSCs鉴定的表面标记Tab.1 Surface markers of the CSCs
CSCs在异种移植模型中显示了它们独特的成瘤能力,并且这些肿瘤和患者体内的肿瘤类似。例如结肠CSCs经皮下移植后显示有腺体的组成,具有伊红染色阳性的散在细胞,这些细胞同样可以分泌粘液[25]。脑CSCs移植后产生了具有扁平上皮特性的移植物,包括发育成熟的角蛋白-生成细胞[26]。CSCs异种移植模型的建立利于理解特定肿瘤干细胞的特性及制订靶向肿瘤干细胞的治疗策略。
4 异种移植模型建立的影响因素
作为判定人CSCs的金标准,分选的肿瘤干细胞异种移植到免疫缺陷鼠体内实验,除了操作引起的细胞应激之外,还有一系列因素制约异种移植模型的成功建立,下面在分析肿瘤干细胞异种移植模型制作程序的基础上(图1),详述相关因素。
移植部位CSCs的高可塑性,决定了异种移植后成瘤特性因移植部位的变化而变化。同位和异位移植后CSCs成瘤情况的比较观察较少。其中卵巢CSCs皮下移植和腹腔移植所产生的肿瘤没有显示出明显的组织学差异,CSCs腹腔移植后仍产生血性腹水,并经腹膜转移至其它器官[28]。结肠 CSCs注射到结肠壁的同位移植与异位移植比较,生长的肿瘤组织学分析未显示明显差异。结肠移植物快速(约3周)引起肝转移,这是皮下注射结肠CSCs后未观察到的现象[25]。前列腺CSCs同位移植后观察到转移至包括脾、肺和肝等器官,但异位移植后未能观察到此现象[24]。这些观察说明CSCs同位移植和异位移植最重要的区别就是CSCs同位移植具有更好的复制转移过程的能力。若研究CSCs和癌细胞转移启动之间的关系,必须考虑移植CSCs的部位[36]。不同于卵巢和结肠肿瘤干细胞,胶质母细胞瘤中异位移植物具有移植位点依赖的成瘤性差异:CSCs皮下移植引起类似栅栏结构的高度血管化瘤以及组织坏死;颅内注射胶质母细胞瘤CSCs后显示出其扩散和渗入脑周组织的能力[37]。通过对皮下移植物中胶质母细胞瘤 CSCs的进一步鉴定,发现来源于不同患者的CSC群中部分产生含有软骨和成骨细胞的混合性肉瘤[38]。这种间质分化潜能仅在基质微环境中显现,而从未在颅内移植中发现。

图1 人肿瘤干细胞异种移植模型程序Fig.1 The operation procedure of human cancer stem cells xenograftmodel
微环境 微环境信号制约人CSCs的发生和发展。对溃疡性结肠炎干细胞的研究发现成纤维细胞在调节干细胞恶性转化方面具有关键作用:从一定比例病人的良性病变区分离得到的ALDH+细胞经继代皮下移植至鼠体内后渐渐发展成腺癌; ALDH+细胞与来自结肠癌组织的人成纤维细胞共移植明显提高肿瘤生长速率。现已发现这种过程至少部分是通过IL-6和IL-8介导的,证实在从溃疡性结肠炎向结肠癌转化过程中炎症的作用[39]。含有辐照和未辐照的乳腺成纤维细胞混合物的原位“人化”鼠模型可用来反映清除乳腺脂肪垫的NOD SCID鼠允许正常乳腺干细胞发育为完全分化的乳腺组织,ALDH1为正常干细胞和乳腺癌干细胞的常用标记,可对患者临床结局进行预测[40]并发现与CSCs自我更新相关的 Hedgehog信号通路[41]。通过抑制repertaxin,IL-8受体CXCR1靶向CSCs可以降低肿瘤生长和体内转移速率[42]。总而言之,这些研究强调了微环境因素对CSCs移植模型的影响。因此在试验规划及结果评估中必须考虑鼠类模型无法完全复制特异物种可溶解的、膜结合的特异细胞因子对CSCs生存的影响。
移植动物品系由于不同程度的免疫活性残留,免疫缺陷鼠不同品系的选择在某些情况下影响CSCs的评估。在NOD SCID IL2Rγnull鼠中黑素瘤干细胞的增长速率比NOD SCID鼠提高104倍[31]。AML的移植实验显示 SCID鼠中白血病-诱发细胞CD34+/CD38-群体的频率约为 1:2.5×105,在NOD SCID中提高10~100倍[21]。研究发现10只PU.1-/-AML(转录因子 PU.1-/-急性髓细胞性白血病)鼠的CSCs就足够用于移植白血病至同类动物[43]。在小鼠黑色素瘤细胞中,CD34+p75-和CD34-p75-细胞群启动肿瘤至受体鼠,但仅有后者产生了异种移植物,CD34+p75-细胞进行自我更新但无分化。p75+细胞群很少表现出启动肿瘤能力[44]。因此,在不同的肿瘤中,肿瘤启动细胞的特性和频率差异很大。
虽然异种移植至免疫缺陷鼠是CSCs研究的最基本方法,但系统相关问题需要仔细评估以正确的诠释CSCs的成瘤特性。种属特异的微环境因素和不同小鼠品系的免疫缺陷差异直接影响移植实验结果。
5 异种移植模型存在的问题
肿瘤干细胞分选后,异种移植到免疫缺陷鼠体内的实验结果受到实验操作的影响。移植干细胞在与原发肿瘤龛明显不同的环境中发展,要在鼠组织形成克隆,必须具备强大的能力,但是没有一个直接的证据来证明异种移植后的细胞行为确实反映了原发肿瘤内同一细胞的分级状态[11]。除了实验操作诱发的细胞应激之外,还有两个实验限制对于异种移植来说是固有的:物种障碍和移植程序。
物种障碍可能会阻碍某些重要的龛的功能如粘附分子或生长因子与其受体间的相互作用。如通过转铁蛋白-转铁蛋白受体系统进行必要的铁的传递,在跨越鼠-人物种屏障时效率仅为1%[45]。当通过移植鼠肿瘤细胞至完全组织相容的鼠体内克服物种障碍时,移植物成瘤效率会得到显著提高[46-48]。小鼠白血病[47-49],小鼠乳腺癌[50-52]和小鼠扁平细胞[53]的肿瘤干细胞往往可以比人肿瘤干细胞较好的优先植入。现在的研究发现,可以通过提供人生长因子[54]或人间质元件[55]进行代偿,或者是通过原位移植而不是皮下或肾被膜[56]移植来缓解。
Morrison等[57]指出:干细胞的移植可以显示干细胞在特定实验条件下的潜力,但不能揭示移植细胞在其原有组织或肿瘤内的命运。研究发现,肿瘤干细胞移植后行为发生很大改变[58]。
现在还没有直接的证据证明未经处理的实体瘤含有CSCs。因涉及到人暴露在射线下,临床不允许使用放射性标记技术在骨髓或白血病内示踪原始肿瘤干细胞或祖细胞。为了完善异种移植实验,必须能够显示出原发肿瘤内 CSCs功能性的存在,这依赖找到单一、确定的 CSCs标记基因。在这些标记的基础上,可以发展基因敲入小鼠模型或病毒标记策略进行遗传谱系追踪。目前,人 CSCs的原位鉴定还是空白。
总之,来自肿瘤细胞的CSCs作为干细胞可以在体外生长,而且保持在体内产生异种肿瘤的能力。结肠癌和肺癌的CSCs在培养一年多后在异位移植后重现肿瘤特性[13,25],且蛋白质组学特性保持不变。因此特定肿瘤干细胞异种移植模型建立需要在改善肿瘤干细胞移植程序、优化肿瘤干细胞异种移植微环境以及克服物种障碍等方面进行深入而系统的研究,从而为研究肿瘤发生与发展、筛选靶向肿瘤干细胞的新药提供有力的工具,也为临床肿瘤治疗提供新的线索与路径。
[1]Marta B,Mauro B,Lucia RV et al.New models for cancer research:human cancer stem cell xenografts[J].Current Opinion in Pharmacology,2010,10:380-384.
[2]Furth J,Kahn M.The transmission of leukemia of mice with a single cell[J].Am.J.Cancer,1937,31:276-282.
[3]Makino S.Further evidence favoring the concept of the stem cell in ascites tumors of rats[J].Ann.NY Acad.Sci.,1956,63: 818-830.
[4]Hewitt HB.Studies of the dissemination and quantitative transplantation of a lymphocytic leukaemia of CBA m ice[J].Br.J.Cancer,1958,12:378-401.
[5]Bruce WR,Van Der Gaag H.A quantitative assay for the number ofmurine lymphoma cells capable of proliferation in vivo[J].Nature,1963,199:79-80.
[6]K leinsmith LJ,Pierce GB.Multipotentiality of single embryonal carcinoma cells[J].Cancer Res.,1964,24:1544-1551.
[7]Belanger LF,Leblond CP.A method for locating radioactive elements in tissues by covering histological sections with a photographic emulsion[J].Endocrinology,1946,39:8-13.
[8]Clermont Y,Leblond CP.Renewal of spermatogonia in the rat[J].Am.J.Anat.,1953,93:475-501.
[9]Pierce GB,Wallace C.Differentiation of malignant to benign cells[J].Cancer Res.,1971,31:127-134.
[10]Pierce GB,Speers WC.Tumors as caricatures of the process of tissue renewal:prospects for therapy by directing differentiation[J].Cancer Res.,1988,48:1996-2004.
[11]Hans Clevers.The cancer stem cell:premises,promises and challenges[J].Nat Med.,2011,17(3):313-319.
[12]Zhou BB,Zhang H,Damelin M,et al.Tumour-initiating cells: challenges and opportunities for anticancer drug discovery[J].Nat Rev Drug Discov.,2009,8:806-823.
[13]Eramo A,Lotti F,Sette G,et al.Identification and expansion of the tumorigenic lung cancer stem cell population[J].Cell Death Differ.,2008,15:504-514.
[14]Dylla SJ,Beviglia L,Park IK,et al.Colorectal cancer stem cells are enriched in xenogeneic tumors following chemotherapy[J].PLoSOne,2008,3:e2428.
[15]Bertolini G,Roz L,Perego P,et al.Highly tumorigenic lung cancer CD133+cells display stem-like features and are spared by cisplatin treatment[J].Proc Natl Acad Sci USA,2009,106: 16281-16286.
[16]Diehn M,Cho RW,Lobo NA,et al.Association of reactive oxygen species levels and radioresistance in cancer stem cells[J].Nature,2009,458:780-783.
[17]Todaro M,Alea MP,Di Stefano AB,et al.Colon cancer stem cells dictate tumor growth and resist cell death by production of interleukin-4[J].Cell Stem Cell,2007,1:389-402.
[18]Ginestier C,Liu S,Diebel ME,et al.CXCR1 blockade selectively targets human breast cancer stemcells in vitro and in xenografts[J].JClin Invest.,2010,120:485-497.
[19]Magnifico A,Albano L,Campaner S,et al.Tumorinitiating cells of HER2-positive carcinoma cell lines express the highest oncoprotein levels and are sensitive to trastuzumab[J].Clin Cancer Res.,2009,15:2010-2021.
[20]Lapidot T,Sirard C,Vormoor J,et al.A cell initiating human acute myeloid leukaemia after transplantation into SCID mice[J].Nature,1994,367:645-648.
[21]Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med.,1997,3:730-737.
[22]Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100:3983-3988.
[23]Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells[J].Nature,2004,432:396-401.
[24]Patrawala L,Calhoun T,Schneider-Broussard R,et al.Highly purified CD44+prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells[J].Oncogene,2006,25:1696-1708.
[25]Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature,2007,445:111-115.
[26]Prince ME,Sivanandan R,Kaczorowski A,et al.Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma[J].Proc Natl Acad Sci USA,2007,104:973-978.
[27]Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res.,2007,67:1030-1037.
[28]Zhang S,Balch C,Chan MW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res.,2008,68:4311-4320.
[29]Chan KS,Espinosa I,Chao M,et al.Identification,molecular characterization,clinical prognosis,and therapeutic targeting of human bladder tumor-initiating cells[J].Proc Natl Acad Sci USA,2009,106:14016-14021.
[30]O'Brien CA,Pollett A,Gallinger S,et al.A human colon cancer cell capable of initiating tumour growth in immunodeficientm ice[J].Nature,2007,445:106-110.
[31]Quintana E,Shackleton MS,Michael S,et al.Efficient tumour formation by single human melanoma cells[J].Nature,2008,456:593-598.
[32]Quintana E,Shackleton M,Foster HR,et al.Phenotypic heterogeneity among tumorigenic melanoma cells from patients that is reversible and not hierarchically organized[J].Cancer Cell,2010,18:510-523.
[33]Bonnet D,Dick JE.Human acutemyeloid leukemia is organized as ahierarchy that originates from a pn mitive hematopoietie cell[J].Nat Med.,1997,3(7):730-737.
[34]Schatton T,Murphy GF,Frank NY,et al.Identification of cells initiating human melanomas[J].Nature,2008,451:345-349.
[35]Shen Y,Cao D.Hepatocellular carcinoma stem cells:origins and roles in hepatocarcinogenesis and disease progression[J].Front Biosci.,2012,4:1157-1169.
[36]Monteiro J, Fodde R. Cancer stemness and metastasis: Therapeutic consequences and perspectives[J].Eur J Cancer,2010,46:1198-1203.
[37]Galli R,Binda E,Orfanelli U,Cipelletti B,et al.Isolation and characterization of tumorigenic,stem-like neural precursors from human glioblastoma[J].Cancer Res.,2004,64:7011-7021.
[38]Ricci-Vitiani L,Pallini R,Larocca LM,et al.Mesenchymal differentiation of glioblastoma stem cells[J].Cell Death Differ.,2008,15:1491-1498.
[39]Carpentino JE,Hynes MJ,Appelman HD,et al.Aldehyde dehydrogenase-expressing colon stem cells contribute to tumorigenesis in the transition from colitis to cancer[J].Cancer Res.,2009,69:8208-8215.
[40]Ginestier C,Hur MH,Charafe-Jauffret E,et al.ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J].Cell Stem Cell,2007,1: 555-567.
[41]Liu S,Dontu G,Mantle ID,et al.Hedgehog signaling and Bmi-1 regulate selfrenewal of normal and malignant human mammary stem cells[J].Cancer Res.,2006,66:6063-6071.
[42]Ginestier C,Liu S,Diebel ME,et al.CXCR1 blockade selectively targets human breast cancer stemcells in vitro and in xenografts[J].JClin Invest,2010,120:485-497.
[43]Kelly PN,Dakic A,Adams JM,et al.Tumor growth need not be driven by rare cancer stem cells[J].Science,2007,317:337.
[44]Held MA,Curley DP,Dankort D,et al.Characterization of melanoma cells capable of propagating tumors from a single cell[J].Cancer Res.,2010,70:388-397.
[45]Ill CR,Brehm T,Lydersen,B.K.,et al.Species specificity of iron delivery in hybridomas[J].In Vitro Cell.Dev.Biol.,1998,24:413-419.
[46]Kelly PN,Dakic A,Adams JM,et al.Tumor growth need not be driven by rare cancer stem cells[J].Science,2007,317:337.
[47]Krivtsov AV,Twomey D,Feng Z,et al.Transformation from committed progenitor to leukaemia stem cell initiated by MLLAF9[J].Nature,2006,442:818-822.
[48]Yilmaz OH,Valdez R,Theisen BK,et al.Pten dependence distinguishes haematopoietic stem cells from leukaemia-initiating cells[J].Nature,2006,441:475-482.
[49]Deshpande AJ,Cusan M,Rawat VP,et al.Acute myeloid leukemia is propagated by a leukemic stem cell with lymphoid characteristics in a mouse model of CALM/AF10-positive leukemia[J].Cancer Cell,2006,10:363-374.
[50]Cho RW,Wang X,Diehn M,et al.Isolation and molecular characterization of cancer stem cells in MMTV-Wnt-1 murine breast tumors[J].Stem Cells,2008,26:364-371.
[51]Vaillant F,Asselin-Labat ML,Shackleton M,et al.The mammary progenitor marker CD61/β3 integrin identifies cancer stem cells in mouse models of mammary tumorigenesis[J].Cancer Res.,2008,68:7711-7717.
[52]Zhang M.Behbod F,Atkinson RL,et al.Identification of tumor-initiating cells in a p53-nullmouse model of breast cancer[J].Cancer Res.,2008,68:4674-4682.
[53]Malanchi I,Peinado H,Kassen D,et al.Cutaneous cancer stem cell maintenance is dependent onβ-catenin signalling[J].Nature,2008,452:650-653.
[54]Feuring-Buske M,Gerhard B,Cashman J,et al.Improved engraftment of human acute myeloid leukemia progenitor cells in β2-microglobulin-deficient NOD/SCID mice and in NOD/SCID mice transgenic for human growth factors[J].Leukemia,2003,17:760-763.
[55]Karnoub AE,Dash AB,Vo AP,et al.Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J].Nature,2007,449:557-563.
[56]Kennedy JA,Barabe F,Poeppl AG,et al.Comment on“Tumor growth need not be driven by rare cancer stem cells”[J].Science,2007,318:1722.
[57]Shackleton M,Quintana E,Fearon ER,et al.Heterogeneity in cancer:cancer stem cells versus clonal evolution[J].Cell,2009,138:822-829.
[58]Blanpain C,Horsley V,Fuchs E.Epithelial stem cells:turning over new leaves[J].Cell,2007,128:445-458.
