大黄鱼Hepcidin基因转录物的相对定量分析
2012-01-31吴曼丽范丹青
蔡 灵, 吴曼丽, 范丹青, 杨 明
(1.厦门大学近海海洋国家重点实验室,福建厦门361005;2.上海大学环境与化学工程学院,上海200444)
实时荧光定量PCR方法(real-time quantitative PCR)是指在PCR指数扩增期间,通过连续监测荧光信号强弱的变化来即时测定特异性产物的量,并根据标准曲线定量未知模板的方法.该方法具有准确、灵敏和简便等特点,在微生物检测、转基因食品检测和基因表达研究等方面具有重要的应用价值[1].实时定量PCR方法分为以检测目的基因自身含量的绝对定量和以内参基因为参比进行的相对定量两类.相对定量根据参照基因和目的基因的扩增效率是否接近,又分为双标准曲线相对定量法和比较Ct(cycle threshold)相对定量法.在这两个相对定量法中,当目的基因和参照基因的扩增效率接近时,比较Ct相对定量法是公认的得到实验结果更为快捷和方便的方法[2].因此,选择合适的内参基因,设计合适的引物,建立合适的PCR反应条件是实时定量PCR方法建立的重要环节[3].
持家基因(house-keeping gene)又称管家基因,是指所有细胞中均要表达的一类基因.超过90%的研究者使用3-磷酸甘油醛脱氢酶,β-actin,18S rRNA和28S rRNA作为参照基因进行定量[4].由于这些基因在个体各个生长阶段的大多数,或几乎全部组织中持续表达或变化很小,因此,其表达水平受环境因素的影响较小,只受启动序列或启动子与RNA聚合酶相互作用的影响,而不受其他机制的调节.上述管家基因可作为实时荧光定量的内参基因,通过校正转录效率和起始模板的用量,使不同样本目的基因的比较成为可能[5-6].
大黄鱼(Pseudosciaena crocea)是我国沿海重要的经济鱼类,但因酷渔滥捕,现今渔汛消失,野生大黄鱼濒临绝迹.目前市售的大黄鱼均以人工养殖为主,但由于其在养殖过程中较易受病害影响,因而导致养殖风险和成本较高,市售价格昂贵.开展大黄鱼体内免疫功能相关基因的研究,对人工养殖大黄鱼的病害防治具有重要的理论意义和广阔的应用前景.本研究克隆了内参基因的序列,建立了大黄鱼抗菌肽Hepcidin基因(pc-hepc)的实时相对定量分析方法,完成了大黄鱼免疫器官中Hepcidin基因转录物的相对定量分析.该工作不仅为开展Hepcidin抗菌肽基因表达特性等的研究奠定了基础,而且为开展其他鱼类中免疫相关基因体内表达机制的研究提供了参照.
1 材料与方法
1.1 实验材料与试剂
大黄鱼取自福建福州罗源湾养殖场,平均体重为40 g.
脂多糖(lipopolysaccharide,LPS),Sigma公司; Trizol试剂盒,Invitrogen公司;PrimeScriptTMRT Reagent Kit反转录试剂盒、TaKaRa PMDT-18质粒连接试剂盒、DNA Marker,大连宝生物公司;Qiaquick Gel Extraction Kit,QIAGEN公司;Power SYBR Green PCR Master Mix荧光定量试剂,Applied Biosystem公司;DIG High Prime DNA Labeling and Detection Starter KitⅠ,Roche公司;所有引物由上海生物工程有限公司合成;其他试剂均为国产分析纯.
1.2 实验方法
1.2.1 组织样本采集及其RNA提取
攻毒组(A组)大黄鱼腹腔注射800 μg LPS,对照组(B组)注射等体积生理盐水,48 h后采集样品(样品数量n=3).现场解剖,取头肾组织样品迅速放入液氮中,-80℃冰箱保存.使用Trizol试剂盒抽提RNA.核酸蛋白含量测定仪(GE公司)检测RNA的浓度和质量.
1.2.2 内参基因(18S rRNA和β-actin)序列的获得
根据GenBank中黑鲷Hepcidin基因的序列设计18S rRNA和β-actin基因的引物,如表1所示.使用PrimeScriptTMRT Reagent Kit进行反转录,并在PTC-200型PCR仪(MJ Research公司)上进行PCR扩增.PCR反应条件为:94℃变性3 min;随后进行30个循环的94℃变性30 s,55℃退火40 s和72℃延伸1 min;最后,72℃延伸 5 min.PCR产物经Qiaquick Gel Extraction Kit回收纯化后,使用TaKaRa PMDT-18载体连接试剂盒连接转化,并由上海生工生物工程公司测序.

表1 用于序列扩增和实时定量PCR的引物Table 1 Primers for sequence amplifications and real-time PCR
1.2.3 实时荧光定量RT-PCR
取500 ng大黄鱼头肾RNA进行反转录.经优化PCR条件后,按1 ng RNA转录为1 ng cDNA计算,取2 ng稀释后的反转录产物加入20 μL反应体系中,同时加入浓度为10 μM的上、下游引物各1 μL.使用Power SYBR Green PCR Master Mix试剂进行实时荧光定量PCR.PCR反应条件为:60℃ 2 min,95℃ 10 min;随后进行40个循环的95℃ 15 s,60℃ 1 min,并在60℃采集荧光信号.PCR程序结束后,对PCR反应产物进行溶解曲线的测定,反应程序为:95℃ 15 s,60℃ 1 min,95℃15 s.
1.2.4 Northern-blot实验
采用 DIG HighPrimeDNA Labelingand Detection Starter KitⅠ试剂盒标记Hepcidin探针.等量混合A组和B组各3条鱼的头肾RNA,并取40 μg总RNA进行甲醛变性凝胶电泳,按试剂盒说明书进行Northern-blot实验.扫描Northern-blot实验结果,并使用Bio-Rad公司的Quantity One软件对Northern-blot结果图中的条带进行光强度分析,以确定各条带的光强度及其占总光强度的比例.
1.2.5 数据统计与分析
以50 ng cDNA为起始量进行10倍梯度稀释,获得扩增效率标准曲线.扩增效率标准曲线使用Origin 7.0软件绘制,横坐标为稀释倍数的lg值,纵坐标为荧光定量分析的Ct值.
使用比较Ct法分析实时荧光定量PCR数据时,要求内参基因和目标基因的扩增效率一致.当满足上述条件时,取一个样品的荧光值,用ΔCt(即目标基因与内参基因Ct值的差值)进行标准化.比较不同的样品相对量时,用标准化后的值,即不同样品的ΔCt的差值进行比较,即Δ(ΔCt)=ΔCt1-ΔCt2.最后,当转化成RNA水平实际变化倍数时,结果为Y= 2-Δ(ΔCt)[4].本实验的相对定量数据以18S rRNA基因片段为内参,采用B组第一条鱼的Hepcidin表达量进行数据归一化,采用2-Δ(ΔCt)方法进行计算.
2 实验结果
2.1 大黄鱼头肾总RNA的提取
紫外分光光度计测定总RNA的吸光值A260/A280在1.8~2.0之间,证明了所提取的RNA纯度较高,无蛋白和DNA污染.取微量总RNA提取液进行1%琼脂糖凝胶电泳,结果显示,rRNA具有完整带型,证明提取的RNA较完整,无降解.
2.2 大黄鱼18S rRNA和β-actin片段的cDNA序列及序列的同源性分析
经过序列相似性比对分析,本实验首次扩增出了大黄鱼的18S rRNA和β-actin的cDNA序列片段,并已登录GenBank获得了登录号,结果如表2所示.

表2 大黄鱼18S rRNA和β-actin片段的序列相似性分析Table 2 Similarity analysis of 18S rRNA and β-actin fragments
2.3 大黄鱼3种基因的扩增和溶解曲线
图1为多次重复的实时荧光定量PCR产物溶解曲线图,其中凝胶电泳图代表普通PCR扩增产物,溶解曲线图代表实时荧光定量PCR扩增产物; M1为 100 bp ladder DNA Marker,M2为 DL2000 DNA Marker.可以看出,利用所设计的引物扩增出的Hepcidin,18S rRNA和β-actin等目的基因片段,都具有各自单一的溶解温度,分别为80,78和84℃; PCR反应产物特异,并且琼脂糖凝胶电泳也证明了其PCR产物单一,没有二聚体的产生.
2.4 实时荧光相对定量 PCR方法检测大黄鱼Hepcidin基因方法的建立
2.4.1 扩增效率标准曲线
图2为大黄鱼3种基因实时荧光定量PCR的扩增效率标准曲线,其中x为模板基因的稀释倍数.由图2(a)可见,18S rRNA基因扩增曲线的斜率与Hepcidin基因斜率相差(Δk)仅为0.08,线性回归系数差值(ΔR2)小于0.005,符合比较Ct法分析的要求.在图2(b)中,β-actin基因扩增曲线的斜率与Hepcidin基因斜率差为0.22,ΔR2也小于0.005.比较而言,18S rRNA更接近Hepcidin基因的扩增效率,因此,更适合用于比较Ct法分析的实时定量PCR.
2.4.2 与Norther-blot结果的比较
为了验证大黄鱼内参基因18S rRNA用于实时荧光定量方法的可行性和有效性,将PCR的实验结果与Northern-blot的实验结果进行了比较,结果如图3所示,其中A为对照组样品,B为攻毒组样品,M为RNA Marker 1000.结果表明,利用实时荧光定量PCR方法分析,攻毒组大黄鱼经LPS诱导,头肾中的Hepcidin基因被诱导并升高至对照组的1.80倍;而利用Northern-blot方法分析,攻毒组大黄鱼头肾中的Hepcidin基因被诱导至对照组的2.11倍,证明两种方法所得的结果基本一致.
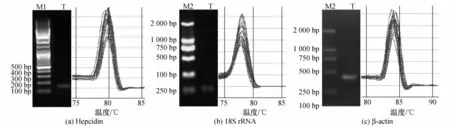
图1 普通PCR扩增产物电泳图和实时荧光定量PCR产物溶解曲线Fig.1 Agrose gel analysis and melting curve anlaysis of the PCR products
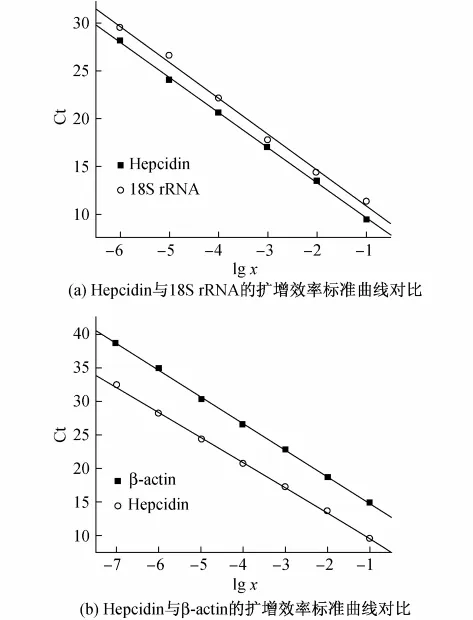
图2 大黄鱼3种基因实时荧光定量PCR的扩增效率标准曲线Fig.2 Relative standard curves of the hepcidin,18S rRNA and β-actin genes from the large yellow croaker using real-time PCR
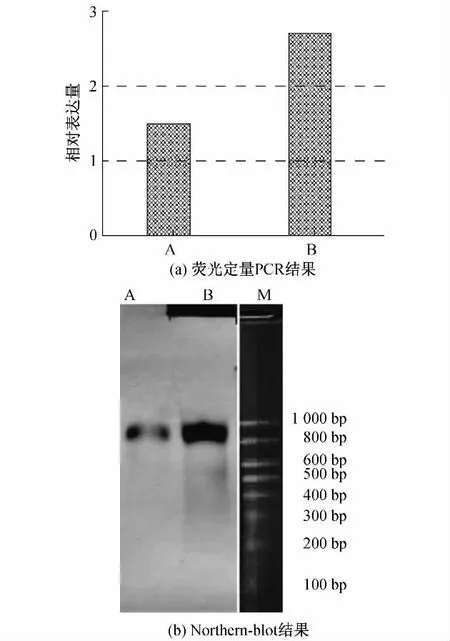
图3 Hepcidin基因实时荧光定量 PCR结果与Northern-blot结果比对Fig.3 Comparison ofthe hepcidin gene quantity obtained from real-time PCR and Northern-blot
3 讨论
本研究建立了大黄鱼Hepcidin抗菌肽基因实时荧光相对定量分析方法,与传统的Northern-blot半定量基因表达方法相比,本方法利用了内参基因进行校正,使结果更加准确可靠.由于Northern-blot实验直接操作RNA进行电泳,而RNA又极易在实验中降解,因此,对实验者的实验技能和对实验过程的控制要求较严格.同时,Northern-blot的每个样品的RNA用量,如本实验中的40 μg总RNA上样量,远大于荧光定量PCR的500 ng总RNA初始量.因此,在操作大量基因的表达检测时,实时荧光定量PCR相比传统的Northern-blot方法,优势非常明显.
抗菌肽Hepcidin是一种重要的先天性免疫因子,于2000年由Krause从人类血浆中分离出来.由于抗菌肽在肝脏表达,因此,被命名为Hepcidin或LEAP-1(liver expressed antimicrobial peptide)[7].随后,在小鼠、猪、狗等多个哺乳动物物种中均发现了这一抗菌肽的存在[8-10].2002年,Shike等[11]在细菌诱导的杂交斑纹鲈鱼(Morone saxatilis×Morone chrysops)鳃中发现了鱼类中的第一个Hepcidin抗菌肽.此后,在大西洋鳕鱼(Gadus morhua)[12]、花鲈(Lateolabrax japonicus)[13]、 黑 鲷 (Sparus macrocephlus)[14-16]等多种鱼类中也发现了这一抗菌肽的存在.Hepcidin家族的抗菌肽是一种保守的富含半胱氨酸,具有二硫键结构的抗菌肽.研究表明,Hepcidin抗菌肽在人体等哺乳动物中是一种调节体内铁稳态的关键物质和一种极为重要的铁代谢调激素[7-10].在鱼类中,Hepcidin抗菌肽在先天免疫相关方面发挥着更为广泛的作用.鱼类体内存在多个Hepcidin抗菌肽变体,细菌、致炎物质等均可影响Hepcidin在鱼体内各器官组织中的表达合成[16].研究发现,Hepcidin的不同变体不仅可以诱发免疫相关基因的表达合成,同时具有抑制肿瘤细胞的活性,并在病毒感染细胞后起到保护细胞抵抗病毒侵染的作用[17-18].这些研究进一步证实了Hepcidin抗菌肽对鱼类先天免疫作用的重要性.
4 结束语
开展大黄鱼体内Hepcidin基因的研究,利用本实验建立的实时荧光定量分析方法对其基因进行定量检测,可以更加深入地了解大黄鱼抗菌肽的表达情况,为进一步开展大黄鱼的先天免疫机制研究奠定了基础.Hepcidin抗菌肽在大黄鱼中的研究不仅对减少大黄鱼养殖病害有所助益,同时也对其他养殖鱼类的病害防治具有普遍的意义.
[1] 王宇,刘景晶.核酸的定量技术研究进展[J].药学进展,2006,30(9):385-390.
[2] LIVAKK J,SCHMITTGENT D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[3] DUNCANA,DYLANN C,FIONAS,et al.Expression stability of commonly used reference genes in canine articular connective tissues[J].BMC Vet Res,2007,3:7.
[4] TRICARICO C,PPINZANIP,BIANCHIS,etal.Quantitative real-time reverse transcription polymerase chain reaction: normalization to rRNA or single housekeeping genes is inappropriate for human tissue biopsies[J].Anal Biochem,2002,309(2):293-300.
[5] BUSTINS A.Quantification of mRNA using real-time reverse transcription PCR (RT-PCR):trendsand problems[J].Mol Endocrinol,2002,29(1):23-39.
[6] HUGGETTJ,DHEDAK,BUSTINS,et al.Real-time RTPCR normalization,strategies and considerations[J].Genes Immun,2005,6:279-284.
[7] KRAUSEA,NEITZS,MAGERTA S,et al.LEAP-1,a novel highly disulfidebonded human peptide,exhibits antimicrobial activity[J].FEBS Lett,2000,480:147-150.
[8] PIGEONC,ILYING,COURSELAUDB,et al.A new mouse liver-specific gene,encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during iron overload[J].Biol Chem,2001,276:7811-7819.
[9] ZHANGAS,XIONGS,TSUKAMOTOH,etal.Localization of iron metabolism-related mRNAs in rat liver indicate that HFE is expressed predominantly in hepatocytes[J].Blood,2004,103:1509-1514.
[10] SANGY,RAMANATHANB,MINTONJ E,et al.Porcine liver-expressed antimicrobialpeptides,hepcidin and LEAP-2:cloning and induction by bacterial infection[J].Dev Comp Immun,2006,30:357-366.
[11] SHIKEH,LAUTHX,WESTERMANM E,et al.Bass hepcidin is a novel antimicrobial peptide induced by bacterial challenge[J].Eur J Biochem,2002,269: 2232-2237.
[12] SUSANE D,JEFFREYW G,LIEBSCHERR S,et al.Identification and expression analysis of hepcidin-like antimicrobial peptides in bony fish[J].Dev Comp Immun,2003,27:589-601.
[13] RENH L,WANGK J,ZHOUH L,et al.Cloning and organisation analysis of a hepcidin-like gene and cDNA from Japan sea bass,Lateolabrax japonicus[J].Fish Shellfish Immun,2006,21(3):221-227.
[14] YANGM,WANGK J,CHENJ H,et al.Genomic organization and tissue-specific expression analysis of hepcidin-like genes from black porgy(Acanthopagrus schlegelii B)[J].Fish Shellfish Immun,2007,23(5):1060-1071.
[15] 蔡晶晶,杨明,蔡灵,等.黑鲷抗菌肽hepcidin在毕赤酵母中的表达及其抗菌活性[J].厦门大学学报:自然科学版,2009,48(5):838-743.
[16] YANGM,CHENB,CAIJJ,etal.Molecular characterization of hepcidin AS-hepc2 and AS-hepc6 in black porgy (Acanthopagrusschlegelii):expression pattern responded to bacterial challenge and in vitro antimicrobial activity[J].Comp Biochem Phys B,2011,158(2):155-163.
[17] CHENJ Y,PANC Y,CHENJ Y.Tilapia hepcidin (TH)2-3 as a transgene in transgenic fish enhances resistance to Vibrio vulnificusinfection and causes variations in immune-related genes after infection by different bacterial species[J].Fish Shellfish Immun,2010,29(3):430-439.
[18] CHENJ Y,VENUGOPALR.Antiviral function of tilapia hepcidin 1-5 and its modulation of immune-related gene expressions against infectious pancreatic necrosis virus (IPNV)in Chinook salmon embryo(CHSE)-214 cells[J].Fish Shellfish Immun,2011,30(1):39-44.
