RT-SHIV rt基因单拷贝PCR扩增方法的建立及初步应用
2012-01-30杜文达苏爱华高锡强
鞠 斌,王 卫,丛 喆,姚 南,陈 霆,杜文达,苏爱华,高锡强,魏 强
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
RT-SHIV嵌合病毒[1]包含逆转录酶抑制剂靶点,是艾滋病新药研究中的重要靶病毒[2]。准确了解RT-SHIV病毒rt基因的具体序列信息,对于病毒体内复制动力学和耐药突变研究具有重要意义[3]。
传统PCR方法获得的目的片段为混合产物,来源于不同的病毒拷贝,且存在模板选择等问题,无法反映出体内病毒变异的真实情况。单拷贝 PCR是近年来新兴的一种PCR方法[4],通过扩增模板的减少来避免序列选择和重组的发生,能全面地了解体内病毒序列。然而,目前应用于单拷贝扩增全长rt基因的方法尚未建立,影响了相关研究的深入进行[5]。本研究拟建立一种单拷贝 PCR方法,扩增RT-SHIV病毒的全长rt基因,用于病毒体内复制相关实验研究。本研究将填补病毒全长 rt基因相关研究的空白,并且所建立的方法能够应用于各类RT-SHIV和 RT/env-SHIV嵌合病毒,以及 SIV病毒,具有广泛的应用价值。
1 材料和方法
1.1 质粒
以含有SIVmac239全长病毒的质粒为骨架,替换进HIV-1rt基因,构建的RT-SHIV全长病毒质粒(本实验室构建,未发表)。NanoDrop 2000微量紫外分光光度计(Thermo)测定RT-SHIV全长质粒的浓度,依据公式:
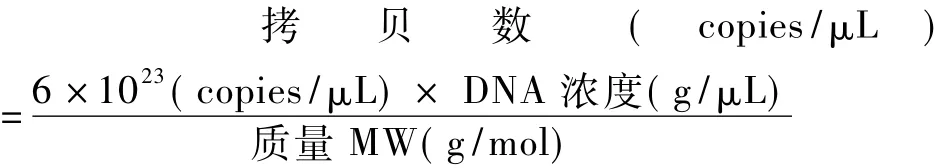
其中,MW=DNA碱基数(bp)×660daltons/bp
计算拷贝数,将质粒进行10倍系列梯度稀释,获得一系列模板浓度。
1.2 血浆样品
RT-SHIV感染猴血浆(本实验室储存)。应用QIAamp Viral RNA Mini Kit(Qiagen)提取病毒RNA,实时荧光定量 PCR[6]计算拷贝数约为 300copies/m L。
1.3 设计并优化rt基因特异性扩增引物
使用Oligo软件设计6对扩增引物,见表1。
筛选rt基因特异性扩增引物,PCR反应体系为25μL,内含引物各 0.4mmol/L、Mg2+2mmol/L、dNTP 0.4mmol/L、Taq DNA聚合酶1U和模板2.5μL,94℃预变性5m in,然后进行35个循环(94℃变性30s,Tm-5℃退火 30s,72℃延伸 2min ~3.5min),72℃下保温10min。6对候选引物分别按上述体系进行PCR反应,电泳检测,筛选出扩增特异性好、效率高、重复性好的引物。

表1 rt基因扩增引物Tab.1 Amp lification primers of rt gene
1.4 优化PCR条件,确定最佳退火温度和反应最佳循环数
以引物的理论退火温度为中心温度,间隔1℃,共8个梯度,进行梯度 PCR,电泳检测,同时使用
Image J 1.41软件(NIH)对电泳图进行灰度分析,确定出引物的最佳退火温度。配制一系列PCR反应液置于PCR仪中,预反应44个循环,反应进行到14个循环时取出一管,之后每隔2个循环取出一管,直至44个循环结束,电泳检测,确定出反应的最佳循环数。
1.5 确定单拷贝PCR扩增最适模板浓度
使用上述方法扩增RT-SHIV全长rt基因,梯度稀释质粒模板,直至扩增阳性率小于30%,按照泊松分布,此时扩增产物为单拷贝序列[7]。
1.6 血浆中 RT-SHIV病毒全长 rt基因的单拷贝PCR扩增
从 RT-SHIV感染猴血浆样本中提取出病毒RNA,逆转录成cDNA为模板,使用本文建立的方法扩增RT-SHIV全长rt基因,然后进行有限地稀释,扩增单拷贝序列,电泳检测,诺赛公司序列测定,BioEdit软件序列分析。
2 结果
2.1 质粒拷贝数的计算
RT-SHIV质粒全长为13216bp,分光光度计测定质粒浓度为150ng/μL,按上述公式计算质粒浓度约为1×1010copies/μL,10倍系列稀释至1×102copies/μL,得到9个不同的模板浓度。
2.2 筛选rt基因特异性扩增引物
6对引物以高浓度(拷贝数为 1×106copies/μL)质粒作模板进行初筛,电泳检测,如图1所示,使用引物RT-out-F/R扩增时,所得产物特异性较差,在约400bp处存在明显的非特异性扩增,条带较弱扩增效率也不高,虽然阳性率高达100%,但各平行管间重复性较差,使用Image J软件灰度扫描后比对各平行管间差异较大,变异系数(CV%)为72.46远高于其他引物,不适合作为扩增 rt基因引物。
剩余5对引物低浓度(拷贝数为1×104copies/μL)质粒作模板继续筛选,电泳检测,结果如图2所示,只有引物TC-out-F1/R1和 RT-F/R扩增阳性率为100%,且没有出现非特异性扩增、扩增特异性好,平行管间亮度比较一致、重复性高,而其余引物扩增阳性率均未达到100%、条带亮度较弱、扩增效率不高,同时如引物TC-out-F2/R2结果所示,平行管间亮度差别较大、扩增重复性较差。使用Image J软件灰度扫描也得出一致的结果,如表2所示,扩增阳性率最高的为引物TC-out-F1/R1和 RT-F/R,均达到了100%;产物产量最高的是引物TC-out-F2/R2,但其标准差较大,平行管间重复性较差;变异系数最小的为引物TC-F2/R2,其次是 RT-F/R和TC-out-F1/R1,但是引物TC-F2/R2的扩增阳性率最低,仅为60%。故综合扩增特异性、阳性率、效率和重复性等条件考虑,选择引物TC-out-F1/R1和 RT-F/R作为特异性扩增rt基因的外套和内套引物。
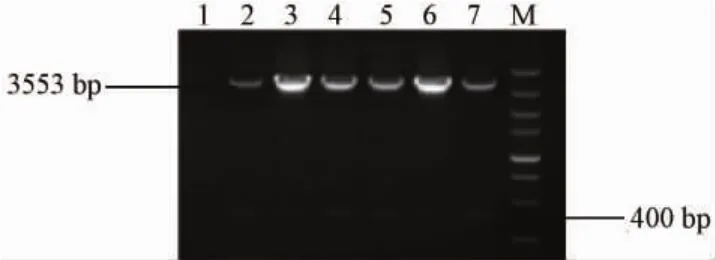
图1 RT-out-F/R扩增产物注:1:阴性对照 2-7:RT-out-F/R扩增产物M:DL5000Fig.1 Amplification products of RT-out-F/RNote:1:Negative control;2-7:Amplification products ofRT-out-F/R;M:DL5000
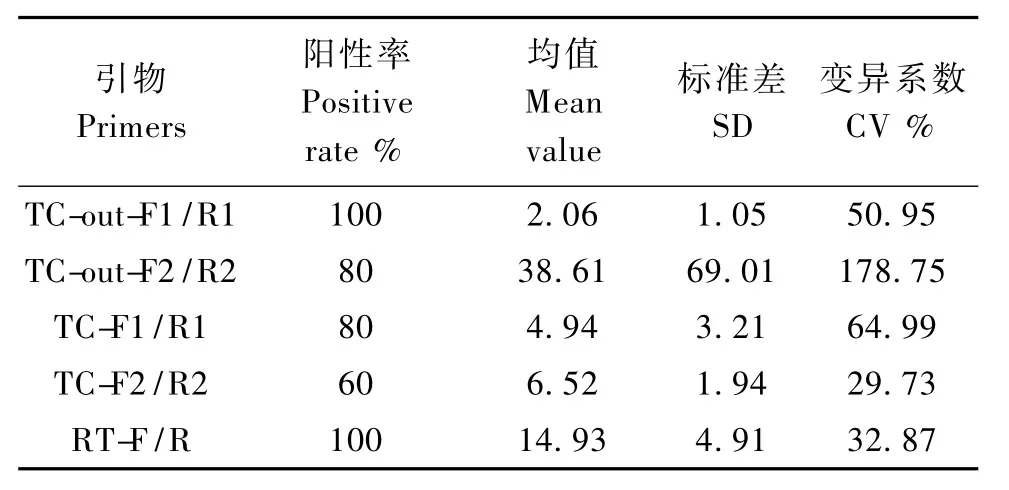
表2 5对引物扩增比较结果Tab.2 Comparison of the amplification results of the five pairs of primers
2.3 最佳退火温度的确定
随着退火温度的改变,PCR扩增效率发生明显变化,效率最高处即定为最佳退火温度,引物TC-out-F1/R1和 RT-F/R的最佳退火温度范围分别为(46.4~48.6)℃和(49.4~50.4)℃,见图3,最终选择为48℃和50℃。
2.4 PCR反应最佳循环数的确定
选取PCR反应过程中第14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44个循环时分别检测产物扩增量,从图4A中可以看出,使用 TC-out-F1/R1引物扩增时,从20个循环开始出现目的条带,随着循环数的增加,亮度逐渐增加,当循环数至34个时,可以看到清晰的条带,随着循环数的增加,目的基因产量并没有明显增加,表明PCR反应已至平台期,使用TC-out-F1/R1引物扩增的最佳循环数为34个循环。同理,使用RT-F/R引物从36个循环开始反应进入平台期,最佳循环数为36个循环。使用Image J软件灰度扫描也得出一致的结果,如图4所示,引物TC-out-F1/R1和RT-F/R分别在第34和36个循环时,反应进入平台期,最终最适循环数分别为34和36个循环。
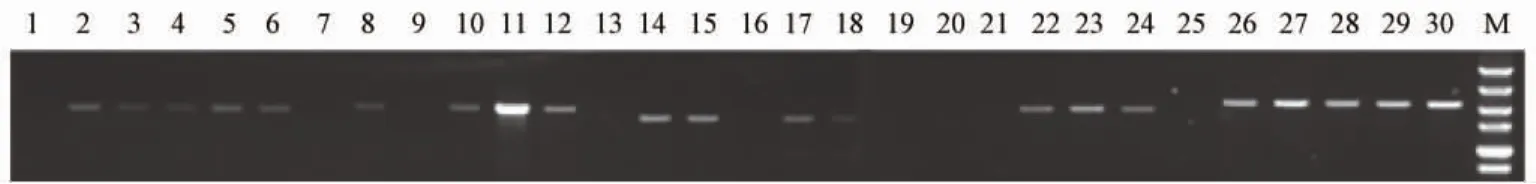
图2 5对引物扩增产物注:1,7,13,19,25:阴性对照;2-6:TC-out-F1/R1,2527 bp;8-12:TC-out-F2/R2,2383bp 13-18:TC-F1/R1,1986bp;20-24:TC-F2/R2,1945bp;25-30:RT-F/R,2186bp;M:DL5000Fig.2 Amplification products of the 5pairs of primersNote:1,7,13,19,25:Negative control;2-6:TC-out-F1/R1,2527 bp;8-12:TC-out-F2/R2,2383bp;13-18:TC-F1/R1,1986bp;20-24:TC-F2/R2,1945bp;25-30:RT-F/R,2186bp;M:DL5000
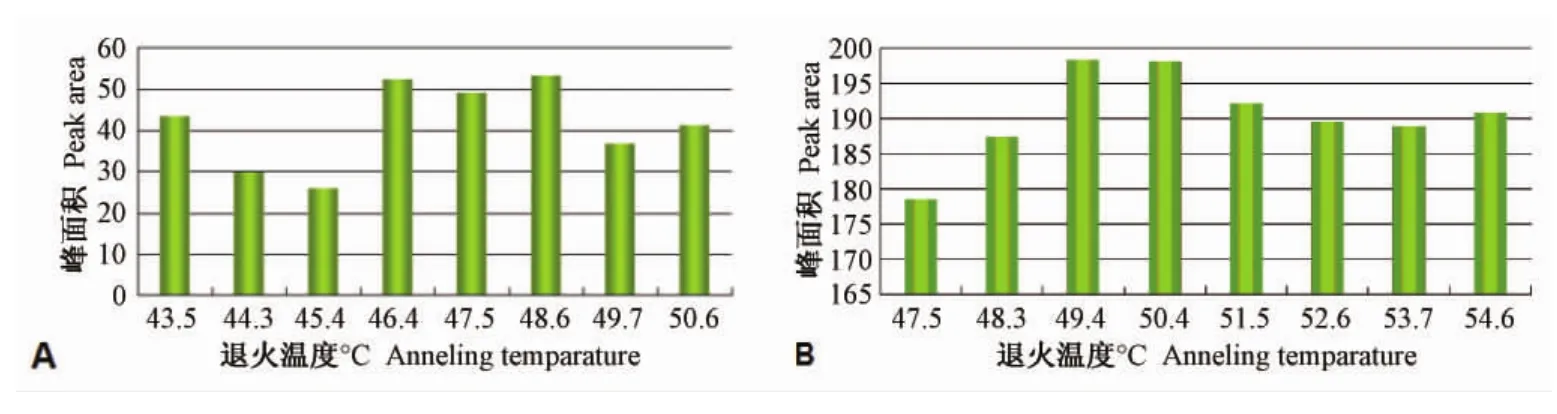
图3 梯度PCR结果 (A:TC-out-F1/R1,B:RT-F/R)Fig.3 Rsults of gradient PCR(A:TC-out-F1/R1,B:RT-F/R)
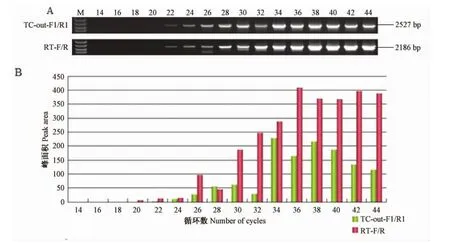
图4 不同循环数PCR结果(A:电泳结果;B:灰度分析结果)Fig.4 The results of PCR with different number of cycles(A:Results of electrophoresis.B:Gray value analysis)
2.5 确定单拷贝PCR扩增最适模板浓度
有限稀释的模板一轮 48℃退火,34个循环;二轮50℃退火,36个循环,电泳检测,如图5所示,模板浓度为1×103copies/μL时,扩增阳性率达80%,未达到单拷贝要求;当模板浓度为1×102copies/μL时,扩增阳性率为20%,符合单拷贝PCR要求。
2.6 单拷贝PCR扩增血浆中RT-SHIV病毒全长rt基因
使用本文建立的方法扩增载量约为300copies/mL的RT-SHIV感染猴血浆样本中全长 rt基因,电泳检测,如图6所示,该方法扩增所得产物特异性好、扩增效率高;将模板进行10倍稀释,扩增阳性率约为66%,20倍稀释后阳性率约为16%,进而估算出要想达到单拷贝PCR低于30%阳性率的要求,需进行约16倍稀释。将单拷贝PCR模板所需稀释度与病毒载量结果联系起来,使得所建立的方法更加方便准确。
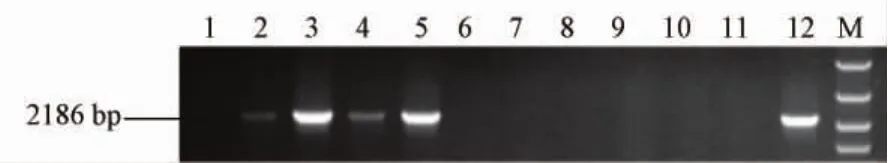
图5 10倍稀释标准品电泳结果注:1,7:阴性对照;2-6:1×103 copies/μL;8-12:1×102 copies/μL;M:DL5000Fig.5 Results of electrophoresis obtained from 10-fold serial dilutions of standardNote:1,7:Negative control;2-6:1×103 copies/μL;8-12:1×102 copies/μL;M:DL5000
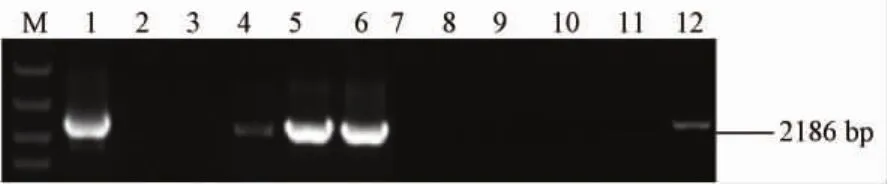
图6 RNA模板电泳结果注:M:DL5000;1-6:10倍稀释;7-12:20倍稀释Fig.6 Results of electrophoresis obtained from the RNA templateNote:M:DL5000;1-6:10-fold dilution;7-12:20-fold dilution
2.7 HIV-1rt基因序列分析
HIV-1rt基因全长1680bp,包括聚合酶区、连接区和RNase H区,测序结果显示,扩增产物含有全长的rt基因,未发生重组,病毒在体内复制过程中存在变异,本文初步分析了 RT-SHIV感染猴 d266和d294样本,结果显示,与原始序列相比,d266样本全长rt基因只发生了1处M403I氨基酸改变;而d294样本全长rt基因发生了6处氨基酸改变,分别是E29K、E42K、G196R、R311K、M403I、E514K。该方法能够准确地反应病毒序列的真实情况,为研究分析艾滋病猴模型中病毒遗传变异情况打下了良好的基础。
3 讨论
HIV-1的rt基因是抗病毒治疗的一个重要靶点,然而在体内复制过程中极易产生突变,尤其是多种耐药性突变的出现会导致抗病毒治疗的失败,通过扩增得到尽可能多的病毒序列,真实反映体内病毒遗传变异情况,研究体内病毒群体多样性和治疗过程中rt基因的序列变异情况,对于抗病毒药物的筛选以及新药的研发有着重要的意义。但是,目前尚未建立起完善的rt基因检测手段,阻碍了相关研究的进展。
本文建立了较成熟的RT-SHIV全长rt基因单拷贝PCR扩增方法,可对全长rt基因进行序列分析,两对引物TC-out-F1/R1和RT-F/R的最佳退火温度分别为48℃和50℃,反应的最佳循环数分别为34和36个循环。当模板浓度为100copies/μL时,扩增得到单拷贝序列,能够扩增出大量的全长rt基因,最大程度上反应了体内病毒序列的真实信息。同时,由于两对引物定位于RT-SHIV病毒的SIV骨架上,故可应用于各类 RT-SHIV和SIV病毒,具有广泛的应用范围。使用该方法从感染猴血浆中扩增RT-SHIV全长rt基因,特异性强,扩增效率高,血浆载量为300copies/mL的样本经16倍稀释后,所得产物为单拷贝序列。初步分析了RT-SHIV感染猴体内病毒的rt基因,能够监测到病毒在体内复制过程中氨基酸的变异情况。
传统的PCR方法得到的是混合型产物,来源于不同的病毒拷贝,测序分析时会遗漏掉许多重要的序列信息。而本文建立的方法通过有限地稀释模板,能够扩增出大量的单拷贝序列,最真实地反应出体内病毒的序列情况。
全长rt基因为1680bp,包括聚合酶区、连接区和RNase H区,由于聚合酶区是药物的最主要靶点,所以过去研究的重点就在于 rt基因的前 600bp,同时也建立起了单拷贝 PCR扩增方法[8]。但是,近年来又发现rt基因的其他区域发生突变也会改变病毒对药物的敏感性[9],然而,目前尚没有建立起全长rt基因的单拷贝PCR扩增方法,阻碍了病毒体内遗传与变异的研究,本文建立的方法具有重大的应用价值。
建立RT-SHIV全长rt基因单拷贝PCR扩增方法的最终目的是应用于病毒遗传与变异的研究,一个方法建立需要大量的实验实践来评估和验证,而本文扩增的RT-SHIV感染猴血浆样本较少,只对该方法的初步应用进行了探讨,尚未对猴体内病毒遗传变异情况进行深入探讨,接下来的工作就是大量扩增RT-SHIV感染猴血浆样本,进一步验证所建立的单拷贝方法,同时深入探讨猴体内病毒遗传与变异情况。
该方法的建立有助于研究各类RT-SHIV模型中全长rt基因的序列信息和病毒的遗传变异情况,以及在抗病毒治疗压力下耐药突变的产生和进化机制,为抗病毒药物和疫苗的筛选和研发提供坚实的基础。
[1]Klaus U,Christiane SH,Disa B,et al.Animal model for the therapy of acquired immunodeficiency syndrome with reverse transcriptase inhibitors[J].Proc.Natl.Acad.Sci,1995,92:8210-8214.
[2]Balzarini J,De CE,Uberla K.SIV/HIV-1 hybrid virus expressing the reverse transcriptase gene of HIV-1 remains sensitive to HIV-1-specific reverse transcriptase inhibitors after passage in rhesus macaques[J].J Acquir Immune Defic Syndr Hum Retrovirol,1997,15(1):1-4.
[3]Wei S,Mary K,Frank M,et al.RT-SHIV subpopulation dynamics in infected macaques during anti-HIV therapy[J].Retrovirology,2009,6:101.
[4]Sarah P,Mary K,Frank M,et al.Multiple,linked human immunodeficiency virus type 1 drug resistance mutations in treatment-experienced patients are missed by standard genotype analysis[J].J Clin Microbiol,2005,43(1):406-413.
[5]North TW,Van Rompay KKA,Higgins J,et al.Suppression of virus load by highly active antiretroviral therapy in rhesus macaques infected with a recombinant simian immunodeficiency virus containing reverse transcriptase from human immunodeficiency virus type 1[J].J.Virol,2005,79(12):7349-7354.
[6]许琰,冯育芳,王卫,等.TaqMan探针实时荧光定量 RTPCR法检测SIV/SHIV病毒RNA拷贝数方法的建立[J].中国比较医学杂志,2007,17(02):92-95.
[7]Salazar-Gonzalez JF,Bailes E,Farm KT,et al.Deciphering human immunodeficiency virus type 1transmission and early envelope diversification by single-genome amplification and sequencing[J].J.Virol,2008,82(8):3952-3970.
[8]Ambrose Z,Palmer S,Boltz VF,et al.Suppression of viremia and evolution of human immunodeficiency virus type 1drug resistance in a macaque model for antiretroviral therapy[J].J Virol,2007,81(22):12145-12155.
[9]Gupta S,Fransen S,Paxinos EE,et al.Combinations of mutations in the connection domain of human immunodeficiency virus type 1 reverse transcriptase:assessing the impact on nucleoside and nonnucleoside reverse transcriptase inhibitor resistance[J].Antimicr Agents Chemother,2010,54(5):1973-1980.
