茶陵野生稻及其导入后代间的遗传差异RAPD分析
2012-01-29蒋斌元王胜利龚建华洪亚辉
蒋斌元,张 齐,康 敏,王胜利,龚建华,洪亚辉
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.株洲市农业科学研究所,湖南 株洲 412000)
水稻是一种重要的粮食作物,是人类主要的粮食来源,提高水稻产量以及防治病虫害一直是科研工作者们努力的方向[1]。普通野生稻是栽培稻的近缘祖先,保有许多宝贵的基因资源,是水稻突破性育种与生产的重要基因源[2-4]。在茶陵已发掘的新石器时代大塘文化遗址中发现了已碳化的谷物堆,由此可见,茶陵地区谷物种植历史悠久,茶陵野生稻具有重要的研究价值。湖南农业大学细胞生物学研究室与株洲农业科学研究所合作,将茶陵野生稻的基因组DNA采用花粉管通道法[5]导入受体栽培稻R9810、RCP08-29,其中R9810这一系中获得的后代已培育到第4代,表型各异,表现出明显的耐寒能力并且具有对株洲当地稻瘟病菌小种的抗性。笔者以茶陵野生稻及其导入后代为研究对象,辅以受体材料为对照,采用RAPD方法[6-9]研究总基因组导入后在遗传上所造成的影响,旨在配合大田表型筛选,为后续有目的性地筛选试验材料提供科学依据。
1 材料与方法
1.1 材料
供试材料为茶陵野生稻(W)、超级稻R9810(C)、 导入后代D4(1:ys09203;2:ys09004;3:ys090015;4:ys090026;5:ys090027c)
1.2 方法
1.2.1 总DNA的提取 将供试材料洗净剪碎分别置于研钵中,加入液氮研磨破碎细胞,使用CTAB法[10]提取DNA,电泳检测。
1.2.2 RAPD扩增 经过多次筛选确定使用引物(表1)与25 μL反应体系,PCR反应程序为94℃预变性 5 min;94℃变性 40 s,36℃复性 40 s,72℃延伸1 min,共计40个循环;最后72℃延伸7 min。引物浓度为10 μM。随机引物由华大基因合成,利用随机引物对各样品基因组DNA进行扩增,凝胶电泳检测扩增产物。
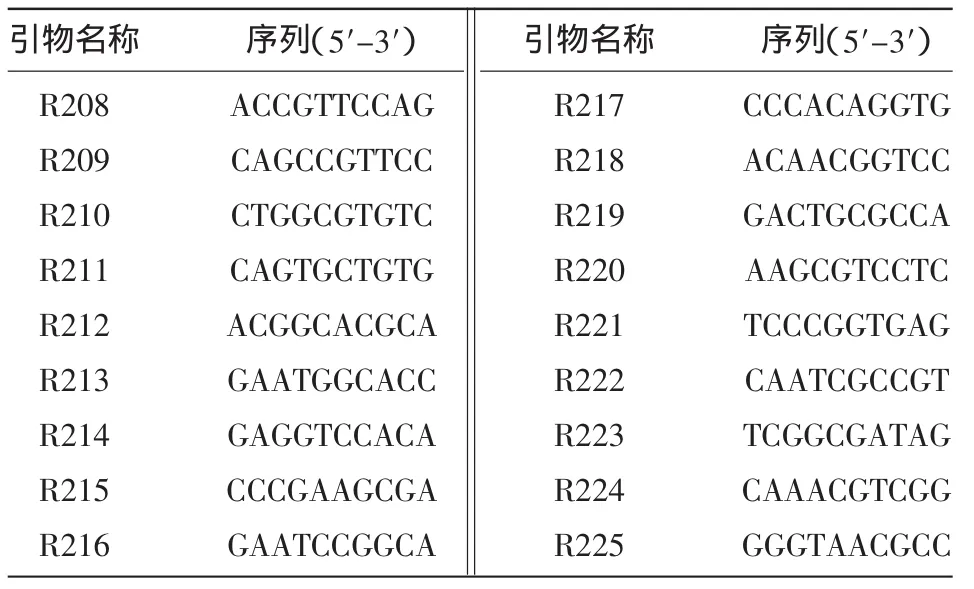
表1 RAPD随机引物序列
1.2.3 数据分析 对凝胶电泳图谱进行统计,使用统计类软件NTSYSpc 2.1,基于非加权组平均法(UPGMA)对所得结果进行聚类分析[11-13]。
2 结果与分析
2.1 水稻基因组DNA的提取
提取的水稻基因组DNA经1.0%琼脂糖凝胶电泳检测后,显示条带清晰(图1)。这说明所提取的水稻基因组DNA大分子较为完整,杂质和DNA的降解均比较少,符合RAPD所需要的PCR模板要求。经蛋白核酸测定仪测量,所提取的基因组DNA的A260/A280值为2.10,基本符合DNA的纯度要求。
2.2 RAPD分析
用筛选出的18个RAPD随机引物对各样品基因组DNA进行扩增,图2为部分RAPD电泳图。
对显示的凝胶电泳图谱进行统计,使用1和0表示带的有和无(表2)。使用统计类软件NTSYSpc 2.1基于UPGMA算法对所得结果进行聚类分析,做出聚类图(图3)。基于该聚类图所显示的遗传关系,发现茶陵野生稻总DNA经花粉管通道法导入栽培稻后,其导入后代在遗传关系上表现各异,有仍然趋向于受体R9810的,如5号导入后代,也有随机插入DNA片段后在遗传距离上发生了改变的,如 1、2、3、4 号导入后代。



表2 随机引物RAPD图谱条带读取结果

3 讨 论
采用花粉管通道法将茶陵野生稻的总基因组DNA导入栽培稻后,在表型上获得了许多变异,笔者使用RAPD法在分子水平上对基因组导入所引起的变异进行了分析说明。研究结果表明,茶陵野生稻在进化上处于比较原始的位置,受体R9810与5号导入后代有着较近的亲缘关系,5号材料在遗传上并未出现很大的改变,而1、2、3、4号导入后代在遗传上则受到了较大的改变,这些变化可能是由于DNA片段的随机插入而引起,亦或者是仅限于所选引物进行扩增才会显示的结果。总而言之,RAPD法能在某种程度上显示出采用花粉管通道法将供体基因组DNA导入受体后所产生的后代在基因组水平的变化,能为后续选育试验提供一定的参考。与表现型相结合,通过对花粉管通道法导入总DNA后获得的大量后代进行归类研究,能提高分类的准确性。
[1]康美花,曹丰生,陈红萍,等.水稻稻瘟病抗性基因研究进展及其在育种上的应用[J].江西农业学报,2010,22(2):95-98.
[2]邓启云,袁隆平,梁凤山,等.野生稻高产基因及其分子标记辅助育种研究[J].杂交水稻,2004,19(1):6-10.
[3]卢宝荣,葛 颂,桑 涛,等.稻属分类的现状及存在问题[J].植物分类学报,2001,39(4):373-388.
[4]吕学莲,白海波,蔡正云,等.普通野生稻(Oryza rufipogon)DNA导入栽培稻后代的发芽耐盐性研究 [J].安徽农业科学,2010,38(36):20556-20558.
[5]龚蓁蓁,沈慰芬,周光宇,等.受粉后外源DNA导入植株技术-通过花粉管通道进入胚囊 [J].中国科学(B辑),1988,(6):611-614.
[6]梁美霞,李景富,许向阳.RAPD技术在蔬菜遗传育种上的应用[J].分子植物育种,2003,1(5-6):737-740.
[7]许 丽,李明莹,林 风.DNA分子标记及其在作物遗传育种中的应用[J].沈阳师范大学学报(自然科学版),2006,24(4):466-469.
[8]Mengoni A,Gori A,Bazzicalupo M.Use of RAPD and microsatellite(SSR)variation to assess genetic relationships among populations of tetraploid alfalfa[J].Medicago Sativa Plant Breeding,2000,119(4):311-317.
[9]Ying X.Detection of Purity of Thai Hom Mali Rice by RAPD[J].Agricultural Science&Technology,2011,12(11):1565-1568.
[10]Murray M G,Thompson W F.Rapid isolation of high molecular weight plant DNA [J].Nucleic Acids Res,1980,(8):4321-4325.
[11]薛庆中.DNA和蛋白质序列数据分析工具(第二版)[M].北京:科学出版社,2010.
[12]Nozaki T,Kumazaki A,Koba T,et al.Linkage analysis among loci for RAPDs,is ozymes and some agronomic traits in Brassica campestris L[J].Euphytica,1997,95:115-123.
[13]漆小泉,朱德蔚,沈 镝,等.大白菜和紫菜薹自交染色体组DNA 的 RAPD 分析[J].园艺学报,1995,22(3):256-262.
