固相微萃取-气相色谱-质谱法测定大头金蝇样本内氯氮平
2012-01-29李学博莫耀南周海梅马锦琦万立华王清山
李学博,莫耀南,周海梅,李 朴,马锦琦,万立华,王清山
(1.重庆医科大学法医学与生物医学信息研究室,重庆 400016;2.河南科技大学法医学院,河南 洛阳 471003;3.重庆市公安局物证鉴定中心,重庆 401147)
在法医学检案过程中常遇到严重腐败甚至白骨化的尸体,难以获得合适的用于毒物分析的体液和组织样本,此时嗜尸性昆虫的幼虫和蛹可以作为 可 靠 的 检材[1-2]。1980 年 Beyer等[3]首次利用孳生在骸骨上的蛆虫样本成功检测出了苯巴比妥药物,随后的研究表明多种药(毒)物可以通过昆虫样本进行检测,Kharbouche等[4]利用液相色谱-质谱联用(LC/MS)技术从丝光绿蝇体内成功测定了可待因,Wood等[5]利用液相色谱-串联质谱联用(LC-MS/MS)技术从红头丽蝇幼虫体内成功检测了10种苯二氮卓类药物,Gosselin等[6]利用高效液相色谱-串联质谱(UPLC-MS/MS)方法成功检测了丝光绿蝇幼虫体内的美沙酮,Roeterdink等[7]利用电感耦合等离子体质谱(ICP-MS)技术分析了丽蝇幼虫体内射击残留物成分,此外,也有利用气相色谱-质谱(GC/MS)技术成功定量检测蝇蛆体内苯丙胺类毒品及马拉硫磷的报道[8-10],现代化检测仪器设备的使用使定量测定单个幼虫及蛹样本的药(毒)物水平成为可能[5-6],甚至羽化后的空蛹壳和排泄物也可以检测到部分毒物成分[11-12],即使在软组织中不能检测到的毒物,仍可以通过蝇类幼虫测得[13]。更为有利的是,以昆虫为检材进行药(毒)物分析时,分析仪器还不会受到尸体分解产物,如尸碱的影响[2,14-15]。
氯氮平(clozapine,CLP)是临床最常用的抗精神病药物之一,也是患者意外过量服用中毒死亡和自杀案件中常见的药物。本研究通过建立固相微萃取气相色谱-质谱联用(SPME-GCMS)的检测方法,对取食含有不同浓度CLP培养基质上的大头金蝇幼虫和蛹进行定量检测,旨在为同类中毒死亡案件的分析检验提供相关借鉴。
1 实验部分
1.1 仪器与试剂
6890-5973N气相色谱-质谱联用仪:美国Agilent科技有限公司产品;NIST98色谱工作站;固相微萃取仪(SPME)及100μm聚二甲基硅氧烷(polydimethylsiloxane,PDMS)萃取头:美国Supelco公司产品。
氯氮平(clozapine,CLP)标准品:中国药品生物制品检定中心提供;洛沙平(loxapine)标准品:内标,中国药品生物制品检定中心提供;氯化钠、氢氧化钠、甲醇:均为分析纯。
1.2 仪器条件及溶液配制
1.2.1 色谱-质谱条件 色谱柱:HP-5MS(30 m×0.25mm×0.25μm)弹性石英毛细管柱;柱流量1.0mL/min;柱温设定:初温160℃,以40℃/min升温至260℃,再以5℃/min升温至280℃;进样口温度:260℃;载气:高纯氦气;进样方式:不分流进样;GC/MS接口温度:280℃;EI源(70eV),电子倍增器电压1 106V。
1.2.2 溶液配制 精密称取CLP标准品5 mg,添加50mL甲醇溶解稀释,得100mg/L CLP标准品储备液,同法配制100mg/L洛沙平储备液,置于4℃冰箱避光保存。精密量取CLP标准品储备液,加甲醇分别配置成50、100、500、1 000、5 000、10 000、50 000μg/L浓度的标准工作液。同法配制1 500μg/L浓度的内标工作液。
1.3 大头金蝇培养
供试大头金蝇为野外捕获,经鉴定种属后在实验室内连续培养获得,在蝇笼内以红糖、奶粉饲养,产卵高峰期以新鲜猪肝诱其产卵。取肝组织4份,400g/份,分别添加2mg、4mg及8mg的CLP水溶液后搅碎混匀并盛装在500mL烧杯内,分别编号C1、C2、C3,同时设空白对照组C0组。将卵块取出后按照400粒/份分别接种至以上含有不同浓度CLP的培养基上,将烧杯放至30cm×40cm×30cm的培养盒内,培养盒底层铺有2cm消毒细沙,上口覆盖固定细孔纱网。置于实验温度(25±0.2)℃,相对湿度(75±5)%,光周期L∶D=14∶10下培养。参照文献[4]方法,分别在大头金蝇卵孵化后的52、76、100、124h及离食前期和后期取幼虫各50只,待幼虫化蛹后,取蛹样本50只,将以上样本置于-20℃冰箱冻死,保存备检。
1.4 样本处理与测定
取不同时期的大头金蝇幼虫及蛹的样本,每次分析随机取10只,称重后按照参考文献中的方法[4,16],先后用去离子水反复冲洗,去除体表粘附的食物组织,用滤纸吸干体表残留液体,在样本中加入200μL内标工作液,添加甲醇4g匀浆,置于60℃水浴中加热平衡10min,离心,取上清液2mL至4mL样品瓶,加入1.0g NaCl饱和溶液,添加1mol/L NaOH调节pH为9,振荡20s。再将样品瓶置于40℃水浴中加热平衡10min,然后将萃取头浸入样品萃取30min。取出萃取头置于双蒸水中振洗20s,然后置于50%甲醇中振洗10s,取出后挥干并插入GC/MS进样口解析90s。
1.5 统计分析
2 结果与讨论
2.1 色谱质谱图
取含有内标的CLP标准工作液,以扫描方式进样及选择离子(SIM)方式检测,其总子流图示于图1。待CLP与内标完全分离,二者的保留时间分别为6.97min及10.01min,CLP选择离子为:m/z 243、256、192、245,洛沙平选择离子为:m/z257、83、70、193,如图2、图3所示,未见其他干扰成分。
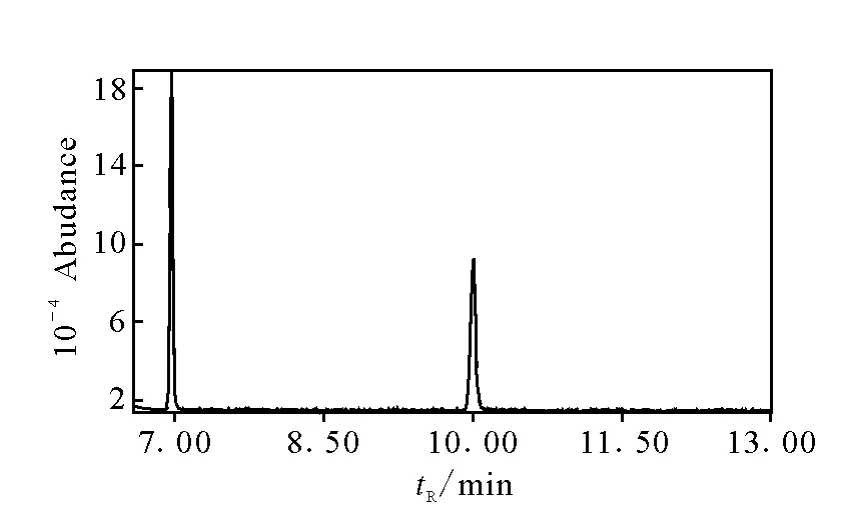
图1 GC/MS方式检测样本内的总离子色谱图Fig.1 TIC of samples analyzed by GC/MS
2.2 检测限与标准曲线
取孵化后100h的C0组大头金蝇幼虫10只/份,按照预处理方法洗净后分别添加一定量的CLP,制作分别含有 CLP 5、10、50、100、500、1 000、5 000μg/L的样品(均含内标500μg/L),以选择离子方式进样,测定CLP检测限并计算信噪比,根据峰面积比对浓度比(CLP对内标)作线性回归。结果显示CLP的检测限为0.1 μg/L(信噪比>3),在5~5 000ng/mg范围内线性良好,回归方程为:y=0.039 9x-0.607 3,r=0.999 8(n=7),示于图4。

图2 氯氮平的总离子质谱图Fig.2 Toltal ion mass-spectrograms of CLP

图3 洛沙平的总离子质谱图Fig.3 Toltal ion mass-spectrograms of loxapine

图4 氯氮平的标准工作曲线Fig.4 Standard curve of CLP
2.3 回收率与精密度
取孵化后100h的C0组大头金蝇幼虫10只/份,按照预处理方法洗净后分别添加一定量的CLP,分别制作含有CLP 100、500、1 000μg/L样品(均含内标500μg/L),按1.4样品预处理步骤操作后分析测定,1日内重复分析测定5次,连续测定3日,按照上述回归方程计算各浓度的相对回收率均值,并得日内及日间精密度均值,列于表1。
2.4 大头金蝇样品内CLP水平测定
按上述样品处理方法及检测条件,对生长在含有不同浓度CLP培养基质上的大头金蝇不同时期的幼虫和蛹进行分析测定,成功定量检测出了样品中的CLP。实验用于检测的样本经去离子水和甲醇反复冲洗后,可去除体表食物成分中CLP对检测的影响[17],使结果更加准确。
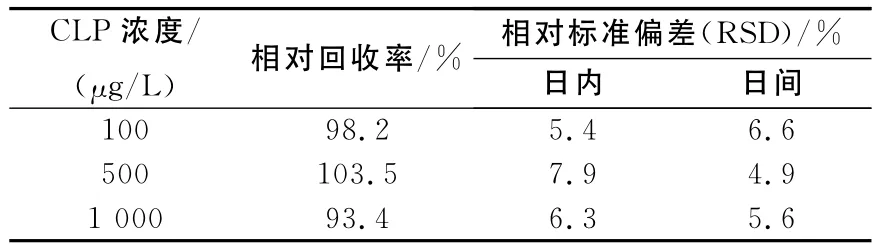
表1 SPME-GC/MS法在大头金蝇幼虫样本内的准确度及精密度Table 1 Accuracy and precision of clozapine from larvae of Chrysomya megacephala by SPME-GC/MS
检测结果列于表2。由表2可看出,在取食期、离食期的幼虫和蛹内均检测到了CLP,其中76h、100h及124h的取食期幼虫各实验组样本间CLP水平差异显著(P<0.05)。大头金蝇样本内CLP水平与取食时间有关,在幼虫发育的早期CLP水平较低,随着取食时间的延长而增长,与上一次检测结果相比,取食76h和124 h的幼虫变化显著(P<0.01),这可能与CLP在幼虫体内不断蓄积有关。在离食期CLP水平又大大降低(P<0.01),这是由于此时CLP的排泄大于摄入所致,蛹期仅检测到极微量的CLP,与相关研究报道一致[12,18]。通常情况下,由于受到代谢的影响,组织中的药物浓度明显高于昆虫样本[19]。
表2 不同时期的大头金蝇幼虫及蛹样本CLP的浓度(μg/g,±s)Table 2 Concentration of CLP in samples of larvae and pupae in different time(μg/g,±s)

表2 不同时期的大头金蝇幼虫及蛹样本CLP的浓度(μg/g,±s)Table 2 Concentration of CLP in samples of larvae and pupae in different time(μg/g,±s)
分组 幼虫52h 幼虫76h 幼虫100h 幼虫124h 离食前期幼虫 离食后期幼虫 蛹C1 1.9±0.33 2.38±0.81 3.23±1.22 4.27±1.23 2.02±0.67 1.24±0.37 0.09±0.02 C2 2.33±0.38 4.12±1.56 6.22±1.55 8.25±3.58 3.84±1.26 1.65±0.43 0.15±0.06 C3 3.28±0.65 6.56±2.34 9.61±2.67 12.33±4.224.55±1.85 1.88±0.76 0.18±0.05
3 结 论
SPME技术是一种新型的样品前处理技术,它利用待测物对活性固体表面的吸附力而达到分离富集的目的,因萃取不破坏样品本身的性质,而又具有简单、快速、环保、灵敏度和精密度高的优点,SPME-GC/MS联用的方法已被广泛应用于包括体液、组织等多种生物样品中化学成分的检测。本研究应用SPME-GC/MS联用的方法,准确定性、定量检测大头金蝇不同时期的幼虫及蛹样本的CLP浓度,检出限为0.1μg/L,在5~5 000μg/L范围内线性良好,不同浓度的回收率在93%~104%间,日内及日间RSD均小于8%。
该方法结果可靠,简便快捷,精密度好,可用于此类中毒案件的法医学分析测定,昆虫样本可作为替代或补充样本,与腐败组织及体液相比,昆虫体内的药(毒)物保存时间更稳定持久[20-21],在难以获得合适的组织体液样本及尸体严重腐败,影响仪器检测效果的案件中有重要价值。另一方面,对疑为谋杀后伪装CLP中毒,有蝇蛆孳生的案件,可检测尸体特殊部位昆虫样本获得间接证据,为案件分析提供参考依据。本研究显示,大头金蝇样本内CLP水平与食物内的含量具有相关性,不同阶段大头金蝇样本CLP含量随时间的变化而改变,取食阶段的幼虫体内含量可不断蓄积到较高水平,到达离食期后由于幼虫停止取食加上正常的排泄导致体内CLP水平急剧下降。部分研究[4,12,22]也表明,药(毒)物在昆虫体内存在明显的蓄积及分解代谢活动,可引起体内药物水平及成分的明显改变,因此今后的研究还要加强代谢物的检测,以获得更为精确的结果。
[1]NOLTE K B,PINDER R D,LORD W.Insect larvae used to detect cocaine poisoning in a decomposed body[J].J Forensic Sci,1992,37(4):1 179-1 185.
[2]KINTZ P,GODELAR B,TRACQUI A,et al.Fly larvae:a new toxicological method of investigation in forensic medicine[J].J Forensic Sci,1990,35(1):204-207.
[3]BEYER J,ENOS W,STAJIC M.Drug identification through analysis of maggots[J].J Forensic Sci,1980,25(2):411-412.
[4]KHARBOUCHE H,AUGSBURGER M,CHERIX D,et al.Codeine accumulation and elimination in larvae,pupae,and imago of the blowfly Lucilia sericata and effects on its development[J].Int J Legal Med,2008,122(3):205-211.
[5]WOOD M,LALOUP M,PIEN K,et al.Development of a rapid and sensitive method for the quantitation of benzodiazepines in Calliphora vicina larvae and puparia by LC-MS/MS[J].J Anal Toxicol,2003,27(7):505-512.
[6]GOSSELIN M,DI FAZIO V,WILLE S M,et al.Methadone determination in puparia and its effect on the development of Lucilia sericata (Diptera,Calliphoridae)[J].Forensic Sci Int,2011,209(11 213):154-159.
[7]ROETERDINK E M,DADOUR IR,WATLING R J.Extraction of gunshot residues from the larvae of the forensically important blowfly Calliphora dubia(Macquart)(Diptera:Calliphoridae)[J].Int J Legal Med,2004,118(2):63-70.
[8]GOSSELIN M,WILLE SMR,FERNANDEZ MMR,et al.Entomotoxicology,experimental set-up and interpretation for forensic toxicologists[J].Forensic Sci Int,2011,208(11 213):1-9.
[9]GOFF M L,MILLER M L,PAULSON J D,et al.Effects of 3,4-methylenedioxymethamphetamine in decomposing tissues on the development of Parasarcophaga ruficomis(Diptera:Sarcophagidae)and detection of the drug in postmortem blood,liver tissue,larvae,and puparia[J].J Forensic Sci,1997,42(2):276-280.
[10]LIU X,SHI Y,WANG H,et al.Determination of Malathion levels and its effect on the development of Chrysomya megacephala(Fabricius)in South China[J].Forensic Sci Int,2009,192(1):14-18.
[11]MILLER M,LORD W,LEE GOFF M,et al.I-solation of amitriptyline and nortriptyline from fly puparia(Phoridae)and beetle exuviae(Dermestidae)associated with mummified human remains[J].J Forensic Sci,1994,39:1 305-1 305.
[12]PIEN K,LALOUP M,PIPELEERS-MARICHAL M,et al.Toxicological data and growth characteristics of single post-feeding larvae and puparia of Calliphora vicina(Diptera:Calliphoridae)obtained from a controlled nordiazepam study[J].Int J Legal Med,2004,118(4):190-193.
[13]LEVINE B,GOLLE M,SMIALEK J E.An un-usual drug death involving maggots[J].Am J Forensic Med Pathol,2000,21(1):59-61.
[14]DRUMMER O H,GEROSTAMOULOS J.Postmortem drug analysis:analytical and toxicological aspects[J].Ther Drug Monit,2002,24(2):199-209.
[15]NOLTE K B,PINDER R D,LORD W D.Insect larvae used to detect cocaine poisoning in a decomposed body[J].J Forensic Sci,1992,37(4):1 179-1 185.
[16]BOUREL B,TOURNEL G,HEDOUIN V,et al.Morphine extraction in necrophagous insects remains for determining ante-mortem opiate intoxication[J].Forensic Sci Int,2001,120(1-2):127-131.
[17]SADLER D,FUKE C.Drug accumulation and elimination in Calliphora vicina larvae[J].Forensic Sci Int,1995,71(3):191-197.
[18]CARVALHO LML,LINHARES A X,TRIGO J R.Determination of drug levels and the effect of diazepam on the growth of necrophagous flies of forensic importance in southeastern Brazil[J].Forensic Sci Int,2001,120(1/2):140-144.
[19]CAMPOBASSO C P,GHERARDI M,CALIGARA M,et al.Drug analysis in blowfly larvae and in human tissues:a comparative study[J].Int J Legal Med,2004,118(4):210-214.
[20]SKOPP G,POTSCH L,KLINGMANN A,et al.Stability of morphine, morphine-3-glucuronide,and morphine-6-glucuronide in fresh blood and plasma and postmortem blood samples[J].J Anal Toxicol,2001,25(1):2-7.
[21]SCHLOEGL H,DRESEN S,SPACZYNSKI K,et al.Stability of ethyl glucuronide in urine,post-mortem tissue and blood samples[J].Int J Legal Med,2006,120(2):83-88.
[22]PARRY S,LINTON S M,FRANCIS P S,et al.Accumulation and excretion of morphine by Calliphora stygia,an Australian blow fly species of forensic importance[J].J Insect Physiol,2011,57(1):62-73.
