硝基甲烷与氨基及羟基化合物间的相互作用
2012-01-28林小雄王明良赵凤起刘宇洪田德余贵大勇刘剑洪
林小雄,王明良,赵凤起,刘宇洪,田德余,贵大勇,刘剑洪
(1.深圳大学化学与化工学院,广东 深圳518060)2.西安近代化学研究所,陕西 西安710065)
引 言
高能推进剂是由化学性质不稳定的硝化甘油加入助溶剂、增塑剂、催化剂和安定剂等组分构成[1]。推进剂在贮存过程中会发生一系列的物理和化学变化,尤其含有化学性质不稳定的硝化甘油的推进剂配方,常会出现汗析、晶析和热分解等现象。范晓薇[2]等对硝化甘油与高分子黏合剂混合体系相互作用进行了理论研究,但缺乏实验方面的研究。
运用量子化学的方法可以准确地计算分子间的相互作用能。通过计算硝基与氨基、羟基之间的相互作用能,可从理论上发现与硝基(硝酸酯基)化合物结合能力强的氨基、羟基类稳定剂。该稳定剂通过氢键、范德华力能较好地与硝基(硝酸酯基)化合物结合在一起,从而抑制或阻止硝基(硝酸酯基)化合物从材料内部析出。
耐热分解温度是评价化合物热稳定性的重要指标之一。因此,用热分析方法可检测硝基(硝酸脂基)化合物与苯胺类化合物的热稳定性。硝基甲烷(CH3NO2)是最简单的有机硝基化合物[3]。本实验以硝基甲烷代替硝化甘油,研究了氨基或羟基化合物对硝基甲烷的稳定机理,从而有助于发现提高推进剂热稳定性的化合物,为设计新颖、高效的稳定剂奠定重要基础。
1 实 验
1.1 计算方法
用GaussView 4.1 软件构造硝基甲烷与乙二胺、乙二醇、1,1-二氨基丙烷和1,1,3-丙三醇的初始几何构型。用密度泛函理论(DFT)在B3LYP/6-311++G**水平下对其构型全优化[4-5]。然后在优化构型的基础上,对各优化构型进行振动频率分析,均无虚频,表明优化的构型是稳定构型,它们都对应各自势能面上的极小点。最后用Boys等[6]提出的均衡校正法(CP)进行基组叠加误差(BSSE)校正。以上计算均采用Gaussian03[7]程序完成。
1.2 材料及仪器
乙二胺,AR,Sigma公司;硝基甲烷、1,1-二氨基丙烷、1,2-乙二醇、1,2-丙二醇、1,1,3-丙三醇,AR,阿拉丁试剂(上海)有限公司;邻苯二胺,CR,百灵威试剂公司;2-硝基二苯胺,CR,百灵威试剂公司。
STA409PC同步热分析仪,德国耐驰仪器有限公司,工作气体:氧气 50NmL/min;氮气100NmL/min。
1.3 实验步骤
(1)在盛有硝基甲烷的烧杯中加入质量分数约10%(过量)的各种含氨基或羟基化合物,若发生难溶、结晶或挥发等现象,说明含氨基或羟基化合物分子无法均匀分布于硝基甲烷液体中,1,1-二氨基乙烷易挥发、硝基甲烷难溶于乙二胺,热重分析实验采用其他氨基化合物(2-硝基二苯胺、邻苯二胺)代替。
(2)计算硝基甲烷中所添加的各含氨基或羟基化合物比例:按要求加入硝基甲烷的含氨基或羟基化合物质量分数控制范围约0.50%~5.00%。
(3)对添加各种含氨基或羟基化合物的硝基甲烷进行热重分析。每次检验样品量控制在20~30mg,每个样品重复检测分析2次以上。
(4)对数据进行收集和处理。
1.4 误差控制
(1)使用统一的空白基线(30~300℃空气基线),以限制浮力和对流引起热重曲线的基线漂移,减少由热天平内外温差造成的对流对称量精确度的影响。
(2)升温速率设为10℃/min,抑制滞后现象。
(3)气氛控制:氧气(O2)50NmL/min;氮气(N2):100NmL/min,符合实际应用温度。
(4)使用同一规格的坩埚。
(5)每次检验样品量控制在20~30mg内,防止质量差距过大引起较大的温度偏差。
(6)某一比例下的样品重复检测分析2次或以上,保证数据的稳定性和可靠性。
2 结果与讨论
2.1 几何构型
图1为硝基甲烷与乙二胺(Ⅰ)、乙二醇(Ⅱ)、1,1-二氨基丙烷(Ⅲ)和1,1,3-丙三醇(Ⅳ)的相互作用。
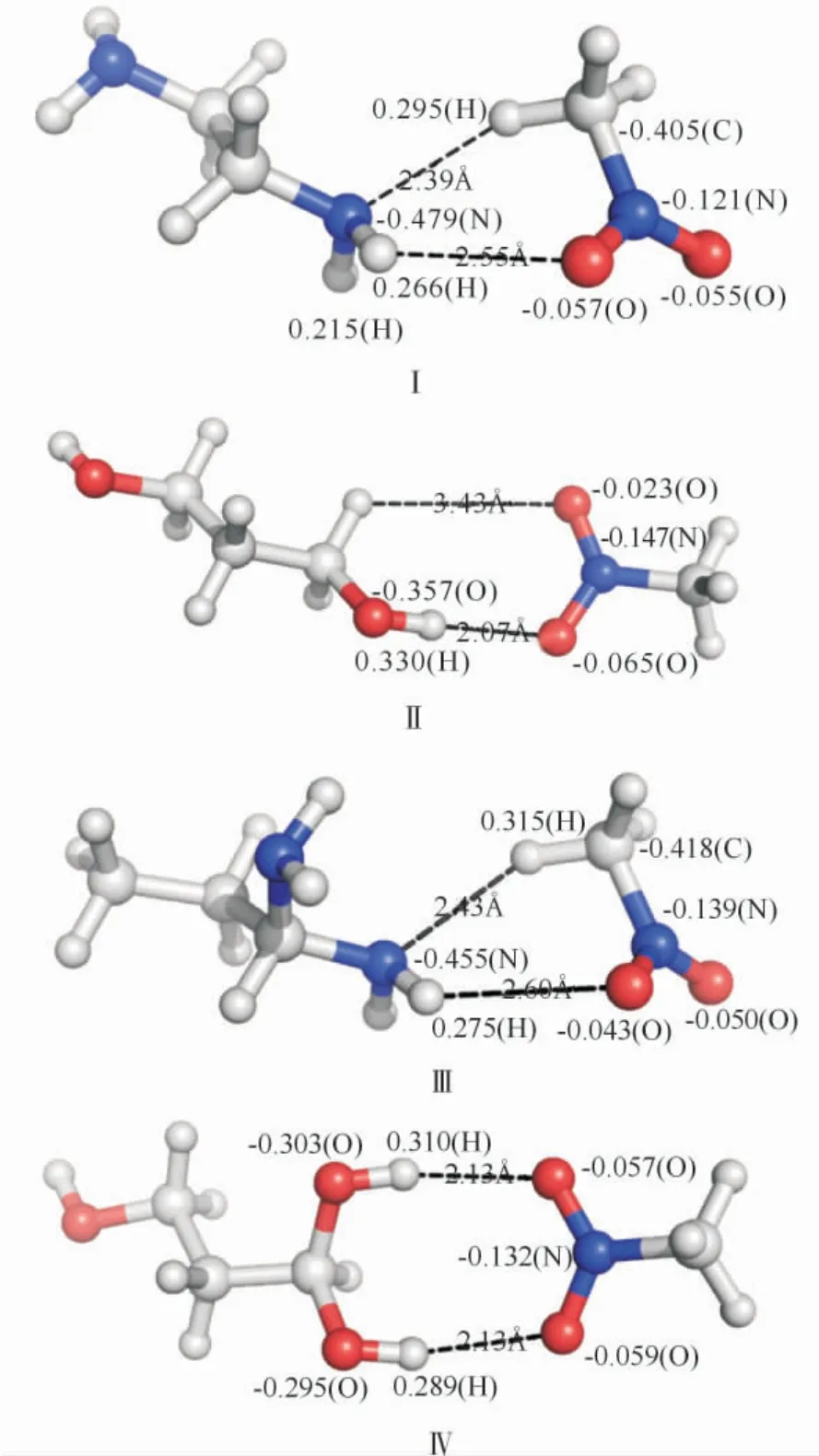
图1 硝基甲烷与氨基、羟基化合物间的相互作用Fig.1 Interaction between nitromethane with amino,hydroxyl compounds
Ⅳ中硝基甲烷的硝基两个氧原子与1,1,3-丙三醇连在同一个碳原子上的两个羟基的氢原子形成两个夹角为165°的强氢键,键长均为2.13Å。与其他3个化合物相比,1,1,3-丙三醇(Ⅳ)与硝基甲烷相互作用最强。硝基甲烷和乙二胺间的相互作用除了图中所示外,还有其他形式的相互作用形式,其他物质亦然。
2.2 硝基甲烷与羟基、氨基间的相互作用能
表1 列出在B3LYP/6-311++G**水平下求得的硝基甲烷与乙二胺、乙二醇、1,1-二氨基丙烷和1,1,3-丙三醇的相互作用能。由表1可知,未校正的相互作用能的大小顺序是1,1,3-丙三醇>乙二胺>乙二醇>1,1-二氨基丙烷,经零点能校正后的相互作用能的大小顺序为1,1,3-丙三醇>乙二胺>乙二醇>1,1-二氨基丙烷,经零点能效应和基组重叠误差校正的相互作用能的大小排序未变,但计算得出的相互作用能有所降低。

表1 硝基甲烷与羟基、氨基间相互作用能的计算值Table 1 Calculated value of interaction energy between nitromethane and hydroxyl and amino compounds
硝基甲烷与氨基、羟基化合物作用的强弱与氢键键长和原子上电荷的分布相一致,表明氢键在硝基甲烷与羟基、氨基化合物的相互作用中起着重要作用。经零点能效应和基组重叠误差校正后,硝基甲烷与1,1,3-丙三醇的相互作用最强,两个分子之间形成两个较强的氢键,最大相互作用能为-19.90kJ/mol。硝基甲烷与1,1-二氨基丙烷虽然也形成了两个氢键,但这两个氢键键长较长,相互作用能弱,仅为-10.06kJ/mol,约为硝基甲烷与1,1,3-丙三醇之间相互作用能的1/2。虽然硝基甲烷与乙二醇之间形成一个氢键,但由于这个氢键键长2.07Å,相互作用能-10.74kJ/mol,比硝基甲烷与1,1-二氨基丙烷的相互作用能大。硝基甲烷与乙二胺的构型比较特殊,氨基上的氢原子和氮原子分别与硝基甲烷的硝基和碳原子上的氢原子形成两对弱相互作用,其相互作用能为-11.97kJ/mol,与硝基和一个羟基的相互作用能近似。
2.3 硝基甲烷与羟基、氨基间的相互作用
表2 为在B3LYP/6-311++G**水平下计算得到的硝基甲烷与氨基、羟基化合物分子间距离和化合物与硝基形成的氢键数目。分子间距离大小为1,1-二氨基丙烷>乙二胺>1,1,3-丙三醇>乙二醇,但由于乙二醇中只有一个羟基中的氢与硝基甲烷中的硝基氧原子发生比较强的作用,只有一个氢键作用,分子间距离最短的乙二醇相互作用能小于1,1,3-丙三醇。1,1,3-丙三醇中连在同一个碳原子的两个羟基中的氢与硝基中的两个氧发生了较强的相互作用,其分子间距离较小,相互作用能大。

表2 分子间距离和形成氢键的数目Table 2 Intermolecular distance and the number of formed hydrogen bonds
2.4 热重分析结果
图2为加入不同比例的氨基或羟基类化合物后硝基甲烷的完全失重温度曲线,纯硝基甲烷的热失重温度为103.3℃,添加微量1,1,3-丙三醇可显著提高硝基甲烷的热失重温度。实验发现,添加质量分数约4.2%的1,1,3-丙三醇后,硝基甲烷的热分解温度最高为137.3℃,比纯硝基甲烷的热分解温度(103.3℃)高34℃。硝基甲烷和1,1,3-丙三醇在最高热失重温度范围(133.3~137.3℃)下的质量分数约4.19%~4.31%,在此范围硝基甲烷完全失重的温度最高,添加微量1,1,3-丙三醇能与硝基甲烷形成氢键交联作用,可显著提高硝基甲烷的热稳定性。

图2 热分解温度-氨基、羟基化合物含量曲线ig.2 Curves of thermal decomposition temperatureamino,hydroxyl compound content
3 结 论
(1)在B3LYP/6-311++G**水 平 下,通 过Gaussian03计算得到硝基甲烷与乙二胺、乙二醇、1,1-二氨基丙烷和1,1,3-丙三醇的相互作用构型、电荷分布及氢键作用;硝基甲烷与1,1,3-丙三醇相互作用能最大,硝基甲烷中的硝基与1,1,3-丙三醇中的两个羟基形成两对强的氢键;虽然硝基甲烷中的硝基也与1,1-二氨基丙烷中的两个氨基形成两对氢键,但氢键作用较弱。理论计算表明,多羟基化合物对硝基化合物的热稳定性有提高作用。
(2)加入1,1,3-丙三醇后硝基甲烷完全失重的温度最高,即其相互作用能最大。添加质量分数约4.19%~4.31%的1,1,3-丙三醇,硝基甲烷完全失重温度由103.3℃提高到137.3℃,比硝基甲烷自身完全失重的温度(103.3℃)高34.0℃。计算结果与实验数据吻合。
[1]徐京城,赵纪军.液态硝基甲烷热分解行为及压力效应的第一性原理研究[J].物理学报,2009,58(6):4144-4148.
XU Jing-cheng,ZHAO Ji-jun.First-principles study of thermal decomposition of liquid nitromethane and its compressive effect[J].Acta Physica Sinica,2009,58(6):4144-4148.
[2]范晓薇,居学海,孙小巧,等.硝化甘油与高分子黏合剂混合体系相互作用的理论研究[J].火炸药学报,2009,32(3):46-49.
FAN Xiao-wei,JU Xue-hai,SUN Xiao-qiao,et al,Theoretical studies of interreaction of complex system nitroglycerin-polymer binder[J].Chinese Journal of Explosives and Propellants,2009,32(3):46-49.
[3]王文俊,张占权.21世纪初固体推进剂技术展望[J].推进技术,2000,21(6):1-4.
WANG Wen-jun,ZHANG Zhan-quan.Prospect for solid propellant technologies at the beginning of the 21st century[J].Journal of Propulsion Technology,2001,21(6):1-4.
[4]Kim K,Jordan K D.Comparison of density functional and MP2calculations on the water monomer and dimer[J].J Phys Chem,1994,98(40):10089-10094.
[5]Stephens P J,Devlin F J,Chabalowski C F et al.Ab initio calculation of vibrational absorption and circular dichroism spectra using density functional force fields[J].J Phys Chem,1994,98:11623-11627.
[6]Boys F S,Bernardi F.The calculation of small moleullar interactions by the differences of seperate total energies,some procedures with reduced errors[J].Molecular Physics,1970,19:553-566.
[7]Frisch M J,Trucks G W,Sehlegel H B,et a1.Gaussi-an 03[M].Pittsburgh:Gaussian Inc,2003.
