人Bcl-w基因的克隆和原核表达
2012-01-26戴晓莉王敏杜鸿
戴晓莉,王敏,杜鸿
Bcl-w属于Bcl-2家族,具有抑制细胞凋亡的功能,在肿瘤的发生发展过程中发挥了重要作用[1],正越来越多地受到肿瘤研究者们的关注。然而,迄今为止,Bcl-w检测的国产化试剂尚未见报道,开展Bcl-w国产化检测试剂盒的研究,无疑将有助于临床肿瘤检测、监控与治疗。本研究从人胃癌组织中扩增出Bcl-w基因,并通过工程菌成功地表达了Bcl-w蛋白,为推进Bcl-w检测的国产化,进一步探讨该重组蛋白在肿瘤治疗中的作用奠定了基础。
1 材料与方法
1.1 材料
Trizol、逆转录试剂盒、pGEM-T载体和质粒提取试剂盒购自Invitrogene公司,LATaq DNA聚合酶、PrimeSTARTMHS DNA聚合酶、dNTP、EcoRⅠ及XhoⅠ核酸内切酶、T4连接酶、核酸标准参照物DL2000和蛋白标准参照物均购自TaKaRa Biotec公司,X-gal和IPTG购自默克公司,琼脂糖购自上海意图公司,显色试剂购自Amershan Biosciences公司,抗His抗体、羊抗小鼠IgG-HRP购自北京中山生物技术有限公司。原核表达载体、大肠埃希菌DH5α和ROS均由本室保存。
1.2 方法
1.2.1 总RNA的提取 取人胃癌组织,将其剪碎研磨,加入1 ml Trizol,室温静置5 min后加入0.2 ml氯仿,充分震荡 15 s,室温静置 10 min;4℃12 000×g离心15 min,取上清加入0.5 ml异丙醇,室温静置10 min后4℃12 000×g离心10 min,弃上清,取沉淀加75%乙醇1 ml涡洗2遍,4℃7 500×g离心5 min,充分去除乙醇,干燥至RNA呈半透明状,最后加入20 μl DEPC水将其溶解。
1.2.2 Bcl-w基因的克隆 根据基因库中人Bcl-w基因编码区序列设计特异性引物,上游:5'-CAGAATTCATGGCGACCC-3',下游:5'-CGCCTCGAGCCACTTGCTAGC-3',分别带有酶切位点 EcoRⅠ和XhoⅠ,由上海生工生物工程技术有限公司合成。利用逆转录试剂盒将总RNA逆转录为cDNA,并以其为模板PCR,利用特异性引物扩增人Bcl-w基因。PCR 反应体系:25 μl 2 × GC 缓冲液 I、6 μl dNTP(2.5 mmol/L) 、2 μl cDNA、0.5 μl LA Taq 酶(5 U/μl) 、1μl P1 及P2 引物、14.5 μl H2O,总体积50 μl。反应条件:94℃预变性5 min,之后94℃变性30 s,62℃退火30 s,72℃延伸45 s,循环30次,最后72℃延伸10 min。获得的PCR产物用1%琼脂糖凝胶进行电泳,EB染色,观察结果。
1.2.3 Bcl-w序列的分析鉴定 胶回收Bcl-w基因的PCR产物,将其T-A克隆入pGEM-T载体,转化感受态细菌,接种于含有氨苄西林、X-gal和IPTG的LB平板,挑取白色菌落增菌,抽提质粒行PCR和酶切双重鉴定。挑取经鉴定得到的阳性标本送测序公司进行测序,将得到的核苷酸序列与基因库中的序列进行比对分析。
1.2.4 人Bcl-w蛋白的表达 将pGEM-T/Bcl-w质粒经EcoR I和Xho I双酶切和胶回收,获得Bcl-w基因片段,连接表达载体pet28a,然后转化大肠埃希菌ROS,取阳性克隆经酶切鉴定与预期结果相符,经测序比对正确后挑取单个菌落增菌过夜,第2天将此菌液以1∶100的比例接种于新鲜培养基中,培养至对数生长期时,加入 IPTG,终浓度分为 0.5,1,1.5,2 mmol/L,培养温度分为25℃、30℃和37℃,诱导时间分为4,6,8 h,在各种条件下分别收集细菌,加入1/10体积的冷PBS,冰浴超声破菌后4℃、12 000×g离心20 min,再分别取上清和沉淀进行蛋白电泳分析,以确定最佳诱导条件。
1.2.5 人Bcl-w蛋白的鉴定 免疫印迹法对所表达蛋白进行鉴定,将SDS-PAGE胶分离蛋白电转移至PVDF膜上,然后用5%的脱脂牛奶封闭1 h,TBS/T洗涤1次,4℃孵育抗His抗体(1∶1 000稀释)过夜,TBS/T洗涤3次,室温孵育羊抗小鼠IgGHRP抗体(1∶400稀释)1 h,TBS/T洗涤3次,最后加显色剂显色并观察结果。
2 结果
2.1 Bcl-w基因扩增结果
提取人胃癌组织总RNA,逆转录获得cDNA,以cDNA为模板,经PCR扩增得到的目的基因长约582 bp(图1)。

图1 Bcl-w基因扩增结果
2.2 重组质粒的筛选与鉴定
将PCR产物经T-A克隆与T载体相连,挑取阳性菌落增菌后抽提质粒,经单、双酶切鉴定,结果见图2。将克隆出的基因测序,获得的核酸序列与基因库中人 Bcl-w序列进行比较分析,同源性为100%。利用酶切位点,将此Bcl-w基因片段连接入原核表达载体pet28a,抽提质粒进行PCR及酶切双重鉴定,所得基因片段与预期相符,成功构建表达载体pet28a/Bcl-w。
2.3 Bcl-w融合蛋白的表达和鉴定
pet28a/Bcl-w阳性ROS菌株的最佳诱导条件为终浓度1 mmol/L IPTG、30℃诱导6 h。结果在相对分子质量22×103处获得大量表达(与预期相符),用抗His抗体进行免疫印迹鉴定,证实该蛋白条带确为Bcl-w融合蛋白(图3),并发现该重组蛋白主要以包涵体形式存在。
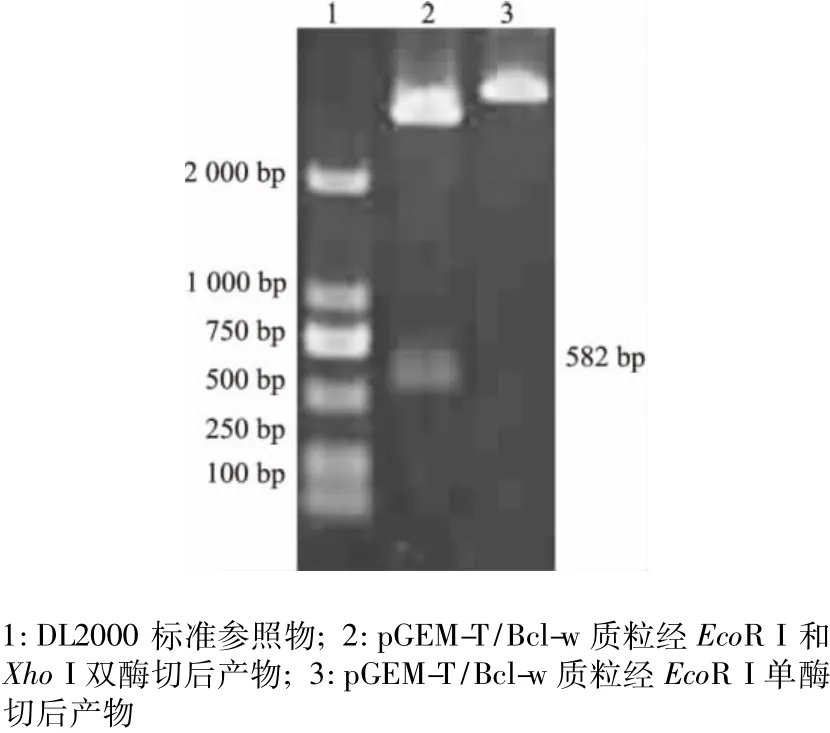
图2 Bcl-w重组质粒的鉴定

图3 人Bcl-w融合蛋白的表达及鉴定
3 讨论
1984年Tsujimoto等[1]首次于滤泡型B淋巴瘤中分离得到一种新型基因,命名为B细胞淋巴瘤/白血病基因2(B-cell lymphoma/leukemia-2,Bcl-2),该基因与细胞凋亡密切相关。目前已发现Bcl-2家族成员超过25个,被分为3类:抗凋亡蛋白,包括Bcl-2、Bcl-XL和Bcl-w等;促凋亡蛋白,包括Bax和Bak等;BH3-only蛋白,包括 Bid和 Bad等[2-3]。正常情况下,细胞内的这3类蛋白处于动态平衡中。
细胞凋亡属于细胞自主性死亡,受到多种基因的调控,在机体的生长发育过程中发挥着重要作用[4]。Bcl-2家族蛋白是调控细胞凋亡的关键性蛋白,越来越多的学者开始利用Bcl-2家族蛋白抑制物来控制肿瘤细胞的生长[5]。作为Bcl-2家族中的抗凋亡因子,Bcl-w通过与家族蛋白及其他相关蛋白之间的作用,发挥着复杂的抗凋亡功能。最新研究表明,在细胞凋亡的刺激下,Bcl-w晶体结构发生改变,形成低聚物二聚体,有助于线粒体外膜通透性的增加[6]。Bcl-w可通过构象改变来调节细胞凋亡,在肝细胞癌、胃癌、结直肠癌等多种肿瘤细胞中表达明显增强[7-9],在睾丸发育和精子发生过程中有调节生殖细胞周期的作用[10]。同时研究发现,Bcl-w的反义核酸诱导细胞凋亡、抑制消化系统肿瘤细胞生长的效果并不明显[11]。但是,Bcl-w究竟以怎样的方式调控着细胞凋亡,是否需要依赖其他辅助因子?其具体作用机制及通路尚不明确。
本实验成功从人胃癌组织中克隆得到Bcl-w基因CDS区,其序列与基因库中发表的人Bcl-w基因序列完全一致;成功构建了原核表达载体pet28a/Bcl-w,并获得了人Bcl-w融合蛋白,为深入研究Bclw的生物学功能,探讨细胞凋亡的分子机制,研究肿瘤的临床治疗奠定了重要的基础,同时也为推进Bcl-w国产化检测试剂盒的研发提供了可能。
[1]Tsujimoto Y,Gorham J,Cossman J,et al.The t(14;18)chromosome translocations involved in B-cell neoplasms result from mistakes in VDJ joining[J].Science,1985,229(4720):1390-1393.
[2]Chan SL,Yu VC.Proteins of the bcl-2 family in apoptosis signalling:from mechanistic insights to therapeutic opportunities[J].Clin Exp Pharmacol Physiol,2004,31(3):119-128.
[3]Ghiotto F,Fais F,Bruno S.BH3-only proteins:the death-puppeteer's wires[J].Cytometry A,2010,77(1):11-21.
[4]Peina-Slaus N.Genetic and molecular insights into apoptosis[J].Acta Med Croatica,2009,63(Suppl 2):13-19.
[5]Ishitsuka K,Kunami N,Katsuya H,et al.Targeting Bcl-2 family proteins in adult T-cell leukemia/lymphoma:In vitro and in vivo effects of the novel Bcl-2 family inhibitor ABT-737[J].Cancer Lett,2012,317(2):218-225.
[6]Lee EF,Dewson G,Smith BJ,et al.Crystal structure of a BCL-W domain-swapped dimer:implications for the function of BCL-2 family proteins[J].Structure,2011,19(10):1467-1476.
[7]Yang X,Yin J,Yu J,et al.miRNA-195 sensitizes human hepatocellular carcinoma cells to 5-FU by targeting BCL-w[J].Oncol Rep,2012,27(1):250-257.
[8]Bae IH,Park MJ,Yoon SH,et al.Bcl-w promotes gastric cancer cell invasion by inducing matrix metalloproteinase-2 expression via phosphoinositide 3-kinase,Akt,and Sp1[J].Cancer Res,2006,66(10):4991-4995.
[9]Wilson JW,Nostro MC,Balzi M,et al.Bcl-w expression in colorectal adenocarcinoma[J].Br J Cancer,2000,82(1):178-185.
[10]Yan W,Huang JX,Lax AS,et al.Overexpression of Bcl-W in the testis disrupts spermatogenesis:revelation of a role of BCL-W in male germ cell cycle control[J].Mol Endocrinol,2003,17(9):1868-1879.
[11]蒋建伟,吴风云,何金花,等.靶向 Bcl-2、Bcl-xl、Mcl-1、Bcl-w、A1反义核酸抑制消化系肿瘤细胞增殖效果的差异[J].中国药理学通报,2010,26(8):1093-1098.
