重组hCDMP1腺病毒转染骨髓间充质干细胞对其向软骨分化的影响
2012-01-26王月田潘欣宇
王月田,崔 颖,潘欣宇,姚 梅,张 本,李 谌
(1.辽宁医学院,辽宁锦州 121001;2.辽宁医学院附属第一医院,辽宁锦州 121001)
重组hCDMP1腺病毒转染骨髓间充质干细胞对其向软骨分化的影响
王月田1,崔 颖2△,潘欣宇1,姚 梅1,张 本2,李 谌2
(1.辽宁医学院,辽宁锦州 121001;2.辽宁医学院附属第一医院,辽宁锦州 121001)
目的探讨人软骨源性形态发生蛋白1(CDMP1)基因转染对骨髓间充质干细胞(BMSCs)增殖及分化的影响。方法
采用腺病毒转染方法将重组人CDMP1(hCDMP1)基因转入体外培养的兔BMSCs,用免疫印迹法(Western blot)检测hCDMP1蛋白质的表达,并通过检测细胞增殖能力(MTT法)、Ⅱ型胶原(ColⅡ)以及蛋白多糖的表达,分析转染hCDMP1对BMsCs增殖、分化的影响。结果hCDMP1蛋白在基因转染细胞内得到正确表达;hCDMP1基因转染组和对照组相比,ColⅡ、蛋白多糖表达水平显著增高(P0.05),而细胞增殖能力无明显变化(P0.05)。结论外源基因转染可以使BMSCs表达有生物活性的hCDMP1,高表达的hCDMP1可以促进BMSCs向软骨表型分化,但对细胞增殖无明显影响。
骨形态发生蛋白质类;骨髓;间质干细胞;软骨发生;转染
目前选用何种生长调节因子以及如何保证其持续高效的刺激作用在诱导骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)向软骨分化的研究中还处于探索阶段。研究已证明转化生长因子、骨形态发生蛋白、生长分化因子等在诱导BMSCs向软骨分化的过程中发挥着重要的调节作用[1]。软骨源性形态发生蛋白1(cartilage-derived morphogenetic protein 1,CDMP1)是近年来发现的一种多肽生长因子,具有特异的软骨诱导能力,可在异位诱导形成软骨[2]。近年来有关CDMP1对BMSCs的诱导作用的研究多数是重组因子的直接刺激作用,但细胞因子在体内代谢快,持续时间短,诱导效率低。通过基因工程技术将外源CDMP1基因导入BMSCs,使其持续、稳定、高效表达目的基因是解决上述问题的一种措施。
1 材料与方法
1.1 主要试剂 胎牛血清、L-DMEM培养基、青霉素、链霉素、胰蛋白酶、台盼蓝、淋巴细胞分离液、Ad-CMV-CDMP1-IRES-eGFP、Ad-CMV-eGFP、甲 基 噻 唑 基 四 唑 (methyl thiazolyl tetrazolium,MTT)试剂盒、免疫组化试剂盒、Ⅱ型胶原蛋白多克隆抗体及甲苯胺蓝;兔抗人CDMP1单克隆抗体由辽宁医学院耳鼻咽喉头颈外科实验室提供。清洁级新西兰白兔购自辽宁医学院动物中心。
1.2 BMSCs的分离和培养 取1月龄左右的健康新西兰白兔,无菌条件下分离双侧股骨,分别剪开股骨两端,不含血清的L-DMEM冲洗骨髓腔,4号针头反复吹打冲出的骨髓液,100目筛网过滤,参照文献[3]进行细胞的分离和培养。
1.3 腺病毒介导重组人CDMP1转染BMSCs
1.3.1 取第3代兔BMSCs以5×105/孔的密度接种于6孔细胞培养板,常规培养24h,待细胞贴壁后吸去上清。按照公式感染复数(multiplicity of infection,MOI)=(蚀斑形成单位/mL)×所取病毒液体积/待转染的细胞数,取腺病毒病毒液以MOI 50、100、200、300四个值转染 MSCs,留下2孔作为阴性对照。37℃孵育3h,换成完全培养基常规培养48~72h,荧光倒置显微镜下检测增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP),以不引起明显细胞病变效应(cytopathic effect,CPE)的最大MOI作为腺病毒的最佳MOI值。
1.3.2 实验分组 取第3代生长状态良好的BMSCs 9瓶,待细胞生长至约80%汇合,随机分为3组。各种病毒液以最佳MOI值分别转染BMSCs,48~72h在荧光倒置显微镜下观察转染效果。实验组:转染 Ad-CMV-hCDMP1-IRES-eGFP;对照组:转染 Ad-CMV-eGFP;阴性组:未转染病毒。
1.4 CDMP1基因转染后BMSCs的增殖和分化
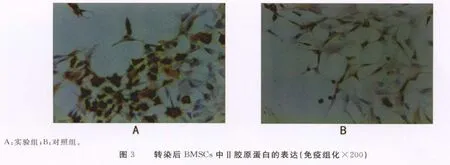
1.4.1 甲苯胺蓝染色及免疫组化方法检测细胞蛋白多糖基质、Ⅱ型胶原的表达 取上述3组细胞爬片(每组10张),丙酮固定,行Ⅱ型胶原免疫组化和甲苯胺蓝染色。医学图像分析系统测定染色的吸光度。200倍镜下切片随机选取3个阳性视野测量吸光度,取其平均值代表该标本的蛋白表达强度。结果以±s表示。
1.4.2 MTT比色法检测细胞增殖活力,绘制细胞生长曲线取上述3组细胞制备细胞悬液,调整细胞密度为1×105/mL,接种于96孔培养板。第1~9天每天同一时点,每组随机选3孔,按照MTT试剂盒说明进行操作。
1.4.3 Western blot检测hCDMP1多肽的表达 取上述3组适量细胞,用PBS洗涤3遍,以150μL裂解液裂解细胞,收集上清液,用RIPA裂解缓冲液(RIPA lysis buffer)稀释,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,蛋白转至硝酸纤维素膜上,用兔抗人CDMP1单克隆抗体标记。膜经彻底洗涤后,用过氧化物酶标记的羊抗兔IgG进行二抗标记。膜上加1mL化学发光剂及增强剂的混合液,暗室反应1min,X光胶片曝光,显影,照相。
1.5 统计学处理 应用SPSS17.0软件进行统计分析,采用单因素方差分析。以P0.05为差异有统计学意义。
2 结 果
2.1 细胞培养 BMSCs刚分离接种时,其内有血细胞混杂,不易分辨成分。可见贴壁细胞呈三角形、多角形或短梭形,在部分区域有细胞的小集落形成,数个至数十个不等。7d后贴壁细胞体积增大,细胞形态基本一致,呈典型的成纤维细胞形态。10~12d后贴壁细胞体逐渐增多并连接成片,呈鱼群状排列。传代培养细胞比原代细胞成分纯净,含少量的混杂细胞。2d后大部分细胞贴壁,细胞形态较舒展,3~4d可见细胞增殖,呈典型的长梭形,细胞数明显增加,7~8d长满瓶底。
2.2 感染后BMSCs增殖活力的检测 MTT比色检测结果:实验组细胞在第3天进入对数生长期,第6天进入平台期,第8、9天生长开始减慢,生长曲线和对照组基本相似。实验组吸光度(A570)值在各时点均高于对照组和阴性组,但差异无统计学意义(P=0.794)。
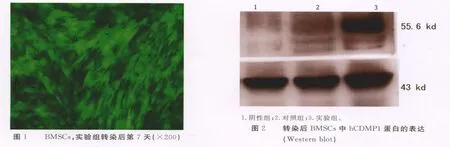
2.3 CDMP1基因修饰后的表达 感染后24h实验组和对照组细胞在荧光显微镜下均可见到少量绿色荧光,48h明显增多,72h可见到大量绿色荧光,荧光与细胞轮廓一致,转染率为90%以上,持续14d以上(封2图1)。阴性组细胞无绿色荧光。Western blot结果:实验组出现相对分子质量约55.6×103的明显的电泳条带,而对照组和阴性组则未显示(封2图2)。
2.4 基因修饰后细胞外基质的检测 Ⅱ型胶原免疫组化结果显示,实验组细胞质出现较明显的棕色颗粒(封3图3),而对照组和阴性组显色较弱。甲苯胺蓝染色显示,实验组细胞质呈深蓝紫色,而对照组和阴性组显色较弱。经计算机图像分析,实验组、对照组及阴性组Ⅱ型胶原表达(以积分光密度IOD表示,下同)IOD 分别为:35.17±1.07、10.32±1.01、10.24±0.90。实验组与对照组、阴性组比较,差异有统计学意义(P0.05)。实验组、对照组及阴性蛋白多糖表达IOD分别为:38.34±1.28、11.44±1.09、10.45±1.11。实验组与对照组、阴性组比较,差异有统计学意义(P0.05)。
3 讨 论
创伤和疾病引起的头颈部软骨缺损的修复是耳鼻咽喉科、头颈外科医师面临的难题。软骨组织工程为解决这一临床难题带来了新的思路和方法。种子细胞作为软骨组织工程三要素之一[4],应具有:来源稳定、取材方便、体外培养增殖能力强、细胞表型稳定、耐机体免疫性高、无致瘤性等优点[5]。BMSCs是源于中胚层和外胚层的一类多能干细胞,因具有自我更新、多向分化、造血支持、促进干细胞植入和免疫调控的特点,成为目前公认的理想的种子细胞[6]。常用的分离BMSCs的方法有全骨髓培养法和密度梯度离心法。马林祥等[7]选用全骨髓培养法和密度梯度离心法二者结合的优化方案,可以得到较纯净的BMSCs。实验采用优化方案,经原代培养获得BMSCs可在体外传20代以上,在数量上能够满足组织工程种子细胞的需要。
CDMP1也即生长分化因子5,是转化生子因子-β超家族的成员,也是骨形态发生蛋白家族中的新亚型[8]。CDMP1是一种分泌的信号分子,在人体骨骼的发育和增长中起关键作用[9],在软骨形成的初期主要是促进间充质前软骨细胞的黏附、聚集和分化,后期则显著促进软骨细胞的成熟和肥大。CDMP1基因突变或缺失导致软骨细胞黏附、增殖能力下降,使机体在发育阶段不能形成正常软骨而致肢体畸形。
随着组织工程和基因工程的发展,细胞治疗和基因治疗对损伤修复产生了深远影响[10]。基因疗法是一种控制功能蛋白质及其过程的时空表达有效的方法,可能按照一种生理性释放调整[11]。有人用脂质体成功将hCDMP1基因转染BMSCs并诱导成软骨细胞,但脂质体转染效率低。目前病毒载体是其最有效的方法,通常采用的病毒载体有腺病毒、逆转录病毒、腺相关病毒和单纯疱疹病毒本载体,腺病毒载体对于瞬时转染是有用的[12],但安全性尚未确定,基因表达的可控性有待提高。
本实验采用腺病毒携带hCDMP1基因成功导入BMSCs,Western blot等方法证实目的基因得到了稳定表达,为以后运用该技术将hCDMP1用于基因治疗提供了实验基础。hCDMP1基因转染未引起BMSCs的过度增殖或抑制,保持了细胞原有的生长状态。Ⅱ型胶原和细胞蛋白多糖是软骨细胞的特征性标志。基因转染后BMSCs合成细胞外基质的能力增强,实验组Ⅱ型胶原和细胞蛋白多糖基质表达水平与对照组比较,均显著提高,提示hCDMP1有诱导BMSCs向软骨表型分化的作用。所以,将hCDMP1基因转染的BMSCs用于体外构造工程化软骨,或将其和生物降解材料相结合移植体内修复软骨缺损,促进了基因加强软骨工程的更大发展。
[1] 任晓勇.人生长分化因子-5基因转染骨髓间充质干细胞及用于软骨缺损修复的初步研究[D].西安:第四军医大学,2005.
[2] Steck E,Bertram H,Abel R,et al.Induction of intervertebral disclike cells from adult mesenchymal stem cells[J].Stem Cells Mar,2005,23(3):403-411.
[3] Cui Y,Wang H,Yu M,et al.Differentiation plasticity of human fetal articular chondrcytes[J].Otolaryngol Head Neck Surg,2006,135(1):61-67.
[4] Kim IY,Seo SJ,Moon HS,et al.Chitosan and its derivatives for tissue engineering applications[J].Biotechnol Advances,2008,26(1):1-21.
[5] Bosnakovski D,Mizuno M,Kim G,et al.Isolation and multilineage differentiation of bovine bone marrow mesenchymal stem cell[J].Cell Tissue Res,2005,319(2):243-253.
[6] Romanov YA,Darevskaya AN,Merzlikina NV,et al.Mesenchymal stem cells from human bone marrow and adipose tissue:isolation,characterization and differentiation potentialities[J].Bull Exp Biol Med,2005,140(1):138-143.
[7] 马林祥,崔颖,潘欣宇,等.BMSCs-PLGA复合物修复软骨缺损的实验研究 [J].山东医药,2009,49(46):28-29.
[8] Miyamoto Y,Mabuchi A,Shi D,et al.A functional polymorphism in the 5′UTR of GDF5is associated with susceptibility to osteoarthritis[J].Nature Genetics,2007,39(4):529-532.
[9] Savarirayan R,White SM,Goodman FR,et al.Broad phenotypic spectrum caused by an identical heterozygous cdmp-1mutation in three unrelated families[J].Am J Med Genet A,2003,117A(2):136-142.
[10]付小兵.组织再生、梦想希望和挑战[J].中国工程科学,2009,11(10):122-128.
[11]Sun XJ,Xia LG,Chou LL,et al.Maxillary sinus floor elevation using a tissue engineered bone complex with BMP-2gene modified bMSCs and a novel porous ceramic scaffold in rabbits[J].Arch Oral Biol,2010,55(3):195-202.
[12]彭亮权,王大平.转基因间充质干细胞在骨组织工程中的应用[J].国际骨科学杂志,2008,29(4):257-259.
Effects of adeno-hCDMP1 transfection on in vitro chondrogenic differentiation of rabbit bone marrow mesenchymal stem cells
ObjectiveTo investigate the effects of gene transfaction with human cartilage-derived morphogenetic protein 1(CDMP1)on the differentiation and proliferation of rabbit bone marrow mesenchymal stem cells(BMSCs).MethodsBMSCs were obtained from New zealand rabbits.Exogenous recombinant hCDMP1was transfected into BMSCs with adenovirus method.Then hCDMP1expression at protein level was measured by western blot method.Expression of Type 1Icollagen(ColⅡ),proteoglycan and growth of the cells were all measured by biologicalMethodsto evaluate the effects of gene transfer on the differentiation of rabbit BMSCs.ResultsAfter hCDMP1gene transfection,BMSCs expressed hCDMP1protein,and compared with the control groups,expression of proteoglycan and ColⅡincreased significantly,but no significant difference appeared in cell proliferation.ConclusionGene transfer with hCDMP1is an effective way to enhance the expression of CDMP1at protein.The expression of heterogenetic hCDMP1gene can induce BMSCs′differentiation to chondrogenic cells.But the gene transfection has no obvious effects on the proliferation of BMSCs.
bone morphogenetic proteins;bone marrow;mesenchymal stem cells;chondrogenesis;transfection
10.3969/j.issn.1671-8348.2012.16.004
A
1671-8348(2012)16-1570-02
△通讯作者,E-mail:Yingwu2002@163.com。
2011-10-12
2011-11-30)
•基础研究•
