HPLC法同时测定复方土荆皮酊中4种二萜类成分
2012-01-25李晓翠苗爱东
李晓翠,苗爱东
(1.北京军区联勤部药品仪器检验所,北京100071;2.河北北方学院,河北张家口075000)
复方土荆皮酊是由土荆皮药材提取液与苯甲酸、水杨酸制成的复方制剂,具有抗表皮真菌和止痒等作用[1-2]。土荆皮提取液的主要成分是二萜酸类化合物[3-6],包括土荆皮甲酸、土荆皮乙酸、土荆皮乙酸-O-β-D-葡萄糖苷和土荆皮丙酸等成分,其中土荆皮乙酸是土荆皮药材的主要成分,具有抗真菌和抗肿瘤等作用[7-12]。目前对该制剂中土荆皮原料药材所含有效成分(或特征成分)的测定方法很少见报道,为有效控制复方土荆皮酊的质量,本实验采用高效液相色谱法同时测定该制剂中土荆皮乙酸-O-β-D-葡萄糖苷、土荆皮丙酸、土荆皮乙酸和土荆皮甲酸等4种二萜类成分,该方法准确度高,重复性好,为更好的控制复方土荆皮酊的质量提供依据。
1 仪器与试药
Agilent 1200高效液相色谱仪(包括低压梯度四元泵、自动进样器、恒温箱和DAD检测器)、Chem Station色谱工作站(美国安捷伦科技公司);Mettler Toledo AG 285型电子分析天平(瑞士梅特勒-托利多公司,d=0.01 mg);KQ2200E型超声波清洗器(江苏昆山市超声仪器有限公司)。
土荆皮乙酸对照品(批号110880-201003,纯度为99.1%)购自中国药品生物制品检定所。土荆皮乙酸-O-β-D-葡萄糖苷对照品(批号101224)、土荆皮丙酸对照品(批号101223)、土荆皮甲酸对照品(批号101220)均购自四川成都普瑞法科技开发有限公司。3种对照品经HPLC峰面积归一化法测定纯度均在98%以上。收集了4个生产厂家(A~D)共17批次的复方土荆皮酊。A:2批次;B:1批次;C:1批次;D:14批次。乙腈为色谱纯,水为纯化水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件采用Agilent Zorbax SB C18(4.6 mm×250 mm,5 μm)色谱柱;以乙腈(A)-0.09%甲酸(B)为流动相,梯度洗脱0~8 min:30%~40%A;8~22 min:40%~100%A;柱温35℃;体积流量1.0 mL/min;检测波长262 nm;进样量为10 μL。
2.2 对照品溶液的制备精密称取土荆皮乙酸-O-β-D-葡萄糖苷、土荆皮丙酸、土荆皮乙酸和土荆皮甲酸对照品适量,分别置于50 mL量瓶中,加甲醇配制成单一对照品贮备液(质量浓度分别为231.965 μg/mL、84.402 μg/mL、368.652 μg/mL、7.958 μg/mL)。精密量取各对照品贮备液适量至25 mL量瓶中,加甲醇稀释至刻度,得土荆皮乙酸-O-β-D-葡萄糖苷、土荆皮丙酸、土荆皮乙酸和土荆皮甲酸的质量浓度分别为81.223、13.504、73.730、0.796 μg/mL的混合对照品溶液。
2.3 供试品溶液的制备精密量取复方土荆皮酊样品5.0 mL置于10 mL量瓶中,用60%甲醇定容至刻度,摇匀,用0.45 μm的微孔滤膜过滤,作为多成分定量测定用供试品溶液。
2.4 阴性对照溶液的制备按处方比例和制备工艺制备不含土荆皮药材提取液的阴性样品,按2.3项下方法制成阴性对照溶液。
2.5 系统适用性实验分别精密吸取2.2项,2.3项和2.4项下的混合对照品溶液、供试品溶液、阴性对照溶液各10 μL,注入高效液相色谱仪,记录色谱图,结果见图1。在上述色谱条件下,土荆皮乙酸-O-β-D-葡萄糖苷、土荆皮丙酸、土荆皮乙酸和土荆皮甲酸与其他相邻色谱峰的分离度均大于1.5,阴性对照无干扰。
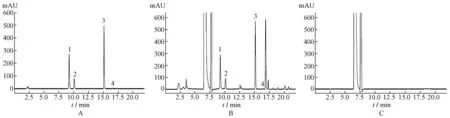
图1 复方土荆皮酊HPLC色谱图Fig.1 HPLC chromatograms of Compound Tujingpi Tincture
2.6 方法学考察
2.6.1 线性关系考察分别精密吸取上述对照品贮备液适量,置于10 mL量瓶中,用甲醇配制成含土荆皮乙酸-O-β-D-葡萄糖苷质量浓度为11.598~82.845 μg/mL,土荆皮丙酸为1.206~27.009 μg/mL,土荆皮乙酸为14.746~126.392 μg/mL,土荆皮甲酸为0.159~2.274 μg/mL的混合对照品溶液。精密吸取上述对照品溶液10 μL注入高效液相色谱仪进行测定。分别以质量浓度C(μg/mL)为横坐标,色谱峰面积A为纵坐标,绘制标准曲线,线性方程见表1。

表1 回归方程和线性范围Tab.1 Regression equations and linear ranges
2.6.2 精密度试验按照上述色谱条件,精密吸取2.3项下供试品溶液10 μL注入高效液相色谱仪中,连续进样3日,每日6次,计算日内精密度的RSD为0.09%、0.15%、0.06%和0.17%;日间精密度RSD为0.32%、0.16%、0.29%和0.71%。
2.6.3 重复性试验分别取同一批次(20110402)样品,按照2.3项下的方法制备供试品溶液,在上述色谱条件下测定土荆皮乙酸-O-β-D-葡萄糖苷、土荆皮丙酸、土荆皮乙酸和土荆皮甲酸,平行操作6份,其RSD值分别为0.31%、0.33%、0.27%和0.27%,表明该方法的重复性良好。
2.6.4 稳定性试验精密吸取同一批次(20110402)样品在上述相同色谱条件下于1、2、3日分别进样分析,记录各色谱峰面积值,结果土荆皮乙酸-O-β-D-葡萄糖苷、土荆皮丙酸、土荆皮乙酸和土荆皮甲酸的RSD值分别为0.27%、0.19%、0.29%和0.69%。表明供试品溶液在3 d内稳定性良好。
2.6.5 加样回收率试验取已知含有量的复方土荆皮酊(20110402)2.5 mL,平行操作6份,分别加入适量的混合对照品溶液,按照2.3项下的方法制备供试品溶液并测定,计算加样回收率,结果见表2。
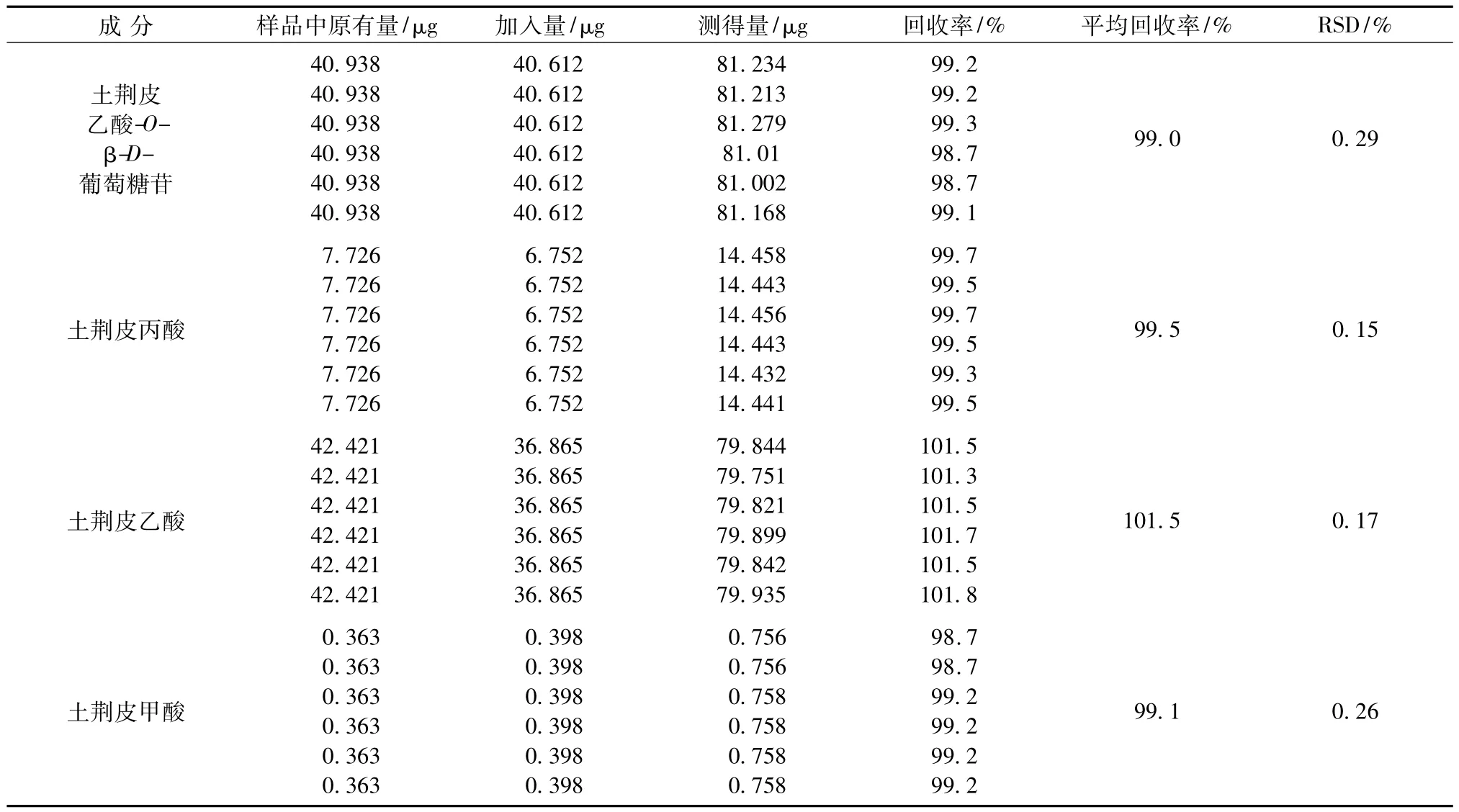
表2 4种二萜类化合物的回收率测定结果Tab.2 Results of recovery tests of four diterpenoids
2.7 样品测定取4个生产厂家共17批次复方土荆皮酊,按2.3项下方法制备供试品溶液,精密吸取10 μL注入高效液相色谱仪中,在上述相同色谱条件下记录土荆皮乙酸-O-β-D-葡萄糖苷、土荆皮丙酸、土荆皮乙酸和土荆皮甲酸的峰面积值,通过回归方程计算4种二萜类化合物的质量浓度,结果见表3。
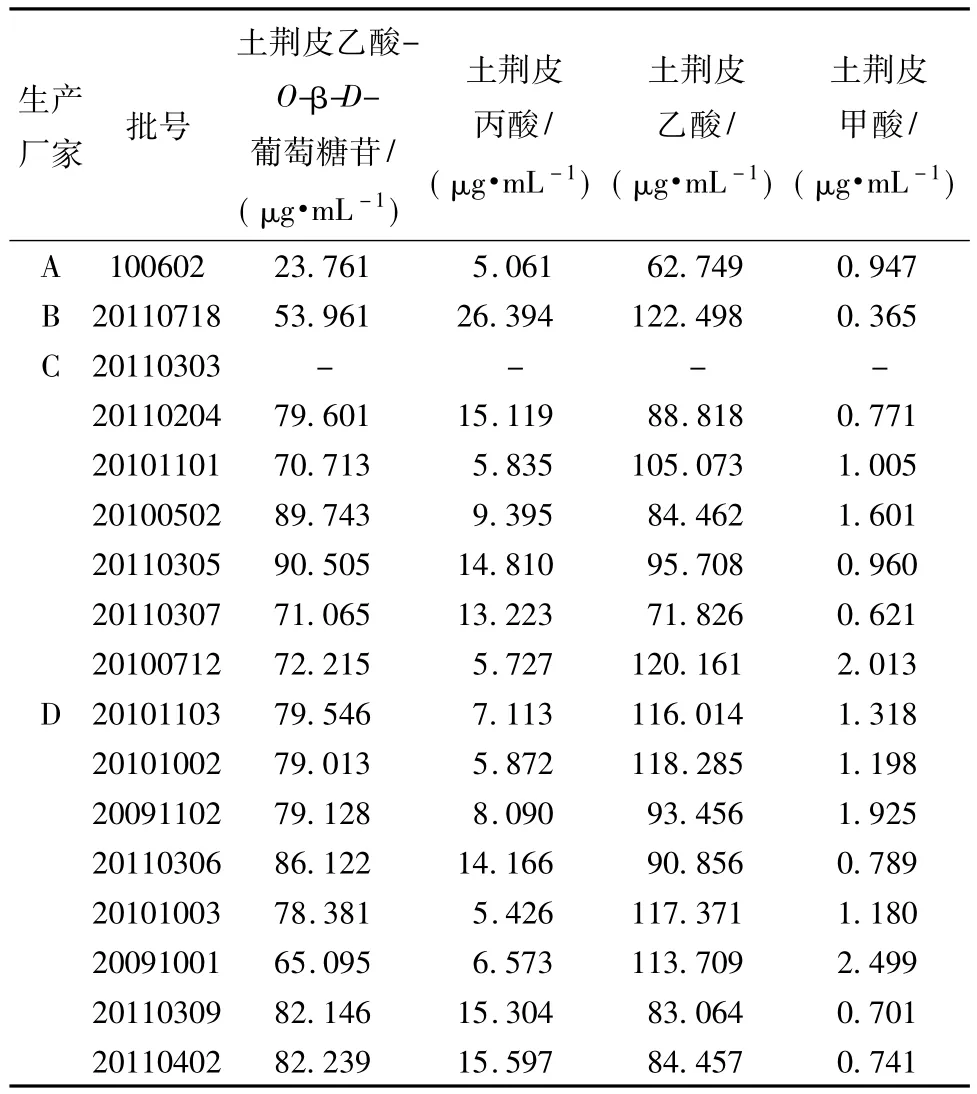
表3 4厂家共17批次样品测定结果Tab.3 Results of content determination of seventy batches of samples from four factories
3 讨论
3.1 色谱条件的选择通过DAD检测器扫描土荆皮乙酸-O-β-D-葡萄糖苷、土荆皮丙酸、土荆皮乙酸和土荆皮甲酸的紫外吸收光谱,其最大吸收波长分别是266 nm、262 nm和260 nm。为了在同一检测波长下测定这4种二萜类成分的含有量,最终选择262 nm作为检测波长。在此波长下,基线平稳,峰面积较大,各色谱峰的峰形较好。
本实验先后考察了甲醇、乙腈与水、酸溶液(醋酸、磷酸和甲酸)等流动相系统并进行分析比较,结果发现选择乙腈-0.09%甲酸为流动相时基线平稳。对不同的梯度洗脱程序进行研究,从分离情况和出峰时间等方面综合考虑,选择乙腈(A)-0.09%甲酸(B)0~8 min:30%~40%A;8~22 min:40%~100%A进行梯度洗脱,所得色谱峰的峰形较好且分离效果最佳。
3.2 提取条件的选择分别考察了60%甲醇、乙醇和流动相作为提取溶剂,在不同超声提取时间下(0、5、10、20 min)对定量测定的影响,结果发现60%甲醇为提取溶剂时基线平稳,色谱峰峰形较好,柱效较高,且超声时间对提取的各成分含有量并无明显差别,故采用60%甲醇对样品直接进行稀释,操作简便,快速。
3.3 现执行标准[2]仅采用酸碱滴定法测定了复方土荆皮酊的总酸量,对处方中加入的苯甲酸、水杨酸和土荆皮药材所含主要成分的含量限度均未作出明确的规定,难以有效控制其内在质量。目前对该制剂中苯甲酸和水杨酸两种化学成分的定量测定方法研究较多[13-16],但有关该制剂中土荆皮药材中多成分定量测定方法的研究尚未见文献报道。
对市售的4个生产厂家共17批次复方土荆皮酊样品进行检测时发现,不同厂家生产的复方土荆皮酊中4种二萜类成分的含有量参差不齐,其中土荆皮乙酸的质量浓度较高,22.648~123.275 μg/mL,土荆皮乙酸-O-β-D-葡萄糖苷次之,质量浓度范围在20.291~90.114 μg/mL,再次是土荆皮丙酸,2.542~26.061 μg/mL,土荆皮甲酸的质量浓度最低,在0.234~2.380 μg/mL之间。同时发现仅有4个生产厂家共计16批次制剂样品中可同时检出这4种成分,其中有1批次药品均未检出这4种成分的任何一种,提示相关厂家对土荆皮原料药材的购入和使用把关不严,使用了伪劣药材投料生产,需要引起各生产厂家、使用单位和监督管理部门的高度重视,以确保用药的安全、有效。
[1]中国人民解放军医疗机构制剂规范[S].2002:118-119.
[2]卫生部药品标准:中药成方制剂第十三册[S].2007:142.
[3]Liu P,Sun J H,Xu M,et al.Characterization of diterpenoids in the bark of Pseudolarix Kaemferi by HPLC-ESI-MSn[J].Acta Pharm Sin,2011,46(2):213-220.
[4]Liu P,Guo H,Guo H Z,et al.Simultaneous determination of seven major diterpenoids in Pseudolarix Kaemferi by high-performance liquid chromatography DAD method[J].J Pharm Biomed Anal,2007,44(3):730-736.
[5]Han Q B,Yip Y K,Yang N Y,et al.Rapid analysis of pseudolaric acids in Cortex Pseudolaricis and related medicinal products by high performance liquid chromatography[J].Talanta,2007,73(4):757-763.
[6]Ye X,Tang M H,Chen L J,et al.Rapid separation and identification of major constituents in Pseudolarix kaempferi by ultra-performance liquid chromatography coupled with electrospray and quadrupole time-of-flight tandem mass spectrometry[J].Rapid CommunMass Spectrom,2009,23(24):3954-3962.
[7]Tan W F,Zhang X W,Li M H,et al.Pseudolarix acid B inhibits angiogenesis by antagonizing the vascular endothelial growth factor-mediated anti-apoptotie effect[J].Eur J Pharmacol,2004,499(3):219-228.
[8]徐永红,王学清,鞠晓华,等.土槿皮乙酸诱导人胃癌SGC7901细胞凋亡及机制[J].中国药理学通报,2008,24(5):601-606.
[9]于静华,田代真一,小野寺敏,等.土槿皮乙酸B不通过Fas途径诱导人乳腺癌MCF-7细胞凋亡和M期周期阻滞[J].中国药理学通报,2008,24(11):1509-1513.
[10]周林妍,李岩.土槿皮乙酸B对结直肠癌细胞SW620增殖和凋亡的影响[J].中华消化杂志,2009,29(11):765-766.
[11]胡云,侯丽辉,吴效科,等.土荆皮酸对HeLa细胞端粒酶活性和细胞周期的影响[J].中国妇幼保健,2008(23):1130-1131.
[12]胡云,李克深,吴效科,等.土荆皮酸对宫颈癌Hela细胞侵袭转移及基质金属蛋白酶表达的影响[J].解放军医学杂志,2008,33(10):1242-1243.
[13]关恺珍,梁毅,卢丽霞.HPLC测定复方土槿皮酊中苯甲酸和水杨酸的含量[J].中国实用医药,2009,4(6):32-34.
[14]朱银春,杨矿生.RP-HPLC法测定复方土槿皮酊中水杨酸和苯甲酸的含量[J].首都医药,1998,5(10):17.
[15]胡晓炜,李亚芳.RP-HPLC法测定复方土荊皮酊中苯甲酸、水杨酸的含量[J].中国药师,2002,5(10):607-608.
[16]李俊松,欧阳强,张淑芳,等.反相高效液相色谱法测定复方土槿皮酊中水杨酸和苯甲酸的含量[J].中国医院药学杂志,1994,14(3):108-110.
