家蝇几丁质酶基因的序列分析、克隆和诱导表达*
2012-01-24吴建伟吴沁怡
国 果,吴建伟,吴沁怡,付 萍,张 勇
几丁质是构成大多数真菌细胞壁的主要成分,同时也广泛存在于节肢动物外壳和软体动物中。它不仅是昆虫的重要结构组织,也是昆虫防止机械损伤和生物危害的屏障。几丁质酶(chitinase)是几丁质降解酶系重要成员,属于糖苷水解酶18家族GH18,能够将几丁质聚合物分解成壳糖乙糖苷和乙酰葡糖胺糖苷两个部分[1]。该酶广泛存在于各种真菌、植物、昆虫和鱼类等生物中。催化水解昆虫几丁质的酶主要是几丁质酶,通过阻断几丁质酶,可以阻止昆虫蜕皮和围食膜再生,以达到杀灭昆虫的目的[2-3]。因此,研究获取昆虫来源的几丁质酶可以作为生物杀虫剂来控制昆虫和真菌病害。目前已克隆得到黑腹果蝇(Drosophila melanogaster)、冈比亚按蚊 (Anopheles gambiae)、赤拟谷盗(Tribolium castaneum)、家蚕(Bombyx mori)、埃及伊蚊(Aedes aegypti)等二十几种昆虫的几丁质酶基因cDNA[4-6]。
家蝇(Musca domestica)是世界性分布的卫生昆虫,从幼虫到成虫均生活在肮脏的环境中,是许多病原体的携带者,约60多种引起人类和动物疾病的病原体与家蝇有关,包括伤寒、霍乱、痢疾、肺结核及一些寄生虫病等。目前对家蝇的研究主要是集中在抗菌肽方面[7],对其几丁质酶的研究尚未见报道。本研究克隆了家蝇几丁质酶基因,并建立了体外表达系统,对其序列进行生物信息学的分析,为进一步研究家蝇几丁质酶的酶学特性和有效利用奠定一定的基础。
1 材料与方法
1.1 材料
1.1.1 文库、菌种及质粒 家蝇三龄幼虫全长cDNA质粒文库的构建和EST测序及UniGene分析由北京华大合作完成。原核表达质粒pET 28a(+)和大肠杆菌BL21(DE3)由中山大学引进本实验室保存。
1.1.2 主要试剂及工具酶 Ex Taq酶(含dNTP),EcolⅠ、HindⅢ、T4DNA连接酶,DNA 标准(DL15,000,DL2,000)均购自大连宝生物工程公司;异丙硫代β-D半乳糖苷(IPTG)购自美国Promega公司;DNA凝胶回收试剂盒、质粒纯化试剂盒购自广州铂尔生物。
1.1.3 引物合成和DNA测序 基因扩增引物合成和重组质粒DNA测序由Invitrogen上海生物技术有限公司完成。
1.2 方法
1.2.1 家蝇几丁质酶基因Ⅰ(MDCⅠ)的识别及序列测定 对测定得到的家蝇三龄幼虫EST序列进行BLASTX分析,从中筛选获得编码家蝇几丁质酶基因的文库质粒(编号为005-C09),命名为MDCⅠ。
1.1.2 MDCⅠ 基因的生物信息学分析 利用瑞士生物信息学研究所的蛋白分析专家系统(Expert Protein Analysis System,ExPASy)提供的生物信息学工具,分析预测蛋白质的理化性质、修饰位点、信号肽、跨膜区及二级结构等。
1.2.3 MDCⅠ 基因的扩增 根据已获得的MDCⅠ编码序列,利用DNA Club和Primer5.0设计引物。上游引物:5′GCCGAATTCTTTCTAGTGGTATGGCAGCAG 3′带EcoRⅠ酶切位点;下游引物:5′GCGAAGCTTTCTGTTGGAATGATCAGT GG 3′,带HindⅢ酶切位点。
以家蝇三龄幼虫cDNA文库中MDCⅠ基因的质粒为模板,94℃预变性5min后,热循环参数为94℃1min,59℃1min,72℃1min,共35个循环,最后72℃延伸10min。PCR产物1%琼脂糖凝胶电泳回收。
1.2.4 重组原核表达质粒(pET 28a(+)-MDCⅠ)的构建及鉴定 将PCR产物和原核表达质粒pET 28a(+)经EcoRⅠ、HindⅢ 双酶切后回收,连接并转化大肠杆菌BL 21/DE3感受态细胞,卡那霉素筛选阳性克隆,对阳性克隆提取质粒进行PCR,双酶切和测序鉴定。
1.2.5 MDCⅠ基因在大肠杆菌BL 21/DE3中的诱导表达 取50μL培养过夜的阳性克隆菌液,加入含有卡那霉素的5mL LB培养基中(菌液/培养基为1/100),37℃220r/min振摇至 OD600=0.4~0.6时,加入IPTG至终浓度1mmol/L,诱导表达5h。离心收集菌体,在沉淀中加入100μL 1×SDS-PAGE上样缓冲液,煮沸5min,13000r/min离心1min取上清10μL进行SDS-PAGE电泳分析。
2 结 果
2.1 序列分析 MDCⅠ基因与果蝇的同源基因氨基酸序列的一致性可达60%~70%,ORF全长753bp,编码251个氨基酸(图1),预测分子量为28.63kDa,理论等电点(pI值)5.78。含有3个半胱氨酸,在溶液中性质稳定。
MotifScan(模序)分析显示,该蛋白含有1个N-糖基化位点,3个N-肉豆蔻酰化位点,6个蛋白激酶C磷酸化位点及1个几丁质酶的活性位点;由Signal P 3.0预测N端含有23个氨基酸残基的信号肽;PredictProtein分析蛋白的拓扑结构和二级结构显示,MDCⅠ蛋白有一个跨膜区位于aa6-aa16,Sec预测α螺旋(H)、β折叠(E)和无规则卷曲(L)的比例是:29.54:17.79:52.67,以无规则卷曲为主。
BLAST对其保守结构域分析显示,MDCⅠ中含有几丁质酶的保守结构域和活性位点,属于糖苷水解酶18家族(图2)。

图1 家蝇几丁质酶基因Ⅰ开放阅读框cDNA序列及对应编码的氨基酸序列Fig.1 Full-length cDNA sequence of MDCⅠand the amino acid sequence encoded by the ORF
2.2 MDCⅠ基因扩增及原核重组质粒的鉴定MDCⅠ基因经PCR扩增后,获得了800bp左右的特异条带(图3泳道1)。将重组质粒进行双酶切鉴定,产物进行1%琼脂糖凝胶电泳。电泳结果显示(图3泳道3):重组质粒双酶切后,在800bp左右有一清晰的条带,与目的基因的大小基本相符,提示重组质粒构建成功。将挑选的阳性克隆子送Invitrogen公司,进一步以pET 28a(+)的通用引物对重组质粒测序,结果表明相应的插入序列与目的基因cDNA序列一致,证明MDCⅠ基因原核表达重组质粒构建成功。
2.3 目的基因表达产物的SDS-PAGE鉴定 取重组菌诱导前后的表达产物进行SDS-PAGE,结果发现诱导的重组菌约在32kDa左右出现表达条带,与目的蛋白预测的分子量(28.63kDa)加上所带His标签分子量(约3kDa)基本相符,而未诱导菌无此条带(图4)。

图2 GenBank中MDCⅠ功能域分析Fig.2 Functional domain analysis of MDCⅠin GenBank
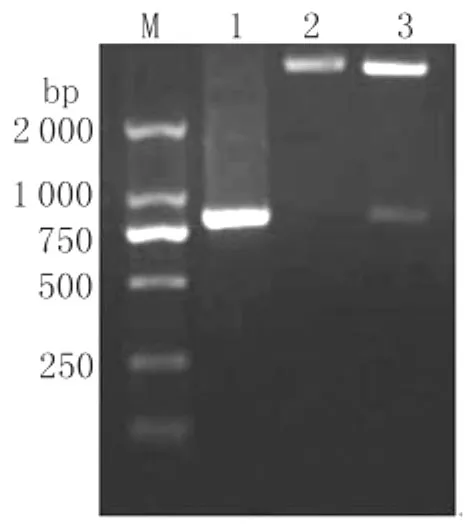
图3 重组质粒的双酶切鉴定图Fig.3 Identification of pET 28a(+)-MDCⅠby PCR amplification and restriction enzymes digestionM:DNA Marker DL 2000;1:PCR product of MDCⅠamplified from cDNA library of Musca domestica;2:pET 28a(+)digested by restriction enzymes EcoRⅠand HindⅢ;3:pET 28a(+)-MDCⅠdigested by restriction enzymes EcoRⅠand HindⅢ
3 讨 论
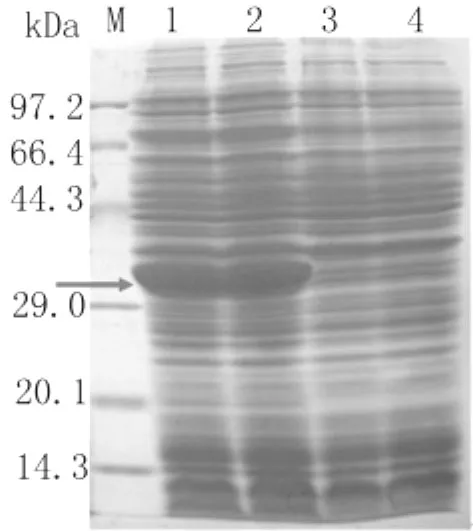
图4 重组质粒pET 28a(+)-MDCⅠ在大肠杆菌的表达产物SDS-PAGE电泳分析1:蛋白质分子量标准;2、3:IPTG诱导的表达产物;4、5:未诱导的表达产物箭头所指为目标蛋白Fig.4 SDS-PAGE analysis on prokaryotic expression product of pET 28a(+)-MDCⅠM,1:Protein marker;2,3:BL21cell containing IPTG induced pET 28a(+) -MDCⅠ;4,5:BL21 cell containing uninduced pET 28a(+)-MDCⅠ
一种昆虫体内几丁质酶基因有1个还是多个在很长时间内存在争议,随着昆虫基因组测序的完成,Zhu Q等2004年首次报道在果蝇中有多个几丁质酶基因[8]。我课题组在对家蝇EST序列分析的过程中,也发现了家蝇体内至少存在两个几丁质酶基因,本研究选取了其中一个基因进行序列分析及克隆表达(另一个基因另文报道),命名为 MDCⅠ。MDCⅠ基因序列包含完整的开放阅读框,为全长cDNA序列。序列分析显示,该酶具有典型的几丁质酶结构特征,从N端到C端依次含有信号肽、几丁质酶活性中心,编码的氨基酸序列与18家族昆虫几丁质酶有较高的相似性。一般认为,昆虫几丁质酶分子量在40~85kDa之间,比植物几丁质酶(25~40kDa)和细菌几丁质酶(20~60kDa)大[9],而我们得到的MDCⅠ预测的蛋白分子量为28kDa左右,表达出的蛋白经SDS-PAGE电泳也证实了其分子量与预测的分子量基本相符,提示家蝇几丁质酶分子量较其他昆虫的小。
本研究将家蝇几丁质酶基因片段克隆到原核表达载体pET 28a(+)中,构建重组质粒pET 28a(+)/MDCⅠ,所获得的重组质粒经过酶切、PCR和测序鉴定,证实含有目的基因片段,且连接、构建正确。重组质粒转化入大肠杆菌BL 21/DE3,IPTG诱导表达,电泳显示重组蛋白条带非常清晰,表明重组蛋白得到了高效表达,本实验结果为进一步研究MDCⅠ的生物学活性及表达模式奠定了基础。
[1]Dahiya N,Tewari R,Hoondal GS.Biotechnological aspects of chitinolytic enzymes:a review[J].Appl Microbiol Biotechnol.2006,71(6):773-782.DOI:10.1007/s00253-005-0183-7
[2]Liu MY,Zhang HB,Hu XQ,et al.Purification and characterization of a chitinase from Bombyx mori[J].Chin J Biotech,2010,26(3):404-409.(in Chinese)刘明艳,张洪斌,胡雪芹,等.昆虫来源的几丁质酶的分离纯化及酶学性质[J].生物工程学报,2010,26(3):404-409.
[3]Tian H,Peng H,Yao Q,et al.Developmental control of a lepi-dopteran pest Spodoptera exigua by ingestion of bacteria expressing dsRNA of a non-midgut gene[J].PloS One,2009,4(7):e6225.DOI:10.1371/journal.pone.0006225
[4]Bolognesi R,Arakane Y,Muthukrishnan S,et al.Sequences of cDNAs and expression of genes encoding chitin synthase and chitinase in the midgut of Spodoptera frugiperdaInsect[J].Insect Biochem Mol Biol,2005,35(11):1249-1259.DOI:10.1016/j.ibmb.2005.06.006
[5]Daimon T,Hamada K,Mita K,et al.A Bombyx mori gene,BmChi-h,encodes a protein homologous to bacterial and baculovirus chitinases[J].Insect Biochem Mol Biol,2003,33(8):749-759.DOI:10.1016/S0965-1748(03)00084-5
[6]Genta FA,Blanes L,Cristofoletti PT,et al.Purification,characterization and molecular cloning of the major chitinase from Tenebrio molitor larval midgut[J].Insect Biochem Mol Biol,2006,36(10):789-800.DOI:10.1016/j.ibmb.2006.07.007
[7]Jin XB,Zhu JY,Ma Y,et al.The expression of anti-bacterial peptide cecropin gene in COS-7cells and the preliminary study on the activities of its gene product[J].Chin J Zoonoses,2007,23(6):566-568.(in Chinese)金小宝,朱家勇,马艳,等.家蝇抗菌肽基因Cecropin在COS-7细胞中的表达及产物活性初步研究[J].中国人兽共患病学报,2007,23(6):566-568.
[8]Zhu Q,Deng Y,Vanka P,et al.Computational identification of novel chitinase-like proteins in the Drosophila melanogaster genome[J].Bioinformatics,2004,20(2):161-169.DOI:10.1093/bioinformatics/bth020
[9]Zhang FL,Wang ZY,Wang ZB,et al.Insect chitinases and their application prospects in plant pest control[J].For Pest Dis,2007,26(4):22-25.(in Chinese)张福丽,王志英,王占斌,等.昆虫几丁质酶及其在植物害虫防治中的应用前景[J].中国森林病虫,2007,26(4):22-25.
