致鹅败血症粪肠球菌溶血素激活因子基因克隆及序列分析*
2012-01-24狄婷婷
狄婷婷,高 原,聂 鑫
肠球菌引起医院内病人感染和死亡的例数正在逐步 增 加[1],其 致 病 菌 主 要 是 粪 肠 球 菌[2-3]。 近 年来,动物感染肠球菌发病和死亡的报道也越来越多[4],粪肠球菌也是其主要致病菌[5-7]。肠球菌中的屎肠球菌可以通过发病猪直接传染人,引起人发病死亡[5],是新发现的人畜共患病病原体。Larsen J等在临床患传染性心内膜炎的老年病人体内分离到猪源粪肠球菌,有的病人因此而死亡,证明粪肠球菌也是一种新的人畜共患病病原菌[8]。研究发现,猪源粪肠球菌毒力岛基因与人源相关基因、致羔羊脑炎粪肠球菌毒力因子基因片段与医学临床中某些该菌的相关基因片段同源性很高,因此认为人与动物粪肠球菌之间存在基因水平转移或存在着某种联系[9-10]。此外,粪 肠 球 菌 也 能 引 起 人 食 物 中 毒[11]。刘磊从新鲜猪肉中分离到11株粪肠球菌,致病基因检出率非常高,提示动物性食品中的粪肠球菌具有一定致病力[12],存在着经肉食品感染人的危险。在欧洲,将粪肠球菌作为益生菌饲料添加剂来调节肠道菌群,同时用与万古霉素交叉耐药的阿伏霉素作促生长剂,结果在动物肠道内诱导耐万古霉素肠球菌大量增殖,会通过食品传播给人类。除耐万古霉素肠球菌外,耐庆大霉素肠球菌也可通过食品由动物传播给人[13]。肠球菌的多重耐药性也能通过质粒在人和饲养动物之间有效传播[13-14]。因此,致病性粪肠球菌研究具有重要的公共卫生学意义。
粪肠球菌感染致死主要由其毒力因子所致,毒力因子包括细胞溶解素(Cyl)、胶原蛋白黏附素(Ace)、表面蛋白(esp)、聚集物质(As)、明胶酶 E(gelE)、心内膜炎抗原(efaA)、信息素(pheromone)等[15]。其中Cyl是主要毒力因子,它能增强细菌的感染和致死能力。Cyl由结构基因CylL1和CylLs、修饰基因CylM、转运基因CylB、激活基因CylA和免疫基因CylI组成[16]。其中CylA能激活Cyl前体蛋白,是Cyl获得溶解细胞活性从而具有感染致死能力的关键因素,也是致病性研究的主要毒力因子[17]。
将临床分离的4株致鹅败血症粪肠球菌的CylA基因片段克隆到pMD18-T载体中,进行序列测定,与GenBank登录的国外从人体分离的和国内从猪体分离的致病性粪肠球菌CylA基因序列做同源性比对分析,了解粪肠球菌的CylA基因的遗传变异情况,为遴选致病性粪肠球菌检测诊断、免疫预防的靶基因和研究溶血素激活基因功能奠定基础。
1 材料和方法
1.1 菌株 本试验使用的致鹅败血症粪肠球菌ME1、ME2、ME3和 ME4,由本实验室通过形态学和生长耐受性观察,菌属区别、分群和菌种鉴定试验,16SrDNA检测、系统进化分析和致病性试验鉴定为粪肠球菌并根据它们相同的16SrDNA序列统一命名为TLME3,提交GenBank,登陆序列编号为:HQ831431[18]。参考菌株 ATCC29212为标准菌株质控粪肠球菌,购自南京便诊生物科技有限公司;大肠杆菌DH5α由本实验室保存。
1.2 主要试剂 Taq酶购自Promega公司;dNTPs、DNA Marker(DL2000和 DL15000)、限制性内切酶EcoRⅠ和XhoⅠ、克隆载体pMD18-T、蛋白酶K、T4DNA连接酶,购自Takara公司;Tris-平衡酚、溶菌酶、Solarbio凝胶回收试剂盒、Tris碱、EDTA、SDS、EB购自上海Solarbio生物科技公司;北京庄盟质粒小量抽提试剂盒购自北京庄盟国际生物基因科技有限公司。其它试剂为国产分析纯。
1.3 引物 引物序列根据NCBI数据库中Gen-Bank上注册号为AF329367的粪肠球菌致病岛全序列(Enterococcus faecalis putative pathogenicity island,partial sequence;and IS905-like sequence,complete sequence)2 699~3 937bp处的CylA基因序列,通过 Primer Primier5.6.0和 Oligo 6.71 Demo引物设计软件,设计扩增引物两对(F1、R1和F2、R2)。并分别在扩增引物的上、下游5'端加入序列为EcoRⅠ和XhoⅠ酶切位点(用斜体加下划线表示)。引物由大连宝生物有限公司合成。
引物序列为:

1.4 方法
1.4.1 CylA基因的PCR扩增 按照参考文献19记载的方法分别提取4株致鹅败血症粪肠球菌总DNA[19]。参照表1、表2的反应体系和反应条件进行PCR扩增。

表1 CylA基因的PCR反应体系Tab.1 PCR reaction system of CylA gene
表2 CylA基因的PCR反应条件Tab.2 PCR reaction condition of CylA gene
1.4.2 PCR产物的克隆和筛选 用0.8%琼脂糖凝胶电泳对PCR产物做分离和检测分析。分离后,切下含目的DNA片段的条带,按Solarbio凝胶回收试剂盒操作说明对其进行回收。参照大连宝生物有限公司pMD18-T载体说明书,将PCR产物(目的片段CylA)与pMD18-T载体连接,转化进入大肠杆菌DH5α中,挑取白色阳性菌落进行EcoRI、XhoI双酶切鉴定(反应体系见表3)。加入上述成分后,瞬间离心混匀,37℃反应1.5h,用0.8%琼脂糖凝胶电泳分离。
1.4.3 核苷酸序列测定和分析 将鉴定正确的重组质粒送大连宝生物有限公司进行测序,以双向碱基互补的测定结果为准。用Lasergene 7.0软件中的EditSeq寻找阅读框,用MegAlign程序中的Jotun Hein方法,对测定的CylA基因序列与Gen-Bank登陆的国外从人体分离的和国内从猪体分离的各4株致病性粪肠球菌CylA基因[12],进行核苷酸序列及推导的氨基酸序列同源性比对(参比序列见表4),并构建系统进化发育树。

表3 pMD18-T-CylA双酶切反应体系Tab.3 Reaction system of double enzyme digestion for pMD18-T-CylA
表4 参与比对的序列Tab.4 The sequence for alignment
2 结 果
2.1 溶血素CylA基因PCR扩增和重组质粒双酶切鉴定结果 用引物F1、R1、F2、R2扩增的4株致鹅败血症粪肠球菌CylA基因片段,经0.8%琼脂糖凝胶电泳检测,4个条带均长约1 239bp,与预期和参考菌株ATCC29212CylA基因相符,蒸馏水阴性对照没有特异性条带(图1)。
重组质粒pMD18-T-CylA EcoRI、XhoI双酶切鉴定结果显示,重组质粒中含有1 239bp的PCR产物的目的外源片段,2 692bp的条带为质粒载体(图2)。
2.2 CylA基因序列测定结果及分析 重组质粒测序结果表明,4株致鹅败血症粪肠球菌CylA基因序列均长1 239bp,用EditSeq寻找结果显示,均为一完整的开放阅读框,编码412个氨基酸。
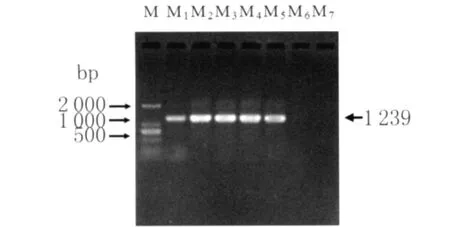
图1 CylA基因PCR扩增结果M:Marker DL2000;M1:参考菌株ATCC29212阳性对照;M2:ME1扩增产物;M3:ME2 扩增产物;M4:ME3扩增产物;M5:ME4扩增产物;M6:蒸馏水阴性对照;M7:大肠杆菌阴性对照Fig.1 Result of PCR for CylA geneM:DL2000DNA Marker;M1:Positive control of reference strains ATCC29212;M2:Product of ME1;M3:Product of ME2;M4:Product of ME3;M5:Product of ME4;M6:Negative control of distilled water;M7:Negative control of Escherichia Coli
2.2.1 CylA基因序列和推导的氨基酸序列的变异
表5为鹅源、人源和猪源致病性粪肠球菌CylA基因相关序列及推导的氨基酸序列,用MegAlign中Jotun Hein方法进行比对的结果。比对结果显示,ME1-ME4CylA基因序列无缺失和插入,仅666 bp碱基由T突变为C,这一突变发生在密码子第3个核苷酸上,是无义突变,未引起其编码的222位氨基酸变异。与其相同的是猪源的HE9,核苷酸、推导的氨基酸均未变异。变异程度相近的有猪源的HE12、HE1,人 源 的 AF329367、AF454824、AY032999以及L37110。而猪源的HE30变异程度稍大(表5)。
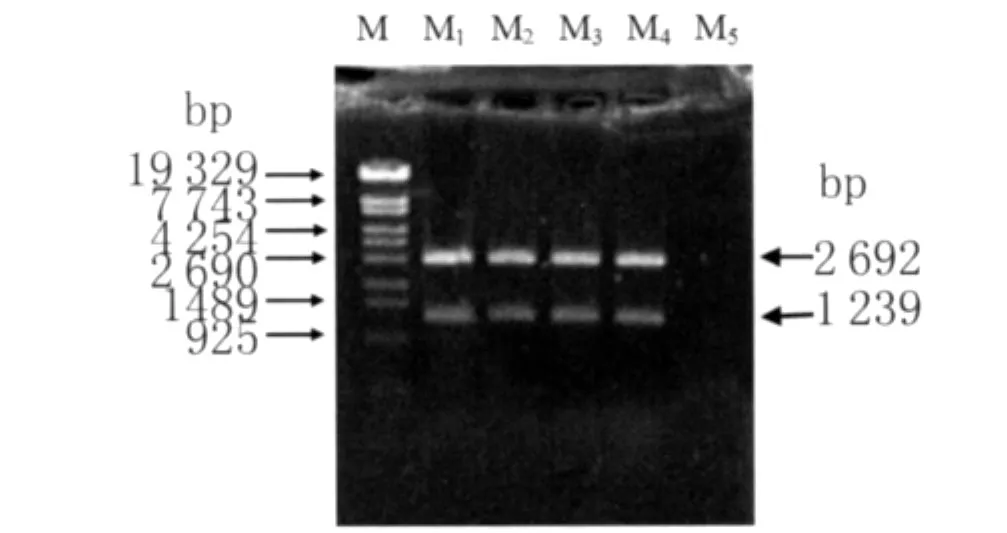
图2 重组质粒pMD18-T-CylA双酶切鉴定凝胶电泳结果M:Markerλ-EcoT14Ⅰdigest;M1:ME1酶切产物;M2:ME2酶切产物;M3:ME3酶切产物;M4:ME4酶切产物;M5:蒸馏水阴性对照Fig.2 Result of detection with double enzyme digestion for recombinant plasmid pMD18-T-CylAM:Markerλ-EcoT14Ⅰdigest;M1:Product of ME1;M2:Product of ME2;M3:Product of ME3;M4:Product of ME4;M5:Negative control of distilled water

表5 CylA核苷酸及推导的氨基酸变异比较Tab.5 Comparison on variation of nucleotide and deduced amino acid for CylA
2.2.2 CylA基因推导的氨基酸序列同源性分析用Lasergene 7.0软件中MegAlign绘制的鹅源、人源和猪源致病性粪肠球菌CylA基因推导的氨基酸序列系统进化发育树见图3,同源性分析结果见图4。

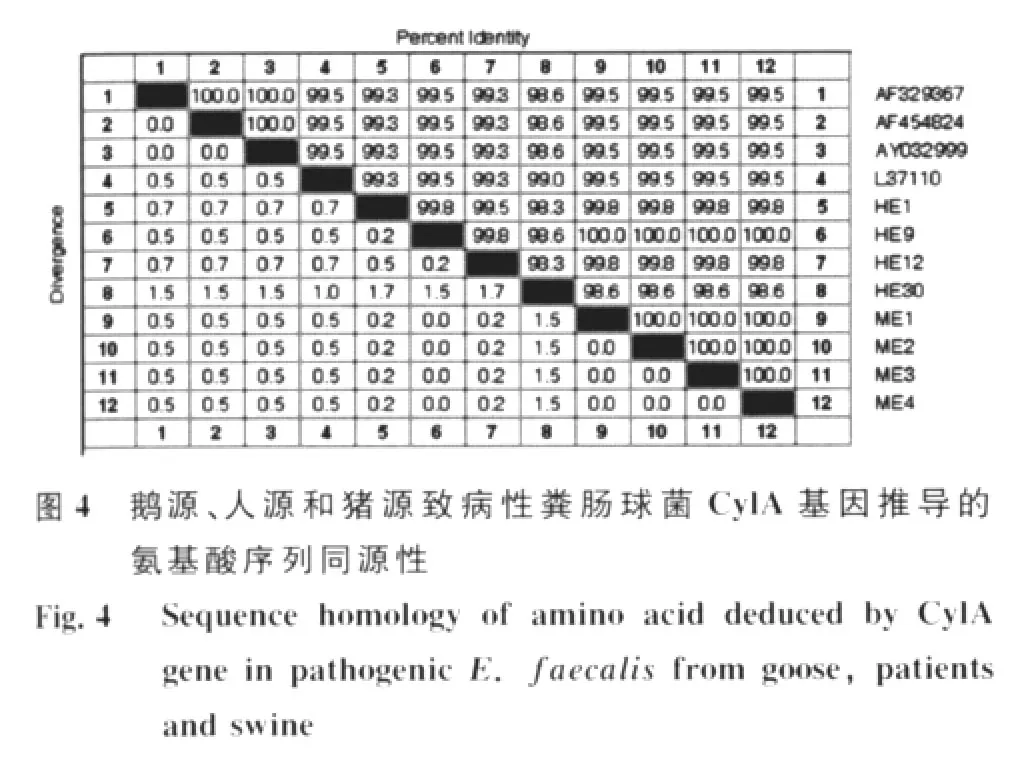
应用 Lasergene 7.0-MegAlign中Jotun Hein方法构建的推导的氨基酸序列系统进化发育树显示,参与比对的12株细菌的CylA基因推导的氨基酸序列来源于共同的祖先。ME1-ME4及HE9支长相等,同源性为100%;ME1-ME4与 HE1、HE12的遗传距离最近,处于同一小分支,同源性为99.8%;与 AF454824、AY032999、AF329367的遗传距离很近,处于同一个节点的不同小分支,同源性为99.5%;与L37110和HE30的遗传距离也很近,虽然处于不同分支,但同源性也较高,分别是99.5%和98.6%。
3 讨 论
3.1 本试验使用的致病菌,是由本实验室通过分离纯化和形态学观察、菌属区别和分群试验,经过亚碲酸盐和丙酮酸盐利用试验、依罗霉素敏感试验、甲基葡萄糖吡喃糖苷产酸试验和色素产生试验等鉴定粪肠球菌的关键性试验,最后采用16SrDNA测定这一目前种间关系相近的细菌菌种鉴定和分类的标准方法[20],鉴定为粪肠球菌的菌株。该菌株分离自表现实质脏器肿大、淤血、出血、坏死和渗出纤维素等败血症变化的雏鹅,并且在试验中该菌株具有β-溶血和使实验动物发生败血症的特性,表明该粪肠球菌菌株是雏鹅败血症的病原。目前国内未见粪肠球菌致鹅败血症的报道,因此,分离菌株是雏鹅败血症一个新病原。由于人和动物感染粪肠球菌发病和死亡的报道越来越多,该分离菌株有可能是新的人畜共患病病原体。
3.2 Cyl是粪肠球菌的主要致病物质,它能溶解动物细胞,加重感染程度,提高细菌致死能力;其毒性及致死能力远高于其它毒力因子。Cyl表达后经修饰生成无活性的结构蛋白中间产物,必须经CylA激活才具有溶细胞活性。因此CylA的激活作用是粪肠球菌致病性的标志。本试验成功克隆了4株致鹅败血症粪肠球菌溶血素CylA基因,证明分离的粪肠球菌具有致病性;同时,为在原核细胞中表达该基因和进行其功能研究奠定了基础。
3.3 试验结果显示,参比的鹅源、人源、猪源致病性粪肠球菌CylA基因具有如下特点:序列无缺失和插入;ME1~ME4仅有一处核苷酸发生无义突变但未引起氨基酸变异;其余参比序列的变异率也很低,为0%~0.48%,个别为1.45%;系统进化发育树上遗传距离很近;人源菌、猪源菌与鹅源菌相比,具有高达98.6%~100%的同源性。这些特点证明了Phillp S.Coburn等关于粪肠球菌CylA基因高度保守的论述[21],提示CylA有可能成为多种动物粪肠球菌性疾病的诊断及保护性抗原的候选基因。
[1]Freitas AR,Tedim AP,Novais C,et al.Global spread of the hyl(Efm)colonization virulence gene in megaplasmids of the Enterococcus faecium CC17polyclonal subcluster[J].Antimicrob Agents Chemother,2010,54(6):2660-2665.DOI:10.1128/AAC.00134-10
[2]Tendolkar PM,Baghdayan AS,Shankar N.Pathogenic enterococci:new developments in the 21stcentury[J].CMLS Cell Mol Life Sci,2003,60(12):2622-2636.DOI:10.1007/s00018-003-3138-0
[3]Sepulveda M,Bello H,Ruiz M,et al.Classic and molecular methodologies for the identification of Enterococcus species[J].Rev Med Chil,2002,130(1):45-49.
[4]Graham JP,Lance BP,Evans SL,et al.Antibiotic resistant enterococci and staphylococci isolated from flies collected near confined poultry feeding operations[J].Sci Total Environ,2009,407(8):2701-2710.DOI:10.1016/j.scitotenv.2008.11.056
[5]Lu HZ,Weng XH,Li HJ,et al.Enterococcus faecium-related outbreak with molecular evidence of transmission from pigs to humans[J].J Clin Microbiol,2002,40(3):913-917.DOI:10.1128/JCM.40.3.913-917.2002
[6]Qi JW,Yu CY,Yan MM,et al.The diagnosis and treatment report of chick death causing by Enterococcus casseliflavu[J].Chin Poul,2006,28(19):88-90.(in Chinese)齐景文,于长泳,闫明媚,等.铅黄肠球菌引起雏鸡发病死亡的诊治报告[J].中国家禽,2006,28(19):88-90.
[7]Qi YY,Yan GQ,Wang JM,et al.Isolation and identification of Enterococcus faecalis in lambs with meningitis[J].J Shihezi Univ(Nat Sci),2005,23(2):200-202.(in Chinese)齐亚银,剡根强,王静梅,等.致羔羊脑炎型粪肠球菌的分离及鉴定[J].石河子大学学报,2005,23(2):200-202.
[8]Larsen J,Schoheyder HC,Lester CH,et al.Porcine-origin gentamicin resistant Enterococcus faecalis in humans,Denmark[J].Emerg Infect Dis,2010,16(4):682-684.DOI:10.3201/eid1604.090500
[9]Shankar N,Baghdayan AS,Willems R.Presence of pathogenicity island genes in Enterococcus faecalis isolates from pigs in Denmark[J].J Clin Microbiol,2006,44(11):4200-4203.DOI:10.1128/JCM.01218-06
[10]Zhou X.The finding of lamb encephalitis induced by Enterococcus and studies on its pathogenic characteristics and diagnosis method[D].Ya’an:Sichuan Agriculture University,2007:89.(in Chinese)周霞,肠球菌性羔羊脑炎的发现及其病原特性和诊断方法研究[D].雅安:四川农业大学,2007:89.
[11]Shan JH,Yuan QH.Investigate of one food poisoning causing by Enterococcus faecalis[J].Practi Pre Med,2001,8(5):394.(in Chinese)单金华,袁钦华.一起粪肠球菌食物中毒的调查[J].实用预防医学,2001,8(5):394.
[12]Liu L.Pathogenic mechanism and prokaryotic expression of hemolysin CylA gene from swine-infected Enterococcus[D].Zhengzhou:Henan Agriculture University.2009:16-17.(in Chinese)刘磊.感染猪的肠球菌致病机制及溶血素CylA基因的原核表达研究[D].郑州:河南农业大学,2009:16-17.
[13]Donabedian SM,ThalL A,Hershberger E,et al.Molecular characterization of gentaxnicin-resistant Enterococciin the United States:evidence of spread from animals to humans through food[J].J Clin Microbiol,2003,41(3):1109-1113.DOI:10.1128/JCM.41.3.1109-1113.2003
[14]Lim SK,Taxumoto K,Tomita H.Pheromone-responsive conjugative vancomycin resistance plasmids in Enterococcus faeca-lis isolates from humans and chicken feces[J].Appl Environ Microbiol,2006,72(10):6544-6553.DOI:10.1128/AEM.00749-06
[15]Ma GJ,Han SJ,Yan GQ,et al.Advance in enterococcal virulence factors[J].Prog Vet Med,2007,28(6):66-69.(in Chinese).马贵军,韩素娟,剡根强,等.肠球菌毒力因子研究进展[J].动物医学进展,2007,28(6):66-69.
[16]Haas W,Gilmore MS.Molecular nature of a novel bacterial toxin:the cytolysin of Enterococcus faecalis[J].Med Microbiol Immunol,1999, 187 (4): 183-190. DOI:10.1007/s004300 050091
[17]Haas W,Shepard BD,Gilmore MS.Two-component regulator of Enterococcus faecalis cytolysin responds to quorum-sensing autoinduction[J].Nature,2002,415(6867):84-87.DOI:10.1038/415084a
[18]Di TT,Gao Y,Nie X,et al.Isolation and identification of Enterococcus faecalis causing geese septicemia[J].Chin J Pre Vet Med,2012,34(3):192-196.(in Chinese)狄婷婷,高原,聂鑫,等.致鹅败血症粪肠球菌的分离鉴定[J].中国预防兽医学报,2012,34(3):192-196.DOI:10.3969/j.issn.1008-0589.2012.03.07
[19]Ausubel FM,Brent R,Kingston RE,et al.In:Jin YX,Bao HZ,Zhao LY,et al(eds).Short protocols in molecular biology[M].5thedition.Beijing:Science Press,2008:55.(in Chinese)[英]F.M.奥斯伯,R.布伦特,R.E.金斯顿,等.精编分子生物学试验指南(第五版)[M].北京:科学出版社,2008:55.
[20]Zhou YY,Rong JR,Bai XM,et al.Gene sequence analysis of 16SrRNA for the use of diagnosis in primary bacterial infections[J].Chin J Zoonoses,2006,22(7):639-642.(in Chinese)周永运,戎建荣,白雪梅,等.16SrRNA基因序列分析用于诊断病原性细菌感染初步研究[J].中国人兽共患病学报,2006,22(7):639-642.
[21]Phillip SC,Lynn EH,Mary CB,et al.A novel means of selfprotection,unrelated to toxin activation,confers immunity to the bactericidal effects of the Enterococcusfaecaliscytolysin[J].Infect Immun,1999,67(7):3339-3347.
