热致死发酵乳杆菌对牛乳β-乳球蛋白过敏小鼠的免疫调节作用①
2012-01-23李艾黎孟祥晨马冬雪
李艾黎 孟祥晨 徐 渐 邵 红 马冬雪
(乳品科学教育部重点实验室 东北农业大学食品学院,哈尔滨150030)
牛乳营养丰富,是婴幼儿重要的食物蛋白来源。但据国外流行病学调查表明,2% ~6%的儿童对牛乳产生过敏反应,严重影响其对优质乳蛋白的吸收利用。β-乳球蛋白(β-lactoglobulin,BLG)被视为最主要的牛乳过敏原蛋白之一,主要诱发特异性IgE抗体介导的Ⅰ型超敏反应,可引起呕吐、腹痛和腹泻等胃肠不适[1,2]。且过敏引起的胃肠道疾病(如婴幼儿结肠炎)常致儿童生长迟缓[3,4]。如何减少 β-乳球蛋白所致牛乳过敏症已成为现代乳制品生产中急待解决的问题。
近年来,许多研究学者希望能借助乳酸菌来有效减缓过敏反应,并减少药物的使用量[5-7]。因为许多乳酸菌在肠道中能通过平衡细胞和体液免疫应答,使免疫系统处于健康稳定状态。本研究在前期试验中亦发现活的乳杆菌具有抑制牛乳β-乳球蛋白过敏反应的效果,但对灭活的乳酸菌是否具有与活菌相似的免疫学效应尚不清楚。
基于乳酸菌与抑制食物过敏的发生、发展之间的紧密联系,本研究构建牛乳β-乳球蛋白过敏小鼠模型,分析热致死的发酵乳杆菌对致敏小鼠Th1/Th2细胞动态平衡、CD4+/CD8+比值和过敏标志性抗体表达的影响,为进一步确定乳酸菌抗牛乳过敏的作用与机制提供理论依据。
1 材料与方法
1.1材料
1.1.1实验菌株 发酵乳杆菌KLDS 1.0740由东北农业大学乳品科学教育部重点实验室分离保存。
1.1.2实验动物 雌性清洁级 BALB/c小鼠,6~8周龄,购自哈尔滨肿瘤医院实验动物中心。饲养环境温度 (23±2)℃,湿度50% ~75%,标准小鼠饲料喂养。
1.1.3主要试剂 乳清粉(新西兰进口);BCA试剂盒 (中国 Beyotime 公司);IL-12、IFN-γ、IL-4 ELISA试剂盒(美国R&D公司)、总IgE试剂盒(美国bethyl公司)、羊抗鼠 IgE酶标二抗(英国 AbD Serotec公司)、羊抗鼠IgG酶标二抗(中国中杉金桥公司)、RPMI1640培养液(美国 Gibco公司)、胎牛血清(杭州四季青生物工程材料公司)、淋巴细胞分离液(Salarbio公司)、牛乳β-乳球蛋白标品和弗氏完全佐剂(FCA,Sigma公司);FITC-抗小鼠CD3抗体、PE抗小鼠CD4抗体、PEcy5抗小鼠CD8抗体(eBioscience公司)等。
1.2方法
1.2.1菌株的活化与菌悬液的制备 发酵乳杆菌接种于MRS液体培养基中,37℃培养18小时后4 000 r/min、10分钟离心收集菌体,用灭菌0.01 mol/L、pH7.4 PBS离心洗涤重悬,调整菌悬液浓度约为2×1010cfu/ml,经100℃ 30分钟热处理后(检验证实无活菌存在,且仍保持正常细菌形态),冷冻干燥保存备用。
1.2.2牛乳β-乳球蛋白的制备[8]以乳清粉为原料,采取高盐低pH法分离纯化β-乳球蛋白。透析除盐后冻成干粉备用,SDS-PAGE电泳鉴定蛋白纯度,BCA蛋白浓度测定试剂盒(增强型)测定β-乳球蛋白浓度。
1.2.3动物模型建立[9]将BALB/c小鼠随机分组(每组8只),即空白组、致敏组和热致死的发酵乳杆菌组。自第1天起,发酵乳杆菌组小鼠灌胃低、中、高剂量(0.2、1.0、5.0 μg)菌液 0.1 ml/(天·只),共28天,空白组同时以等量生理盐水灌胃。致敏组和发酵乳杆菌组小鼠在第7天、第21天、第28天给予腹腔注射0.2 ml 0.5 mg/ml过敏原(1 ml弗氏佐剂+1 ml 1 mg/ml BLG),空白组小鼠腹腔注射等量生理盐水。于实验的第30天,即末次腹腔注射48小时后检测指标。
1.2.4ELISA法检测细胞因子[10]无菌取小鼠脾脏,用玻璃针芯在200目筛网上研磨后,加入到RPMI1640培养液中制成单细胞悬液。加入淋巴细胞分离液进行离心,分离出淋巴细胞,再用RPMI1640培养液洗涤(4 000 r/min)2次。调细胞密度为2×106个/ml。将细胞与含有100 ml/L小牛血清的RPMI1640培养基及BLG(终浓度1 g/L)加入到96孔培养板中,每孔总体积200 μl,每组设3个重复(n=3)。在37℃,50 ml/L CO2培养箱饱和湿度条件下培养48小时后,离心收集上清。严格按照各ELISA试剂盒说明书进行操作,在波长450 nm处用酶标仪测定各孔的吸光度(A)值,从相应的标准曲线查得各样品的 IL-12、IFN-γ、IL-4浓度。
1.2.5ELISA法检测抗体水平[11]摘除小鼠眼球放血,离心后吸取血清,严格按照各试剂盒说明书检测小鼠血清中总IgE、BLG特异性IgE和总IgG浓度。
1.2.6流式细胞仪检测T细胞亚群[12]无菌取小鼠脾脏组织研碎制成细胞悬液,将细胞浓度调至2×106个/ml,分别与 FITC 标记的抗 CD3+、PE 标记的抗CD4+、PEcy5标记的抗CD8+单克隆抗体反应(4℃,30分钟)。PBS缓冲液清洗后,细胞悬浮于PBS缓冲液中,通过流式细胞仪检测其表面抗原分子的表达情况。
1.3数据处理 实验数据采用SPSS11.0软件进行统计分析,各组定量检测数据以±s表示,组间比较进行单因素方差分析(One-way ANOVA),以P<0.05为差异有显著性。
2 结果
2.1发酵乳杆菌对致敏小鼠Th1/Th2细胞平衡的影响 由于Th1、Th2细胞的比例同 IFN-γ和 IL-4的分泌水平密切相关,故本实验以IFN-γ/IL-4比值为代表研究乳酸菌对淋巴细胞Th1/Th2平衡的影响。如表1结果所示,与致敏组相比,不同剂量发酵乳杆菌组小鼠的IL-4质量浓度显著下降(P<0.05),而IFN-γ分泌值明显增高(P<0.05)。由于发酵乳杆菌中、高剂量组比发酵乳杆菌低剂量组更明显地促进了IFN-γ的分泌(P<0.05),使其IFN-γ/IL-4比值显著高于空白组和致敏组(P<0.05)。
表1 发酵乳杆菌干预对BLG致敏小鼠Th1/Th2细胞平衡的影响(pg/ml,±s,n=3)Tab.1 Effect of L.fermentum on the Th1/Th2 cell balance in BLG-immunized mice(pg/ml,x— ± s,n=3)
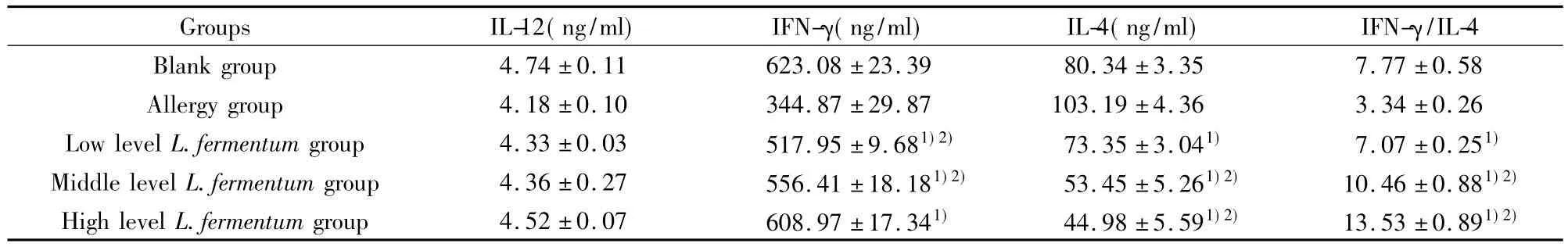
表1 发酵乳杆菌干预对BLG致敏小鼠Th1/Th2细胞平衡的影响(pg/ml,±s,n=3)Tab.1 Effect of L.fermentum on the Th1/Th2 cell balance in BLG-immunized mice(pg/ml,x— ± s,n=3)
Note:One-way ANOVA,statistically significant difference:1)P<0.05 vs allergy group;2)P<0.05 vs blank group.
Groups IL-12(ng/ml) IFN-γ(ng/ml) IL-4(ng/ml) IFN-γ/IL-4 Blank group 4.74±0.11 623.08±23.39 80.34±3.35 7.77±0.58 Allergy group 4.18±0.10 344.87±29.87 103.19±4.36 3.34±0.26 Low level L.fermentum group 4.33±0.03 517.95±9.681)2) 73.35±3.041) 7.07±0.251)Middle level L.fermentum group 4.36±0.27 556.41±18.181)2) 53.45±5.261)2) 10.46±0.881)2)High level L.fermentum group 4.52±0.07 608.97±17.341) 44.98±5.591)2) 13.53±0.891)2)
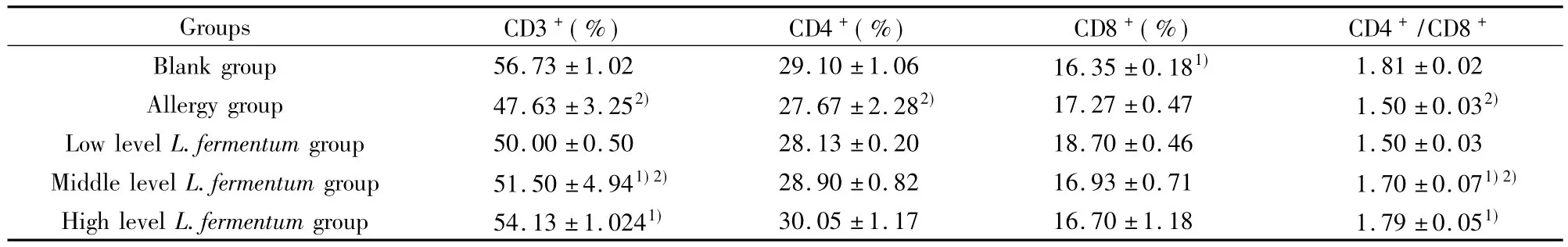
表2 发酵乳杆菌干预对BLG致敏小鼠淋巴细胞亚群的影响Tab.2 Effect of L.fermentum on the lymphocyte subgroups in BLG-immunized mice

图1 发酵乳杆菌干预对BLG致敏小鼠血清中总IgE(A)、BLG特异性IgE(B)和总IgG(C)抗体含量的影响Fig.1 Effect of L.fermentum on the serum levels of total IgE(A),BLG-specific IgE(B)and total IgG(C)in BLG-immunized mice
2.2发酵乳杆菌对致敏小鼠抗体分泌的影响 如图1结果所示,BLG能够诱导小鼠总IgE、BLG特异性IgE和总IgG水平升高,且显著高于空白组(P<0.05)。与致敏组相比,不同剂量发酵乳杆菌组均可显著降低致敏淋巴细胞上清液中各抗体的含量(P<0.05)。而中、高剂量发酵乳杆菌组更有效地抑制了总 IgE、BLG特异性 IgE和总 IgG的分泌(P<0.05),且与空白组相比差异不显著(P>0.05)。
2.3发酵乳杆菌对致敏小鼠脾细胞T细胞亚群的影响 如表2结果所示,口服发酵乳杆菌后,致敏组小鼠皮细胞中CD3+、CD4+T细胞数降低,CD4+/CD8+比值减小,与空白组比较差别有统计学意义(P<0.05)。与致敏组比较,经发酵乳杆菌干预后可明显升高致敏小鼠的CD3+T细胞数和CD4+/CD8+比值(P<0.05),特别是口服高剂量发酵乳杆菌后的CD3+T细胞数和CD4+/CD8+比值与空白组相比无显著性差异。
3 讨论
研究者多认为,Th2细胞占优势的Th1/Th2细胞失衡是牛乳过敏发病最重要的免疫学异常[2],即Th2细胞作为介导体液免疫的重要细胞,其数量增加、功能亢进的最终结果是诱导B细胞产生高水平的IgE应答和嗜酸性粒细胞活化,并引起组胺、白三烯等多种炎性介质释放,导致过敏反应发生。
以往研究表明,乳杆菌细胞壁组分可以作为一种主要的病原相关分子模式(Pathogen-associated molecular patterns,PAMP)[13],例 如 未 甲 基 化 的CpG、肽聚糖(PG)和脂磷壁酸(LTA)等,它们被肠上皮细胞或树突状细胞(Dendritic cells,DCs)上的Toll样受体家族(Toll-like receptor,TLRs)识别后,通过TIR区域向胞浆内传导信号,激活NF-κB等转录因子和蛋白激酶[14],释放细胞因子、表达共刺激分子等,从而激活Th0细胞向不同的亚型细胞分化(如Th1、Th2细胞),在天然免疫、炎症反应和获得性免疫中发挥作用。另外,乳杆菌在热致死过程中,菌体的细胞膜壁遭到破坏,也可能释放出细胞内与调节免疫活性相关的活性物质(如菌体蛋白或多糖类物质等)[15]。本研究中口服热灭活的发酵乳杆菌菌液能诱导致敏小鼠淋巴细胞分泌IL-12和IFN-γ,降低IL-4水平,使得IFN-γ/IL-4比值显著升高,促进了Th1型免疫应答,并可能通过逆转Th2细胞过度亢进来阻断IgE的分泌。由此推测,乳杆菌的细胞壁成分、代谢产物、菌体细胞等均有可能刺激机体的肠道粘膜免疫系统,这可能是其抑制过敏发生的机理之一。
目前,IgG抗体在过敏反应中的作用也日益受到重视,但一直存在争议。Durham 等认为[16],IgG抗体与IgE抗体竞争结合抗原,进而抑制肥大细胞和嗜碱性粒细胞激活,从而抑制过敏。Little[17]认为,IgG参与过敏反应。资料表明,虾、花生过敏患者体内IgG水平比正常人显著升高。本实验中4种不同的乳杆菌与空白对照组比较,均可下调总IgG分泌量,该结果提示乳杆菌可能通过下调总IgG的生成量或抑制其合成来缓解过敏反应,但其具体的作用机制还不是很清楚,有待进一步研究。
CD4+、CD8+T细胞对机体的细胞免疫和体液免疫有重要的调节作用。CD4+和CD8+T总量的提高固然重要,但CD4+/CD8+比值保持动态平衡(正常情况下约为2∶1)对稳定机体免疫功能是必需的,在免疫缺陷性疾病时此比值会出现倒置现象。本研究结果显示,过敏组小鼠T细胞亚群改变明显,CD3+T显著低于空白组,CD4+/CD8+比值降低,与文献[18]报道相一致,而发酵乳杆菌干预可提高过敏小鼠脾淋巴细胞中CD3+和CD4+T细胞的比例,优化CD4+/CD8+比值。因此,我们认为通过饲喂发酵乳杆菌能使失调的T细胞亚群恢复平衡,这也可能是其缓解过敏的机制之一。
1 Carlo C,Francesco B,Barbara B et al.Cow's milk protein allergy in children:a practical guide[J].Italian J Pediatrics,2010;36(5):1816-1824.
2 Pasquale M,Giuseppe M,Maria L P.Food allergy in gastroenterologic diseases:Review of literature[J].World J Gastroenterol,2006;12(48):7744-7752.
3 王小卉,杨 毅,王 莹et al.婴儿肠道菌群的形成及其与食物过敏的关系[J].实用儿科临床杂志,2004;19(9):756-758.
4 Romagnani S.The increased prevalence of allergy and the hygiene hypothesis:missing immune deviation,reduced immune suppression,or both? [J].Immunology,2004;112(3):352-363.
5 Flinterman A E,Knol E F,van Ieperen-van Dijk A G et al.Probiotics have a different immunomodulatory potential in vitro versus ex vivo upon oral administration in children with food allergy[J].Allergy Immunol,2007;143(3):237-244.
6 Akiko T,Shinpei T,Shigeru F et al.Lactobacillus Acidophilus strain l-92 regulates the production of Th1 cytokine as well as Th2[J].Cytokines,2007;56(3):293-301.
7 Yumi I,Noriyuki I,Xiao J Z.Suppressive effects of Bifidobacterium breve strain M-16V on T-helper type 2 immune responses in a murine model[J].Biol Pharm Bull,2009;32(4) :760-763.
8 王子龙,林召丰,黄 霞 et al.两种分离β-乳球蛋白方法的比较[J].食品工业科技,2008;29(12):153-154.
9 Segawa S,Nakakita Y,Takata Y et al.Effect of oral administration of heat-killed Lactobacillus brevis SBC8803 on total and ovalbumin-specific immunoglobulin E production through the improvement of Th1/Th2 balance[J].International J Food Microbiology,2008;121(1):1-10.
10 Fujiwara D,Inoue S,Wakabayashi H et al.The anti-allergic effects of lactic acid bacteria are strain dependent and mediated by effects on both Th1/Th2 cytokine expression and balance[J].International Archives of Allergy and Immunology,2004;135(3):205-215.
11 Karine A P,Christophe C,Herve B et al.Evaluation of a high IgE-responder mouse model of allergy to bovine b-lactoglobulin BLG:development of sandwich immunoassays for total and allergen-specific IgE,IgG1and IgG2a in BLG-sensitized mice[J].J Immunol Methods,2000;235(2):21-32.
12 陈莹瑛,李 俊,施 磊et al.玉屏风多糖对佐剂性关节炎大鼠T细胞亚群的影响[J].中国药理学通报,2010;26(5):588-592.
13 余叶红,郭本恒,吴正钧et al.干酪乳杆菌LC2W细胞壁组分对RAW264.7巨噬细胞吞噬活性的影响[J].中国微生态学杂志,2009;21(1):23-29.
14 Guei-Cheng P,Ching-Hsiang H.The efficacy and safety of heat-killed Lactobacillus paracasei for treatment of perennial allergic rhinitis induced by house-dust mite[J].Pediatric Allergy and Immunology,2005;16(5):5433-5438.
15 Segawa S,Hayashi A,Nakakta Y et al.Oral Administration of heatkilled Lactobacillus brevis SBC8803 ameliorates the development of dermatitis and inhibits immunoglobulin E production in atopic dermatitis model NC/Nga mice[J].Pharmaceutical Society of Japan,2008;31(5):884-889.
16 Durhma T.Immunologic changes associated with allergen immunotherapy[J].J Allergy and Clinical Immunology,1998;102(2):157-
164.
17 Little C H,Geogriou G M,Miehael J et al.Production of serum immunoglubulins and T cell antigen binding molecules specific for cow'milk antigen in adults intolerant to cow'milk[J].Immunology and Immunopathology,1998;89(2):160-170.
18 连广琬,赵明奇,李翊泉et al.流式细胞术检测过敏性紫癜患儿外周血调节性T细胞的研究[J].热带医学杂志,2010;10(1):27-30.
