体内组织工程构建小口径人工血管的研究进展
2012-01-19王淑芳郑文婷孔德领
王淑芳,郑文婷,孔德领
(南开大学生命科学学院药物化学生物学国家重点实验室,天津300071)
体内组织工程构建小口径人工血管的研究进展
王淑芳,郑文婷,孔德领
(南开大学生命科学学院药物化学生物学国家重点实验室,天津300071)
小口径血管在临床上有很大需求,但小口径血管再狭窄率很高。体内组织工程是改善小口径血管功能、实现血管再生的有效手段。介绍了小口径人工血管的国内外研究发展动态,详述了作者实验室在构建小口径人工血管方面的设计思路和研究所取得的主要进展。研究包括支架材料结构设计与制备技术,支架材料表面功能化修饰,内皮祖细胞捕捉,血管平滑肌再生,抗凝血和促内皮细胞黏附,血管再生微环境的构建等。最后对小口径人工血管研究尚需解决的科学问题和研究方向进行了讨论。
人工血管;组织工程;支架制备;干细胞捕捉;内皮化;平滑肌再生;细胞外微环境
1 前言
小口径血管在临床上有很大需求,美国心脏协会2010年报道,每年大约有500 000冠状动脉搭桥手术[1],另外超过100万的患者因严重的下肢缺血需要血管移植[2]。在我国每年也有大量需求。但如今在临床上常用的大口径血管材料(ID>6 mm)ePTFE和Daron,如果作为小口径血管材料,再狭窄率很高。在过去的20~30年间,小口径人工血管的研究手段主要是组织工程。对材料表面进行抗凝血修饰,在植入体内之前,在材料表面种植内皮细胞,并借助生物反应器进行组织培养[3]。
然而,组织工程研究方法存在许多局限。在体外构建的小口径血管在植入体内后常常出现内皮细胞层脱落、内皮细胞在短期内被取代、内皮细胞功能不全、血管再狭窄率高等问题。组织工程构建过程需要病人自体细胞的分离、体外扩增、与支架材料一起通过生物反应器长时间培养,发生细菌感染的几率高,构建的组织工程血管不宜储存和运输、成本很高等,临床应用的可操作性较差[4]。血管组织工程的研究开展这么多年来,还没有小口径血管材料的临床实验。因此,需要突破传统的研究思路,寻求一种生产更为简单、临床应用的操作性更强的小口径人工血管的研究方法。
近年来,在组织工程与组织再生领域,越来越多的学者提出“体内组织工程”的思路[5-6]。具体来说,就是强调对支架材料进行活性和功能修饰,使植入的支架材料在体内募集捕捉干细胞,诱导血管新生和干细胞分化与增殖,促进组织的迅速修复和再生,使组织构建在体内完成。与传统组织工程研究手段不同之处,在于没有细胞接种和体外培养,依靠材料调动人体自我康复能力,引导或诱导受损组织/器官再生。因此,体内组织工程材料的主要研究内容,是支架材料的结构设计与加工、材料的活性修饰与组织再生微环境构建。对于小口径人工血管来说,支架材料的结构设计主要考虑材料的力学强度、顺应性、孔结构和生物降解性,对支架材料的活性修饰,除了组织再生微环境修饰,更重要的是表面抗凝血修饰和促内皮细胞黏附的特异性修饰。
2 支架材料结构设计加工及其对血管形成过程的影响
高分子材料的来源、性质和结构设计对血管支架材料至关重要。血管的细胞外基质主要是胶原纳米纤维,因此,采用静电纺丝方法制备血管支架材料能够模拟血管细胞外基质;采用合适的高分子材料和材料复合与加工技术,可以获得力学性能与天然血管相似的血管支架。
2.1 材料的选择与制备
在制备人工血管时选择高分子材料主要考虑材料的力学性质、生物相容性和可降解性。胶原、壳聚糖、纤维素、明胶、透明质酸等天然高分子生物相容性好,但是力学强度较差。聚已内酯(PCL),聚乳酸(PLA或PLLA),聚羟基乙酸(PGA)等合成高分子及其共聚物PLGA,PLCL等,力学性质和降解性可以控制,但是普遍缺少生物活性,需要进行生物功能化修饰。多年来PCL在人工血管及其它支架材料中应用普遍,它具有良好的生物相容性和力学性能。作为血管材料它的不足之处是降解太慢,对血管再生构成障碍。需要选择更合适的高分子材料,或者采取不同高分子材料的复合,解决支架材料的力学强度、降解速率与组织再生进程的平衡关系。
还有一类可降解高分子材料,近年来特别受关注,它们是通过生物途径合成的聚合物,其中,最具代表性的是聚羟基脂肪酸酯PHA类材料。其中一个成功的例子是PLA/PHBHHx复合体系。PLA具有较高的力学强度、良好的降解性和加工性。但最大的缺点是脆性较高;而聚3-羟基丁酸-3-羟基己酸(PHBHHx)是PHA系列聚合物的一个新品种,由于具有较长的侧链,其结晶度较低,是一种“软而韧”的聚合物,而且,PHBHHx体外降解速率较慢。研究表明,这两种聚合物在力学性能和生物降解性等方面具有很大的互补性,在某些比例条件(如80/20或20/80)下形成微相分离结构(如图1),材料综合性能良好[7]。利用该材料构建人工血管的研究正在进行中。
近年来,一些研究组潜心研究新型抗凝血组织工程材料。袁直等将乳酸与苹果酸共聚形成PLMA,再用多肽GRGDS修饰,形成含RGD多肽的高分子PGS5,研究了其抗凝血性,结果显示PGS5抗凝血性良好(如图2),有潜力用于血管组织工程[8]。
2.2 静电纺丝制备超细纤维多孔支架材料
人工血管要满足一定的抗张强度,最重要的是需要具备连通性的孔结构,利于细胞迁移和各种生物活性分子的传递。常用的制备方法有盐析、气体发泡和相分离等。但是,静电纺丝技术更适合人工血管的制备。这是因为电纺丝技术制备的三维纤维结构与天然细胞外基质(ECM)很相似。纤维直径可以从几十纳米到几微米,同时具有孔隙率高、比表面积大、孔径分布较宽的特点。电纺丝制得的无纺布,是由不同取向的纤维堆积而成,纤维之间是疏松的。当细胞黏附到纤维表面时,可以推动周围的纤维以扩展空间,从而提高材料的细胞渗透性,有利于细胞的侵入生长。
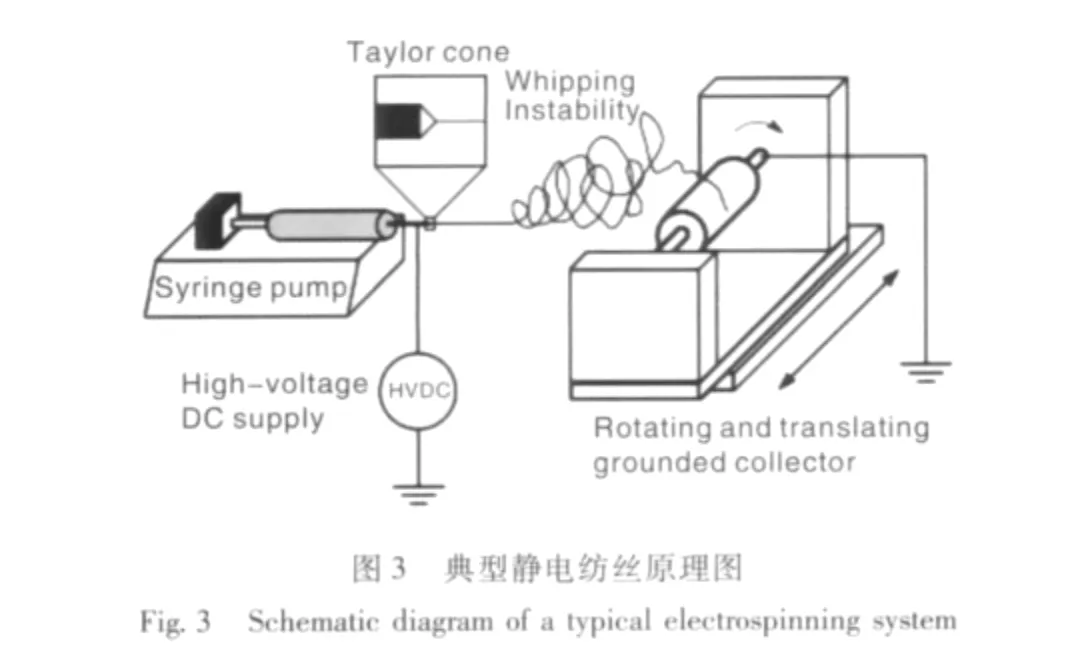
静电纺丝,简称电纺,是用高压电源将一种极性的电荷引入聚合物溶液或熔体中,然后,聚合物溶液或熔体向带有异性电荷的收集器加速。随着溶液(或熔体)与收集器所带的异性电荷之间的静电引力以及溶液内部同种电荷之间的静电排斥作用的增强,溶液最前端的液面将由圆形新月面变成圆锥(称为Taylor锥)。当电场强度超过液体表面张力时,会从Taylor锥喷射出纤维。纤维穿过周围环境,溶剂蒸发,然后固体聚合物纤维在收集器上沉积,形成无纺纤维毡结构。利用这种方法制成的纤维其直径一般在几微米到几十纳米之间(如图3)[9]。
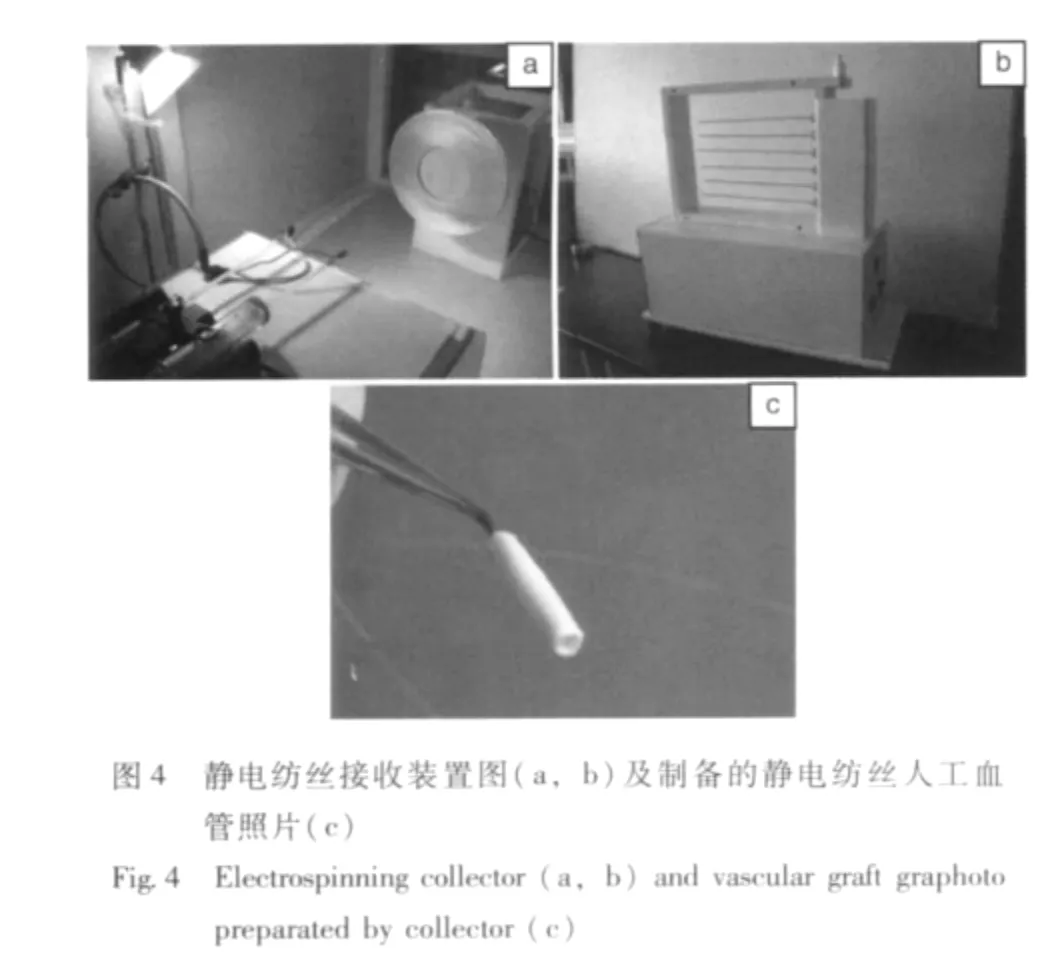
在制备人工血管时,往往需要对两种高分子材料进行复合。从同一方向电纺的两种高分子纤维由于同种电荷排斥作用,在接收器上不能均匀混合。采用图4a的转动盘作为接收器,可以得到两种高分子纤维均匀混合的静电纺丝膜。采用图4b接收装置,可以加工静电纺丝人工血管(图4c)。图4b的每根水平接收杆是转动的,接收杆直径可以根据血管的内径需要进行调换。当使用两种高分子加工血管时,高分子溶液从接收器两侧电纺,可实现两种高分子纤维的均匀混合[10-11]。
2.3 通过加工工艺设计,制备有利于细胞向内迁移的大孔支架材料
作者实验室一直以来,采用静电纺丝PCL支架作为小口径人工血管,但是,PCL纤维直径小,纤维之间孔径往往小于10 μm,在体外细胞培养和体内埋植实验中,细胞很难迁移到支架内部,在血管移植实验中,血管平滑肌再生困难,形成的平滑肌组织层位于支架表面上方,不在支架内部[12]。近来开始尝试通过水溶性高分子PEO进行致孔,制备结构疏松的PCL静电纺丝血管。PEO致孔显著改善了PCL静电纺丝膜材料的孔径和疏松程度,改善了细胞向支架材料内部的迁移。
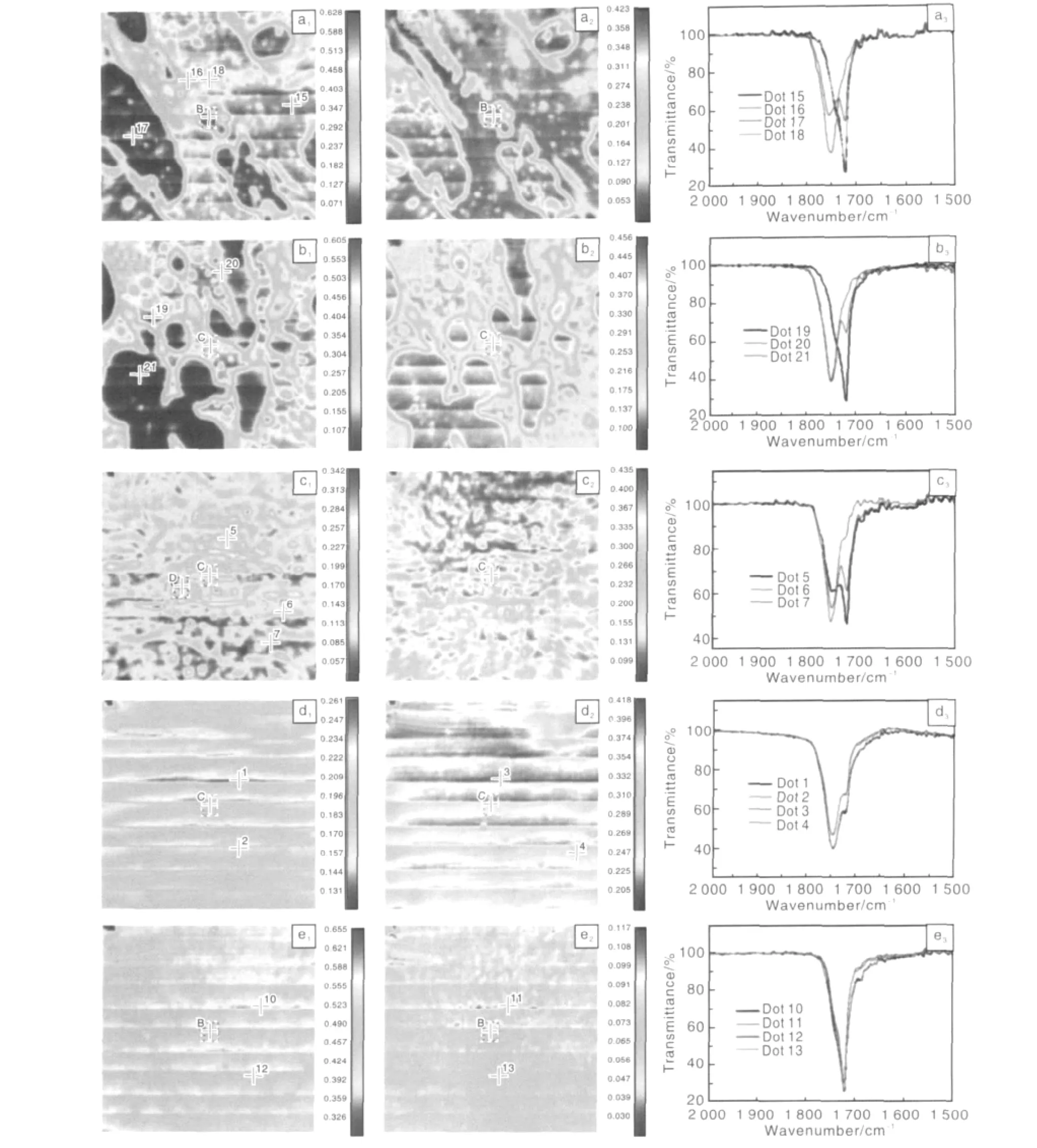
图1 不同比例的PLA/PHBHHx的显微红外照片及相应的谱图Fig.1 FTIR-microscopic images for PLA/PHBHHx blends with various ratio and corresponding to spectra for labeled dots:(a1~a3)PLA/PHBHHx(40/60),(b1~b3)PLA/PHBHHx(50/50),(c1~c3)PLA/PHBHHx(60/40),(d1~d3)PLA/PHBHHx(80/20),and(e1~e3)PLA/PHBHHx(20/80))

图2 高分子上黏附血小板的SEM照片Fig.2 SEM images of adherent platelets on bare polymers:(a)PDLLA,(b)PLMA,(c)P-GS5,and(a’~c’)magnified images of(a~c)
在静电纺丝的同时,向纤维内部喷入水溶性PEO微球,最后将微球溶解掉,产生需要的孔结构。图5显示的是采用PEO致孔的PCL静电纺丝膜。PEO溶液在电喷条件下形成直径可调的微球,均匀混合在PCL纤维中间。将PEO微球洗掉以后,形成结构更加疏松的支架材料。
静电纺丝支架的不足之处是孔径偏小,不利于细胞的迁移和向内生长。研究人员尝试各种静电纺丝技术。如混合电纺,将两种材料的纤维均匀地混合在一起,两种高分子具有不同的降解速率,随着其中一种纤维的快速降解,可以提供更多的细胞生长空间。如PCL和明胶复合材料,通过控制两种高分子溶液的浓度、流速和接触距离,来控制两种纤维的直径和含量比例。对纺丝膜进行后交联,可调节明胶的溶解和降解速率。静电纺丝前将明胶和PCL分别用FITC和罗丹明B染色,用共聚焦显微镜观察两种颜色纤维的直径、分布和混合程度。如图6所示,两种纤维能够均匀混合形成组成均匀的材料。
最近有文献报道疏松静电纺丝支架的制备技术。作者在管状接收器上钻孔,将接收管与高压气体钢瓶连接(如图7),在静电纺丝过程中调节气流压力,可以产生结构疏松的既有足够力学性质,又有良好细胞穿透效果的支架材料[13]。
以往的大量研究表明,血管移植后内皮形成在几周内完成,但是,平滑肌再生却困难得多。如果植入的人工血管不能形成有功能的平滑肌,血管缺乏收缩和舒张功能,势必影响血管内皮的功能。血管内皮会发生老化,血管壁发生钙化,血管变硬、变脆,最终导致动脉粥样硬化、新内膜增生、血栓形成等。

图5 静电纺丝支架材料表面的SEM像:(a)传统静电纺丝制备的PCL膜材料,SEM显示其纤维结构致密,孔径较小,(b)静电纺丝PCL的同时,电喷PEO微米球所得到的复合支架材料,纤维与球的结合良好,且球的分布均匀,(c)通过梯度酒精脱水,将(b)中的PEO微米球洗去,进行冷冻干燥得到只含有PCL纤维的3D膜材料,与(a)相比其纤维结构疏松,孔径增大Fig.5 SEM images of surface of scaffolds:(a)PCL membrane produced by traditional electrospinning,SEM showing fibers compact structure and small pore,(b)PCL-PEO composite scaffolds produced by electrospinning PCL and electrospraying PEO microparticles at the same time,SEM images showed uniform distribution of PEO microparticles,PCL fibers excessively combined with PEO microparticles,(c)3D PCL of PEO microparticle removed by gradient alcohol to water and then dehydrated with -20℃ and frozen dryly,SEM images showed scaffolds of loose structure compared with TS PCL scaffolds and pore diameter in 3D PCL scaffolds more bigger than TS PCL scaffolds(a)

图6 明胶与PCL共纺纤维的共聚焦像:明胶纤维和PCL纤维Fig.6 Confocal images of fluorescence stained fibers blend:gelatin fiber and PCL fiber
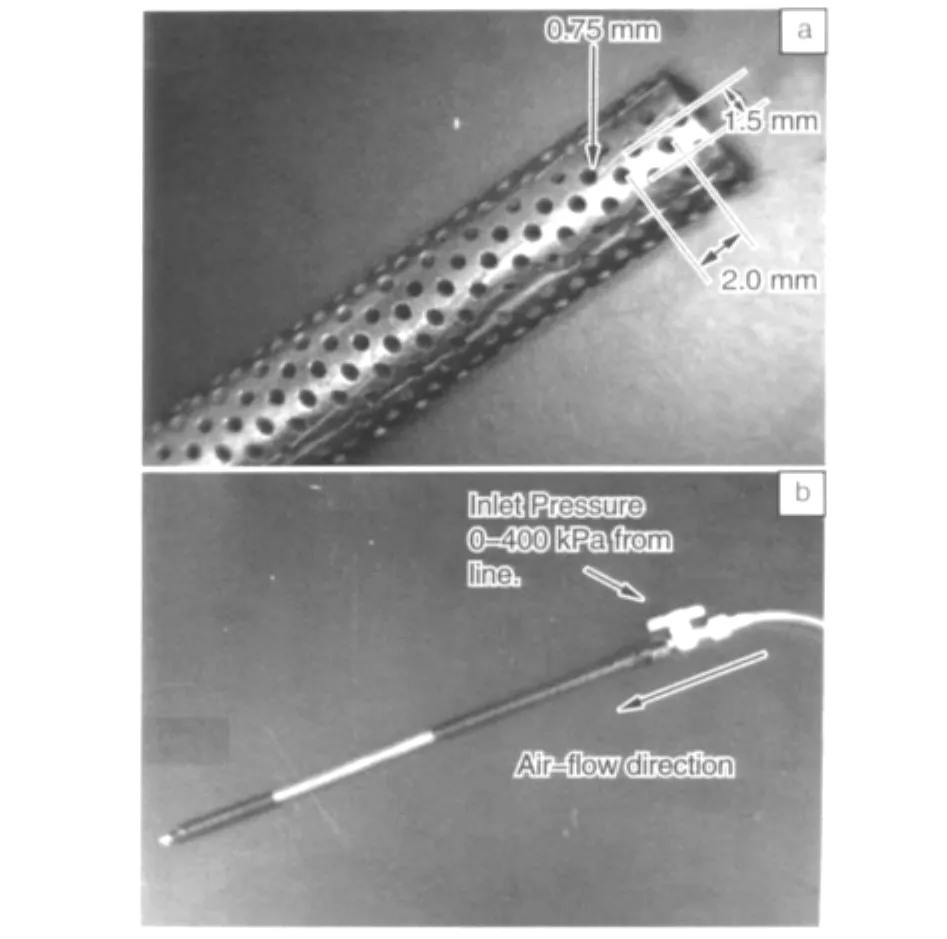
图7 实验所用的穿孔模芯:(a)标注尺寸的模芯,(b)连接有空气流的模芯装置,上方箭头所指处为气流进口压力,下方箭头所示方向为气流方向Fig.7 Images depicting perforated mandrel used in our experiment:(a)mandrel labeled with dimensions,(b)mandrel device connected with air line,above arrow showing location of inlet pressure,and down arrow showing direction of air-flow
瑞士Walpoth实验室对静电纺丝技术制备的聚已内酯(PCL)小口径血管,进行了大鼠腹主动脉长期移植研究[14]。他们发现 PCL具有很好的生物相容性和组织顺应性,即使不做任何修饰,PCL血管的内皮形成在2~4周内完成,18个月以后新内膜增生轻微,血管管腔几乎没有狭窄。然而,他们发现在血管植入大鼠体内1.5个月后出现一些软骨样细胞。12个月后,软骨样细胞继续增多,在18个月时大部分支架呈现钙化。同时发现,迁移进入血管支架内的细胞密度和微小血管密度在6个月时达到最大,在后期细胞和微血管密度反而下降(如图8[14])。这些现象表明,平滑肌再生不完善,血管壁内部没有实现很好的细胞化,支架孔径小,纤维降解慢,小血管密度低,血管壁细胞缺乏足够的营养,是导致后期血管钙化的主要原因。
人工小口径血管移植后,血管的再生过程涉及到细胞重塑,细胞的形态、结构与功能发生改变,也称为表型转化。在正常状态下,血管平滑肌细胞主要表现为收缩型,位于血管壁中层,通过细胞收缩使血管壁维持一定张力。但在动脉粥样硬化、高血压等疾病出现时,血管平滑肌细胞便会发生表型转化,以增殖型为主,在各种刺激因素和生长因子作用下,由中层迁入内膜并大量增殖,导致血管壁增厚。在人工血管移植治疗中,平滑肌细胞将首先表现为增殖型,然后转化为收缩型。
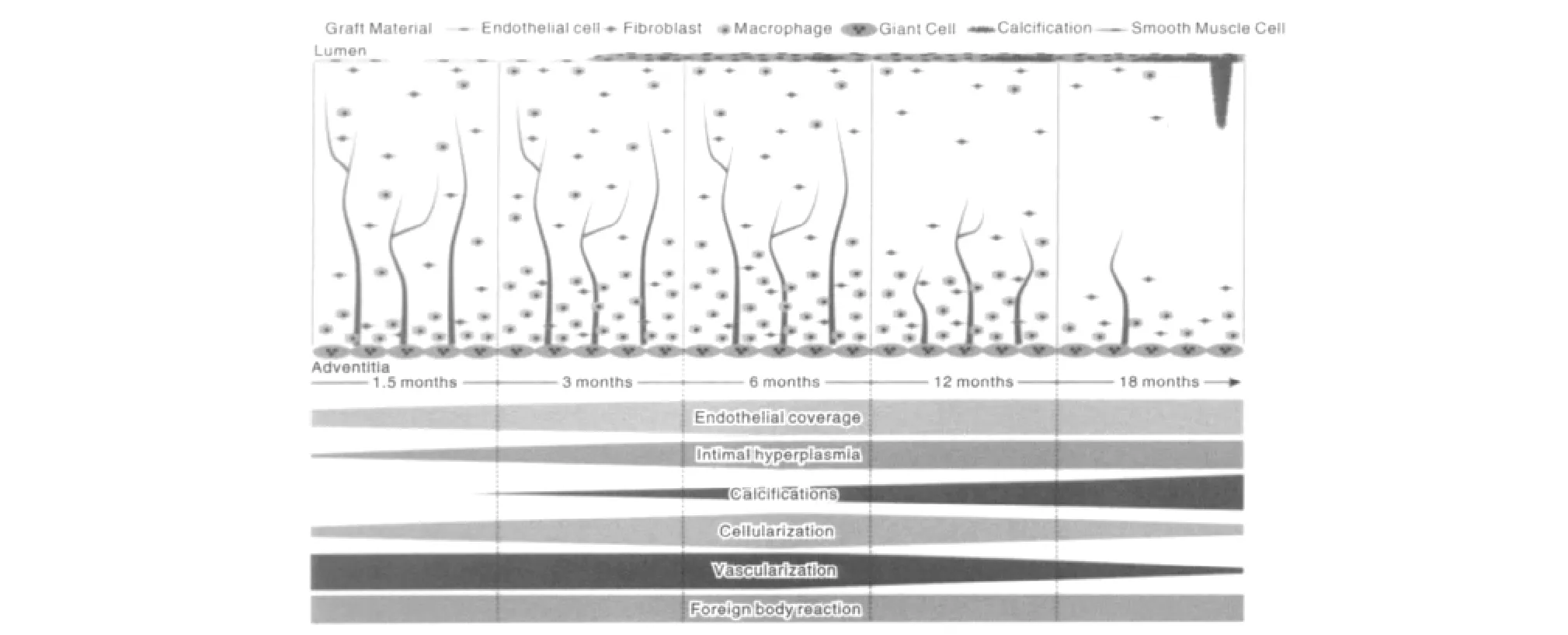
图8 血管壁随时间的生物学响应示意图Fig.8 Schematic representation of biological response in vascular graft wall over time
血管平滑肌再生,可以从人工血管结构设计和活性修饰方面去解决。Guobao Weii等[15]已经将生长因子控释技术与三维静电纺丝支架结合起来,制备出能够稳定控释血小板衍生生长因子(PDGF-BB)的支架。在下一步实验中,他们准备将二者结合起来,进一步研究体外培养平滑肌细胞,形成人工血管的技术手段。Jiang Hu[16]等采用复合相分离与电纺技术构建了含大孔的高孔隙率、3D贯通孔结构 PLLA支架(如图9[16]),并用于人平滑肌细胞的体外培养,诱导平滑肌细胞进行表型转变,起到了良好效果(如图10[16])。他们将人大动脉平滑肌细胞(HASMCs)种植于该管状支架(内径3 mm,外径5 mm,长4 mm)上,体外培养24 h,然后,将其或空白支架(未种植细胞)分别植入裸鼠皮下,2周后取材,进行相应的组织学检测。H&E染色结果表明,实验组与对照组都有组织的形成,这是由于PLLA血管支架的3D多孔结构为组织的形成提供了可能性(图10 a)。马氏染色证实材料周围及其内部分布大量胶原蛋白(图10 c),为形成细胞外基质,加速平滑肌细胞的快速增殖创造了条件。IgG对照的免疫组化染色说明了材料中未发生抗原抗体反应(图10 d),证实了实验组结果的真实性。利用平滑肌细胞-α-肌动蛋白抗体(SM-α-actin)对鼠源的平滑肌细胞着色,发现在材料中有一些平滑肌肌动蛋白的分布(图10 e)。人线粒体抗体对皮下埋植后的材料染色,看到材料内部有线粒体的存在(图10 f),说明平滑肌细胞分化作用的发生。实验结果充分证明了PLLA血管支架特有的3D多孔结构,可以允许体外种植的HASMCs迁移到支架内部,而且有分化作用的发生,同时也有宿主自身细胞的迁移。该研究显示,这种含大孔的高孔隙率、3D贯通孔结构的支架材料,对于细胞向内生长和构建组织工程血管都极为重要。
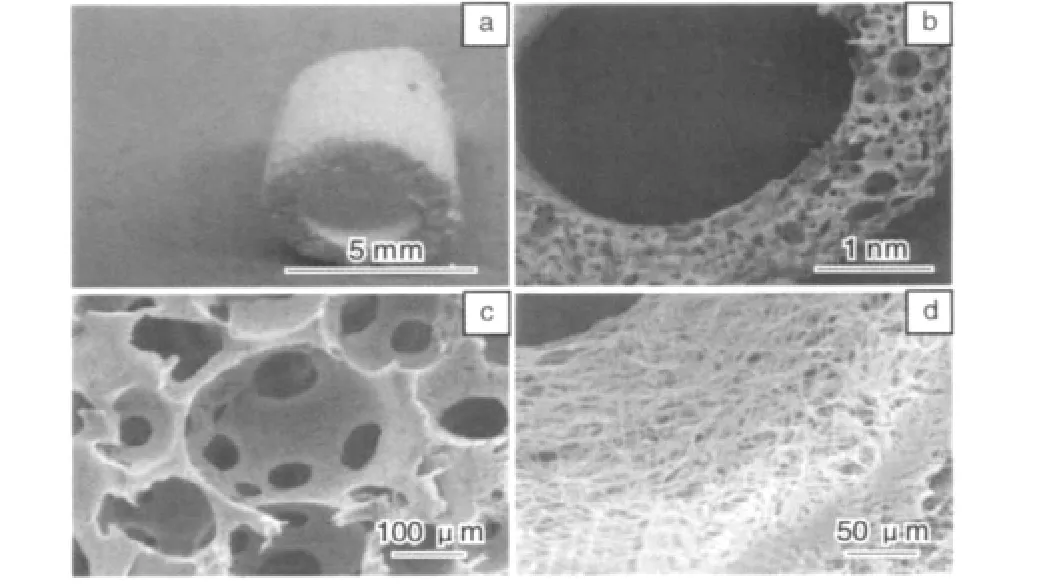
图9 含大孔的管状纳米纤维多孔支架:(a)管状支架全貌,(b)支架横截面,(c)大孔和贯通孔结构及(d)纳米纤维结构的SEM照片Fig.9 Photographs of tubular nano-fibers scaffolds:gross view of tubular scaffold(a),SEM micrographs of scaffold cross-section(b),macropores and pore interconnections structure(c),and nano-fibers structure(d)
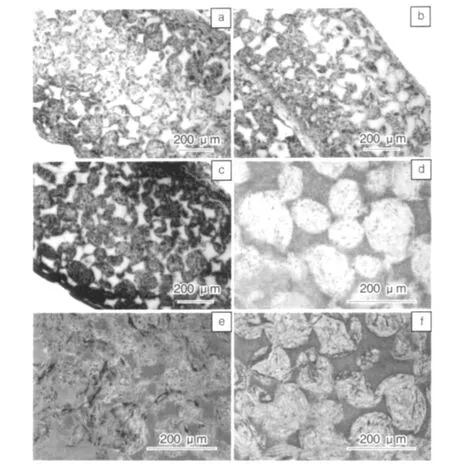
图10 HASMCs细胞在支架上种植培养24 h后体内移植情况:(a)H-E染色,(b)空白支架,(c)移植2周后Masson染色,(d)移植2周之后IgG免疫组化染色(胶原ECM染蓝色),(e)用SMA-actin抗体染色植入宿主SMCs,(f)用人线粒体抗体染色的植入HASMCsFig.10 In vivo implantation of HASMCs-scaffold constructs after 24 h of cell seeding and culture:H-E staining of sections of construction(a),blank scaffolds(b),masson's trichrome after 2 weeks of implantation(c),staining of 2 weeks implants of construction(collagenous ECM stained blue),immunohistochemical staining of IgG control 2 weeks after implantation(d),implanted host SMCs stained with SMA-actin antibody(e),and implanted HASMCs stained with human mitochondria antibody(f)
3 支架材料表面功能化修饰
人工血管表面修饰,主要是抗凝血修饰和促内皮细胞黏附修饰。抗凝血修饰,主要是表面肝素化[17-18]和接枝两性离子如磷酰胆碱(MPC)[19-21]等。这类研究开展得很多,方法比较成熟,这里不再重点介绍。
3.1 内皮祖细胞(EPC)捕捉
近年来人工血管表面修饰,主要是针对内皮祖细胞(EPC)的特异修饰,实现对外周血EPC的捕捉,使血管材料植入体内后在原位实现快速内皮化[22]。这种手段可以避免组织工程方法中的种子细胞来源、体外培养、内皮层脱落、产品储存等问题。可用于捕捉EPC并促进干细胞分化的生物分子包括:血管内皮生长因子VEGF,神经生长因子NGF等;内皮干细胞特异抗体CD34[5],KDR,CD133等;其它细胞粘附分子 RGD和DNA适配体[5]等。图11是EPCs在涂覆了EPC特异捕获分子的人工血管支架的捕获情况示意图[22]。图中表示多肽、蛋白、抗体、磁性分子、适配体都可作为EPCs的捕获分子,这些分子与EPCs上的靶点键合,将内皮祖细胞固定在移植物表面,然后,捕获的EPCs能够分化成内皮细胞,并在人工血管上形成内皮层。高分子支架表面具有血液相容性和抗凝血性的涂层,可以阻止其它血细胞或丝素蛋白黏附于表面。

图11 EPCs在涂覆了EPC特异捕捉分子的人工血管支架上的捕获情况示意图Fig.11 Immobilisation of EPCs on artificial vascular grafts coated with EPC-specific capture molecules
Orbus Neich公司将CD34抗体固定到冠状动脉支架表面,生产出可捕获内皮干细胞、快速实现内皮化的支架 Genous(TM)Bio-engineered R Stent(TM)[23],已进入临床试验阶段。Genous血管支架表面固定CD34抗体,在植入体内1 h后,可观察到大量的细胞粘附,48 h后,可形成几乎完整的类似血管内皮的单层。表明CD34表面捕捉细胞的效率很高,这些被捕捉的细胞,加速了血管内皮的进程。临床研究表明,该支架可募集血液循环中的内皮祖细胞到支架表面,加速血管损伤部位的内皮自然修复,促使支架更好地与周围血管组织相容,减少血栓形成的机率,降低再狭窄的发生。在植入26 d后可形成完全正常的血管内皮。
Rotmans实验室[24]将CD34抗体固定到以ePTFE为材料的人工血管上,植入猪体内后,3 d可以实现快速内皮化。但是,该研究发现CD34抗体修饰的血管材料,同样会发生内膜增生。
国内许多实验室在近几年也开始了类似的研究,如黄楠实验室开展了用于改善心血管植入金属支架的研究。他们利用层层自组装技术,在Ti表面涂布了多层的CD34抗体。这种方法是先在NaOH处理的Ti基质表面沉积一层抗生物素蛋白,再沉积一层生物素化的蛋白A与之前一层相结合,最后,CD34抗体通过其Fc片段与蛋白A结合,露出与抗原结合的Fab段。在这种修饰了的Ti表面培养EPC,并将其植入狗的腹主动脉,结果表明,CD34抗体修饰的表面,能够增强EPC的粘附和捕捉,在体内能诱导内腔表面的快速内皮化[25]。除此之外,他们还利用一种结合了静电作用和共价修饰的方法,在氨基硅烷化的Ti表面,形成肝素和纤连蛋白涂层。首先将两种生物活性分子混合通过静电作用来形成超分子复合体,之后用基于硅烷的方法,将复合物共价连接在Ti表面。初步的工作结果表明,肝素和纤连蛋白的RGD多肽位点都是有功能的。这种修饰后的材料,具有良好的血液相容性。而且相对于Ti材料,修饰后促进了内皮细胞的粘附增殖等[26]。
3.2 抗菌和抗凝血修饰
计剑实验室在2003年通过静电自组装(ESA)的方法成功地在不锈钢支架表面加入了PEI和肝素,通过接触角和电化学阻抗分光学的方法证明了21 d后在Tris-HCl缓冲液中这种涂层仍然是稳定的,而通过血小板粘附和静态凝血时间实验表明,这种带有PEI/肝素涂层的不锈钢支架,具有一定抑制血小板粘附、延长凝血时间的作用[27]。该实验室在2005年通过层层自组装的方法构建了一种能够抗粘附和抗菌的材料。他们利用壳聚糖抗菌和肝素抗粘附的性质在氨化的PET表面层层自组装壳聚糖和肝素。大肠杆菌的粘附实验,说明了在PET表面粘附的大肠杆菌大大高于自组装后的材料,而且粘附的细菌数量会随着组装后pH的降低而减少,表明多层的壳聚糖/肝素能够有效杀死细菌。这种简单而有效的方法为抗粘附和抗菌的表面修饰提供了选择[28]。
3.3 材料表面修饰方法
材料表面的修饰方法有多种,包括共价键形式的基团修饰和化学接枝,包括分子之间的生物结合,如抗原与抗体、生物素与结合素、蛋白与蛋白等之间的亲和作用,还包括非共价键形式的吸附、涂层和自组装。化学修饰往往是对材料表面进行改性,如改变电荷性质,由电正性表面转变为电负性表面,或者由疏水表面变为亲水表面。在生物材料研究中,往往需要对材料进行活性修饰,即向材料内部或表面引入活性分子,如生长因子、酶或DNA。如果采取化学接枝方法,会导致这些活性分子的失活,而物理吸附方式达不到对活性分子的稳定固定。
张旻等采用一种具有两亲性的蛋白HFBI在PCL静电纺丝支架表面自组装,将PCL表面的疏水性转变为亲水性,提高了支架的细胞相容性和血液相容性。同时通过蛋白-蛋白之间的相互作用,将CD31抗体吸附固定在HFBI自组装涂层的PCL支架表面,提高了支架材料表面对内皮细胞的黏附能力(见图12[29])。由于HFBI可以结合多种蛋白,这是一个通用性方法,可以用于对其它蛋白分子的固定。这种固定方法是分子之间的相互作用,是生物结合,非化学键固定。既具有足够的稳定性,又能很好地保持固定分子的生物活性。
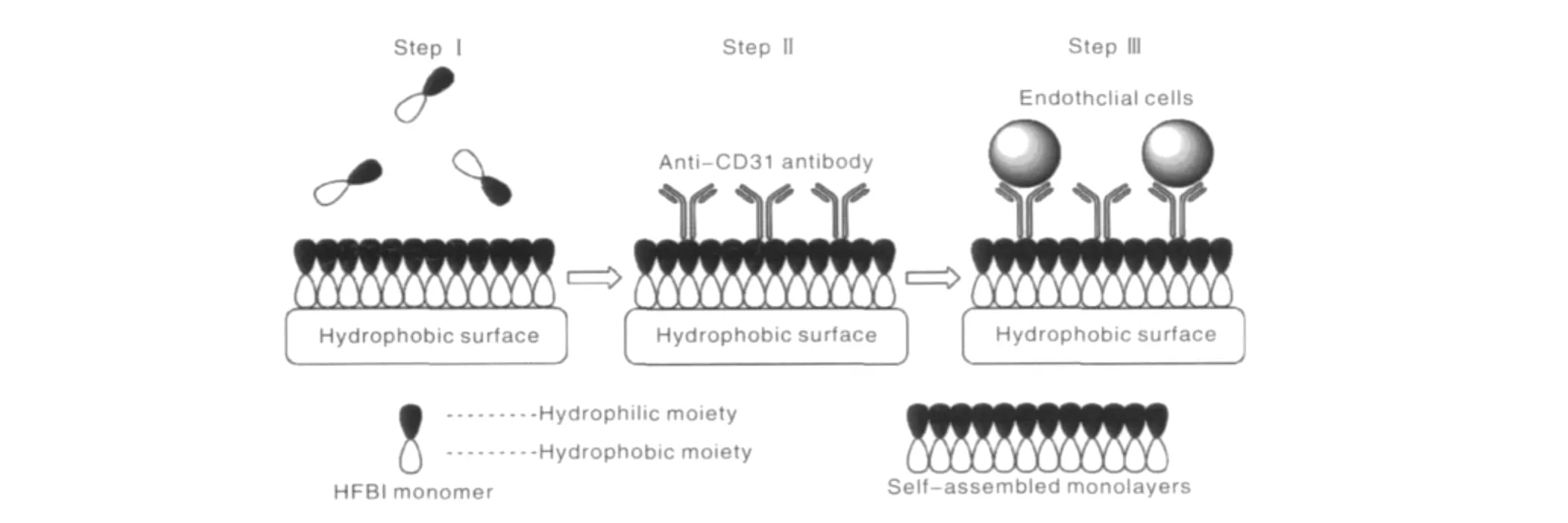
图12 HFBI固定CD31抗体捕捉内皮细胞Fig.12 Immobilization of anti-CD31 antibody on surface of electrospun PCL scaffolds through HFBI and subsequently specific capture of endothelial cells
对人工血管进行表面功能化修饰时,往往需要固定 多种生物分子,包括肝素、抗体、多肽或生长因子。作者实验室报告了一种基于环糊精-金刚烷之间主客体相互作用的表面修饰方法[30]。首先向材料表面固定环糊精分子,根据需要控制环糊精在材料表面的接枝密度。同时,对客体分子进行金刚烷修饰。然后,通过金刚烷与环糊精分子之间的主客体组装,实现活性分子在材料表面的固定。环糊精与金刚烷之间的结合不仅特异性强,而且结合牢固。这种修饰方法的优点是:①等量反应,由于主客体识别专一性强,材料表面的环糊精分子数目决定活性分子的固定量。该方法具有“模块化”的特点,可以根据实际应用选择不同类型的生物活性分子进行修饰,获得所需的表面性质。②组成比例可控,有些情况下需要多种活性分子共同修饰,如支架材料表面需要肝素、抗体、生长因子等。由于活性分子的固定只取决于环糊精和金刚烷之间的分子识别,与活性分子的性质无关,因此,可以根据需要确定两种或多种活性分子的投料比,即可以准确控制其在材料表面的相对比例,这是其它方法,如共价键结合或物理吸附所不能实现的。
实验方法如图13所示。在实验中选用了纤维素基支架材料,首先将环糊精分子共价偶联到纤维素纤维表面。同时合成了分子链两端带有金刚烷基团的聚己内酯(PCL)客体分子。最后,通过环糊精与金刚烷之间的主-客体相互作用将PCL分子链固定在纤维表面,实现了对纤维的表面修饰[30]。
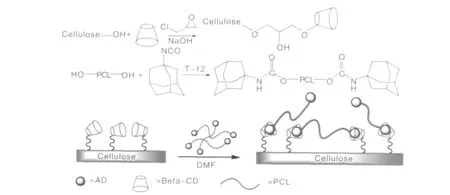
图13 采用主客体自组装方法的支架材料表面修饰示意图Fig.13 Synthesis pathway for cellulose-CD and PCL-AD and the conceptual illustration surface modification for self-assembly process of cellulose-CD with guest polymer PCL-AD
孔德领实验室合成了一种带有RGD肽的可自组装成胶的小分子Nap-FFGRGD。该分子在一定条件下可形成水凝胶,可以在PCL静电纺丝支架表面自组装涂层,将PCL纤维表面改性,提高亲水性,抑制血小板黏附,并改善细胞的黏附与伸展[31]。接下来,该实验室利用Nap-FFGRGD涂层修饰的小口径人工血管开展了兔子颈动脉移植研究。在体外实验中,修饰材料显著提高了捕捉内皮细胞、抑制血小板粘附与聚集的能力。通过AV-shunt模型检测修饰后PCL支架(PCL-RGD)的血液相容性。对体外循环2 h后的血管支架进行SEM分析,观察到PCL支架内表面粘附有大量血小板,而PCL-RGD支架表面基本上没有血小板粘附。
在体内实验中,植入3 d后,通过SEM观察材料内表面,在PCL支架上有大量的血小板、红细胞、炎症细胞及纤维蛋白构成的血栓基质沉积,但是修饰后的材料内表面是光滑的,基本没有血小板粘附,证明了其很好的血液相容性。植入4周后(n=5),利用数字减影血管造影(DSA)测定PCL-RGD支架全部通畅,而PCL由于血栓的形成,支架通畅率只有60%。取材后用SEM观察支架材料内表面,发现在PCL支架粘附有一些血栓基质,而在PCL-RGD支架是没有的,说明该修饰改善了材料的血液相容性(如图14)。此外,通过HE染色可以看到在PCL-RGD支架上细胞浸润显著增加,而且细胞分布更加均匀;通过CD31免疫荧光染色,PCL-RGD支架的内皮化进程大约是PCL支架的3倍;通过α-SMA染色观察平滑肌再生发现,4周时支架内表面在内皮层下均不同程度的长有平滑肌细胞层,PCL-RGD的平滑肌细胞平均覆盖面积有65%,比其在PCL支架上高出23%。说明了RGD的修饰促进了细胞在PCL材料内部的迁移,加速了血管支架的内皮化和平滑肌进程(如图15[12])。

图14 AV-shunt检测修饰后PCL支架(a)和PCL-RGD支架(b)的血液相容性的SEM照片及血管支架植入兔颈动脉3 d后PCL支架(c)和PCL-RGD(d)支架内表面,血管支架植入4周后的PCL支架(e)和PCL-RGD(f)支架内表面的SEM照片Fig.14 SEM images showing platelet adhesion on the grafts after exposed to blood for 2 h in AV-shunt experiment:(a)PCL grafts and(b)PCL-RGD grafts.The adhesion of platelets and mononuclear cells in PCL and PCL-RGD grafts for 3 d after implantation:(c)PCL and(d)PCL-RGD respectively.SEM images for luminal surface of explanted grafts at 4 weeks after implantation:(e)PCL grafts and(f)PCL-RGD grafts
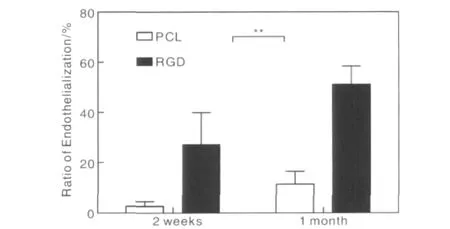
图15 通过CD31免疫荧光染色观察内皮化情况。4周取材后的内皮化比率是通过纵切计算的。**P<0.01.PCL组(n=3),PCL-RGD组(n=5)Fig.15 Endothelium characterization by immunofluorescence staining using CD31 antibody.The ratio of endothelialization at 2 and 4 weeks after implantation was calculated based on the staining of longitudinal sections.**P <0.01.PCL group(n=3);PCLRGD group(n=5)
4 血管再生微环境的构建
支架材料的组织再生微环境非常重要。向支架材料中复合各种细胞外基质,以及与血管再生相关的各种生长因子,可以促进内皮细胞、平滑肌细胞的迁移、黏附、增殖以及分化,为人工血管植入后内皮形成和平滑肌再生提供适宜的微环境[16-17]。
4.1 生长因子复合于支架材料
杜凤仪等制备了壳聚糖/聚己内酯(CS/PCL)质量梯度静电纺丝支架,并负载肝素和VEGF,仿生构建血管壁微环境[32]。该支架材料抗凝血性增强,能稳定持续释放VEGF,促进快速诱导内皮化。通过两种高分子纤维的梯度分布控制,实现肝素与VEGF在血管壁内层高密度固定,达到抗凝血和诱导内皮化形成的作用,同时减弱肝素和VEGF对血管壁内部平滑肌细胞增殖的抑制作用。该研究为小口径血管组织再生微环境的构建提出了新思路。
图16是血管组织工程支架梯度电纺与均匀电纺的示意图[32]。均匀电纺是在CS(0.5 ml/h)与PCL(1 ml/h)稳定流速下进行,梯度电纺在质量梯度流速(CS:0~0.5 ml/h,PCL:0~1 ml/h)下进行,由于肝素和VEGF负载于壳聚糖,因此,梯度电纺更有利于血管内壁抗凝血和快速诱导内皮化。
袁晓燕与孔德领两个课题组合作,通过同轴共纺,以血小板衍生生长因子(PDGF-bb)与葡聚糖(DEX)为芯层,以PLCL为壳层,研究了血管平滑肌细胞在多孔纤维膜上的粘附、增殖和细胞形态。结果表明,负载PDGF-bb的多孔纤维膜材料能促进细胞粘附,其细胞活性也显著提高[33]。
4.2 NO原位控制释放
内皮细胞通过NO合成酶(NOS)氧化L-精氨酸产生一氧化氮(NO),对心血管系统的生理与功能发挥重要调节作用。从内皮细胞表面持续释放的NO能够有效地防止血小板在正常血管壁上的粘附和活化,能抑制平滑肌细胞的增殖,调节免疫应答及促进伤口愈合,有助于减少血管再狭窄。由于NO分子对心血管系统的重要性,近年来人们尝试各种方法制备可释放NO的生物材料。这些方法包括:①将NO供体作为分散的分子掺入聚合物材料或者共价连接到聚合物骨架上,形成了早期的NO释放材料,可用于制备成皮下植入或透皮给药的固体膜或凝胶以及其它医学装置的包衣材料。优点是可以通过改变聚合物基质或NO供体结构来调节NO释放速率,增加这些包衣材料或医学装置的效率并延长其使用周期[34-35];② 先制备NO供体衍生物,再将这些衍生物加入不同的聚合物基质中,通过调整聚合物基质比例以及种类控制NO的释放速率[36-37];③ 前面两种方法只有固定的NO储存量,不能保持持续、长期的NO释放。人体内存在着S-亚硝基硫醇类和亚硝酸盐等内源性的可释放NO的物质。内源性NO在体内多与蛋白质连接,如S-亚硝基蛋白(AblSNO),其可以与低分子的硫醇(RSHs)如L-半胱氨酸(Cys)之间发生快速的亚硝基转换反应,转化后得到的CysNO在体内是不稳定的,可快速释放NO。因此,可将诸如L-半胱氨酸或包含L-半胱氨酸的复合物固定在材料表面或者将还原剂以及NO前体混合进聚合物基质中,利用上述的反应来释放NO,发挥其生物活性。这种方法的优点是利用体内存在的NO供体,保证长期稳定的NO供给,NO的释放也是发生在材料的植入部位[38]。

图16 血管组织工程支架梯度电纺与均匀电纺示意图Fig.16 Schematic diagram of gradient and uniform nano-fibrous scaffolds for vascular tissue engineering
作者实验室直接将NO供体分子混合到PCL溶液中,制备静电纺丝支架。发现NO突释现象和材料的细胞毒性明显。采用芯壳结构的静电纺丝技术,NO供体分子包埋在纤维的内芯,使NO突释和材料的细胞毒性得到了一定程度的改善[39]。芯壳结构材料上培养的细胞活性明显高于非芯壳结构的材料,接近于纯PCL支架。NO释放材料表面的血小板粘附显著低于PCL材料(图17[39]),说明NO的释放有效地抑制了血小板的粘附。

图17 材料表面粘附血小板的SEM照片:(a)单纯PCL纺丝膜,(b)负载NO供体分子的PCL纺丝膜Fig.17 SEM micrographs of adhered platelets on control electro-spun film:(a)pure PCL electro-spun film and(b)PCL electro-spun film with supplier loaded NO moleculars
最近,作者实验室合成了半乳糖基修饰的NO供体分子,利用半乳糖基团稳定NO供体分子,同时实现酶催化控制NO的释放。该NO供体分子在储存条件下很稳定,不被空气和水分解,只有在半乳糖苷酶存在的条件下NO才能释放。将这种新型NO供体分子结合到静电纺丝血管支架材料中,构成了酶催化NO释放血管材料。由于人体内含有这种半乳糖苷酶,因此,可以预见这种新的NO释放材料,可能具有潜在的应用价值。
4.3 转基因技术应用
基因治疗手段常在组织工程中用于提高生长因子和酶的表达,加快组织的形成。基因治疗往往希望基因表达发生在病灶部位,而不是全身和系统表达。针对这一特点,文献报道了多种支架材料介导的基因投递体系。如将基因载体与DNA的复合物纳米粒子固定到材料表面[40],这类支架材料介导的非病毒基因转染体系主要是提高了细胞对DNA纳米复合物的摄取率,因而显著提高了转染效率。张琳华等将抗DNA抗体通过化学键结合到血管支架表面,进而固定质粒DNA,并应用治疗猪动脉再狭窄,显示出支架局部基因转染与表达[41]。
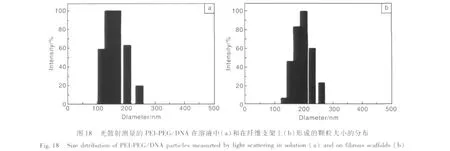
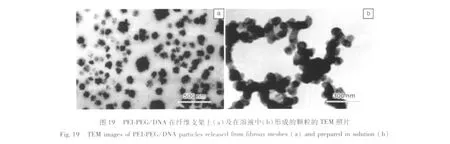
作者实验室应用了一种不同的方法将DNA固定到电纺丝纤维材料表面。首先将PEG修饰的非病毒载体PEI与PCL溶液混合,制备复合的静电纺丝支架,再将DNA通过DNA-PEI的相互作用吸附到材料表面。采用PEG修饰的PEI的目的是改善PEI的细胞相容性,并降低PEI在基因转染中的血清抑制作用。当基因载体分子PEI-PEG从纤维中释放时,与纤维表面吸附的DNA结合,形成PEI-PEG/DNA纳米复合物,粒径约200 nm。图18是PEI-PEG/DNA在溶液中和在纤维支架上颗粒尺寸的分布,图19是其在溶液中和在纤维支架上形成的颗粒的 TEM 照片[42]。
5 结语
人工血管需要同时解决抗凝血、促内皮细胞生长和平滑肌再生的问题。血管内皮和平滑肌都有复杂的生物学特性,人工血管的研究涉及多学科的交叉。在材料方面,应重点开展新材料、结构设计、功能修饰、降解问题、新制备工艺等内容。同时,应从分子和细胞水平研究材料与心血管系统的生物应答,探讨材料学因素对心血管组织修复的影响。
人工血管的研究不单是材料制备的问题,生理和病理等各种生物学因素直接影响材料的植入效果和转归。因此,需要在心血管生物学方面深入研究巨噬细胞、内皮细胞与动脉粥样硬化等信号传导及其他生物学机制。在心血管生理病理方面深入研究内皮细胞、平滑肌细胞的生理与功能,研究二者在疾病状态下的损伤、修复与再生过程的信号传导与干预机制。
此外,深入系统地开展心血管生物材料基础研究,需要多学科交叉和研究团队建设,这是解决人工血管研究的复杂问题和加速该研究方向产业化进程的关键。
References
[1]Writing Group Members,Lloyd-Jones D.American Heart Association Statistics Committee and Stroke Statistics Subcommittee.Heart Disease and Stroke Statistics——2010 Update:a Report from the American Heart Association[J].Circulation,2010,121(7):e46-e215.
[2]He W,Nieponice A,Soletti L.Pericyte-Based Human Tissue Engineered Vascular Grafts[J].Biomaterials,2010,31(32):8 235-8 244.
[3]L'Heureux N,Dusserre N,Konig G.Human Tissue-Engineered Blood Vessels for Adult Arterial Revascularization[J].Nature Medicine,2006,12(3):361 -365.
[4]Villalona GA,Udelsman B,Duncan D R,etal.Cell-Seeding Techniques in Vascular Tissue Engineering[J].Tissue Eng Part B Rev,2010,16(3):341-350.
[5]Avci-Adali M,Paul A,Ziemer G,etal.New Strategies for in Vivo Tissue Engineering by Mimicry of Homing Factors for Self-Endothelialisation of Blood Contacting Materials[J].Biomaterials,2008,29:3 936-3 945.
[6]Gu Zhongwei(顾忠伟).International Development Progress of Tissue Inducing Biomaterials(组织诱导性生物材料国际发展动态)[M].Beijing:Science Press,2010:184-200.
[7]Zhao Q,Wang S F,Kong M M,etal.Phase Morphology,Physical Properties,and Biodegradation Behavior of Novel PLA/PHBHHx Blends[J].Journal of Biomedical Materials Research B:Applied Biomaterials,2012,100B(1):23 -31.
[8]Liu Y,Wang W,Wang J.Blood Compatibility Evaluation of Poly(d,l-Lactide-Co-Beta-Malic Acid)Modified with the GRGDS Sequence[J].Colloids and Surfaces B:Biointerfaces,2010,75:370-376.
[9]Travis J,Horst A,Von Recum.Electrospinning:Applications in Drug Delivery and Tissue Engineering[J].Biomaterials,2008,29:1 989-2 006.
[10]Kong Deling(孔德领),Wei Di(魏 迪),Wang Shufang(王淑芳),etal.Collector of Tube Shape for Collecting Electrospinning Polymer Fiber from Both Sides(双侧收集电纺聚合物纤维管的接收装置):CN,200910068575.6[P].2010-11-01.
[11]Kong Deling(孔德领).Collector for Collecting Tube-Shaped Electrospinning Polymer Fiber(用于收集电纺聚合物纤维管的接收装置):CN,ZL200610014742.5[P].2010-05-01.
[12]Zheng W T,Wang Z H,Song L J,etal.Endothelialization and Patency of RGD-Functionalized Vascular Grafts in a Rabbit Carotid Artery Model[J].Biomaterials,2012,33(10):2 880 -2 891.
[13]Michael J McClure,Patricia S Wolfe,David G Simpson,etal.The Use of Air-Flow Impedance to Control Fiber Deposition Patterns during Electrospinning[J].Biomaterials,2012,33:771-779.
[14]Sarra de Valence,Jean-Christophe Tille,Damiano Mugnai,etal.Long Term Performance of Polycaprolactone Vascular Grafts in a Rat Abdominal Aorta Replacement Model[J].Biomaterials,2012,33(1):38-47.
[15]Wei G.Nano-Fibrous Scaffold for Controlled Delivery of Recombinant Human PDGF-BB[J].J Control Release,2006,112(1):103-110.
[16]Hu J,Sun X,Ma H Y,etal.Porous Nanofibrous PLLA Scaffolds for Vascular Tissue Engineering[J].Biomaterials,2010,31:7 971-7 977.
[17]Sask K N,Zhitomirsky I,Berry L R.Surface Modification with an Antithrombin-Heparin Complex for Anticoagulation:Studies on a Model Surface with Gold as Substrate[J].Acta Biomater,2010,6(8):2 911-2 919.
[18]Lin W C,Liu T Y,Yang M C.Hemocompatibility of Polyacrylonitrile Dialysis Membrane Immobilized with Chitosan and Heparin Conjugate[J].Biomaterials,2004,25(10):1 947 - 1 957.
[19]Hong Y,Ye S H,Nieponice A,etal.A Small Diameter,Fibrous Vascular Conduit Generated from a Poly(Ester Urethane)Urea and Phospholipid Polymer Blend[J].Biomaterials,2009,30(13):2 457-2 467.
[20]Yang Z M,Wang L,Yuan J.Synthetic Studies on Nonthrombogenic Biomaterials 14:Synthesis and Characterization of Poly(E-ther-Urethane)Bearing a Zwitterionic Structure of Phosphorylcholine on the Surface[J].J Biomater Sci Polym Ed,2003,14(7):707-718.
[21]Chen S,Jiang S.A New Avenue to Nofouling Materials[J].Adv Mater,2008,20:335-338.
[22]Avci-Adali M,Perle N,Ziemer G,etal.Current Concepts and New Developmente for Autologous in Vivo Endothelialisation of Biomaterials for Intravascular Applications[J].European Cells and Materials,2011,21:157 -176.
[23]Aoki J,Serruys P W,van Beusekom H.Endothelial Progenitor Cell Capture by Stents Coated with Antibody Against CD34:the HEALING-FIM(Healthy Endothelial Accelerated Lining Inhibits Neointimal Growth-First in Man)Registry[J].J Am Coll Cardiol,2005,45(10):1 574-1 579.
[24]Rotmans J I,Heyligers J M,Verhagen H J,etal.In Vivo Cell Seeding with Anti-CD34 Antibodies Successfully Accelerates Endothelialization but Stimulates Intimal Hyperplasia in Porcine Arteriovenous Expanded Polytetrafluoroethylene Grafts[J].Circulation,2005,112(1):12-18.
[25]Li Q L,Huang N,Chen C,etal.Oriented Immobilization of Anti-CD34 Antibody on Titanium Surface for Self-Endothelializa-tion Induction[J].J Biomed Mater Res A,2010 94A:1 283-1 293.
[26]Li G,Yang P,Qin W,etal.The Effect of Coimmobilizing Heparin and Fibronectin on Titanium on Hemocompatibility and Endothelialization[J].Biomaterials,2011,32:4 691-4 703.
[27]Tang Q G,Ji J,Barbosa M A,etal.Construction Thromboresistant Surface on Biomedical Stainless Steel via Layer-by-Layerdeposition Anticoagulant[J].Biomaterials,2003,24(25):4 699-4 705.
[28]Fu J H,Ji J,Shen J C,etal.Construction of Anti-Adhesive and Antibacterial Multilayer Films via Layer-by-Layer Assembly of Heparin and Chitosan[J].Biomaterials,2005,26(33):6 684-6 692.
[29]Zhang M,Wang Z X,Wang Z F,etal.Immobilization of Anti-CD31 Antibody on Electrospun Poly(ε-Caprolactone)Scaffolds Through Hydrophobins for Specific Adhesion of Endothelial Cells[J].Colloids Surf B Biointerfaces,2011,85(1):32 -39.
[30]Zhao Q,Wang S F,Cheng X J,etal.Surface Modification of Cellulose Fiber via Supramolecular Assembly of Biodegradable Polyesters by the Aid of Host-Guest Inclusion Complexation[J].Biomacromolecules,2010,11(5):1 364-1 369.
[31]Wang Z H,Wang H M,Zheng W T,etal.The Highly Stable Surface Modifications of Poly(3-Caprolactone)(PCL)Films by Molecular Self-Assembly to Promote Cell Adhesion and Proliferation[J].Chem Commun(Camb),2011,47(31):8 901-8 903.
[32]Du F Y,Wang H,Zhao W,etal.The Gradient Nanofibrous Chitosan/poly ε-Caprolactone Scaffolds as Extracellular Microenvironments for Vascular Tissue Engineering[J].Biomaterials,2012,33(3):762-770.
[33]Li H,Zhao C G,Wang Z X.Controlled Release of PDGF-bb by Coaxial Electrospun Dextran/Poly(L-lactide-Co-ε-Caprolactone)Fibers with an Ultrafine Core/Shell Structure[J].Journal ofBiomaterials Science,2010,21:803 -819.
[34]Kelly A Mowery,Mark H Schoenfisch,Joseph E Saavedra,etal.Preparation and Characterization of Hydrophobic Polymeric Films That are Thromboresistant via Nitric Oxide Release[J].Biomaterials,2000,21(1):9 -21.
[35]Amedea Barozzi Seabra,Marcelo Ganzarolli de Oliveira.Poly(Vinyl Alcohol)and Poly(vinyl Pyrrolidone)Blended Films for Local Nitric Oxide Release[J].Biomaterials,2004,25(17):3 773-3 782.
[36]Zhang H,Annich G M,Miskulin J,etal.Nitric Oxide-Releasing Fumed Silica Particles:Synthesis,Characterization,and Biomedical Application[J].J Am Chem Soc,2003,125(17):5 015-5 024.
[37]Brian J Nablo,Mark H Schoenfisch.In Vitro Cytotoxicity of Nitric Oxide-Releasing Sol-Gel Derived Materials[J].Biomaterials,2005,26(21):4 405-4 415.
[38]Duan X B,Lewis R S.Improved Haemocompatibility of Cysteine-Modified Polymers via Endogenous Nitric Oxide[J].Biomaterials,2002,23(4):1 197-1 203.
[39]Zhang L,Wang K,Zhao Q,etal.Core-Shell Fibrous Vascular Graft with Nitric Oxide Releasing Property[J].Science in China Series B:Chemistry,2010,53(3):1 -7.
[40]Bengali Z,Rea J C,Gibly R F,etal.Efficacy of Immobilized Polyplexes and Lipoplexes for Substrate-Mediated Gene Delivery[J].Biotechnol Bioeng,2009,102(6):1 679-1 691.
[41]Zhang L H,Luo T,Zhang C,etal.Anti-DNA Antibody Modified Coronary Stent for Plasmid Gene Delivery:Results Obtained from a Porcine Coronary Stent Model[J].Gene Med,2011,13(1):37-45.
[42]Zhang J,Duan Y J,Wei D,etal.PEI/PCL Co-Electrospun Fibers Adsorbed DNA for Substrate Mediated Gene Delivery[J].Journal of Biomedical Materials Research A,2010,96(1),212-220.
The Development of Construction of Small-Diameter Vascular Grafts in Vivo
WANG Shufang,ZHENG Wenting,KONG Deling
(State Key Laboratory of Medicinal Chemical Biology,College of Life Sciences,Nankai University,Tianjin 300071,China)
Although there is a growing demand of small-diameter vascular grafts for cardiovascular disease,the incidence rate of restenosis caused by vascular grafts remains high.An effective approach to improve the function of small-diameter vascular grafts and realize the blood vessel regeneration would be to induce a healing response in vivo for tissue engineering.In this article,we summarize the recent research developments on small-diameter vascular grafts,and highlight the main designing ideas and research outcomes in our laboratory.The work includes structural design and fabrication of porous scaffolds,anti-clotting modification,functionalization for endothelial progenitor cells(EPCs)capture,creation of micro-environment for vascular smooth muscle regeneration and angiogenesis.Some directions and problems on future research in these areas are also discussed.
vascular grafts;tissue engineering;scaffold preparation;stem cell capture;endothelialization;smooth muscle regeneration;extracellular microenvironments
R318.08
A
1674-3962(2012)09-0006-14
2012-04-23
国家973研究计划项目(2011CB964903,2012CB725203);国家自然科学基金资助项目(50830104,51073081,81000680)
王淑芳,女,1963年生,教授,博士生导师
孔德领,男,1966年生,教授,博士生导师
10.7502/j.issn.1674-3962.2012.09.02
