GL1-EGFP融合蛋白的原核表达及对神经胶质瘤细胞的靶向作用分析
2012-01-17于家文郭美华赵春晖
于家文,郭美华,赵春晖,冯 斌
(1. 大连医科大学 生物技术系, 辽宁 大连 116044; 2. 辽宁师范大学 生命科学学院, 辽宁 大连 116081)
包括多形性胶质母细胞瘤(GBM)在内的脑肿瘤治疗目前仍是一个挑战。血脑屏障(BBB)的存在限制了化疗药物到达肿瘤细胞。目前的主要方法是通过外科手术切除大部分肿块及对浸润部分的辅助治疗。由于神经胶质瘤细胞的浸润性生长,使它和正常脑组织没有明显界限。如何找到手术无法切除的残存胶质瘤细胞,是实现神经胶质瘤治疗中有效预后的新课题和焦点。肿瘤细胞表面的特殊分子标记为完成这一目标提供了有效手段。表面结合叶酸[1]、转铁蛋白[2]、表面生长因子受体(EGFR)的抗体[3]的免疫脂质体已经应用于含硼化合物BSH和其他治疗药物靶向导入胶质瘤细胞的研究中,并取得了较好的动物体内、外实验结果。
肿瘤靶向肽是一类能与肿瘤细胞表面特异受体结合的寡肽。与抗体及其他靶向分子相比,肿瘤靶向肽具有分子量更小、组织穿透能力更强、低免疫原性和高亲和力、容易大量合成等优点,在药物靶向导入系统(drug delivery system, DDS)中具有广阔的应用前景[4-5]。GL1是一段通过噬菌体展示技术筛选出来的12短肽(LLADTTHHRPWT)。对高表达EGFR的神经胶质瘤细胞ΔGli 36具有高亲和性,体内实验证明GL1能够有效地靶向肿瘤细胞[6]。本研究拟通过构建GL1与EGFP的融合蛋白,重组成为具有靶向作用和带有荧光示踪功能的蛋白,为神经胶质瘤的靶向治疗提供了基础数据。
1 材料和方法
1.1 材 料
LA Taq DNA聚合酶、T4DNA连接酶、pMD18-T、DNA凝胶回收试剂盒、限制性核酸内切酶Nde I和EcoR I购于宝生物大连有限公司。KOD DNA聚合酶购自东洋纺(上海)生物科技有限公司。Ni2+-树脂填料购自Novagen公司, Anti-His 鼠单克隆抗体、辣根过氧化物酶(HRP) 标记的二抗购自Invitrogen公司。ECL发光检测试剂盒购自Thermo公司。U87△EGFR细胞由日本冈山大学医学部松井秀树教授惠赠,其他试剂均为国产分析纯。
1.2 方 法
1.2.1 PCR目的片段的扩增:设计两对引物,在5'端分别加入Nde I和EcoR I酶切位点,以pEGFP-N1质粒为模板,对GL1-EGFP和EGFP基因进行扩增。扩增GL1-EGFP的引物为: 5'-CCGCATATGCTTTTAGCTGATACAACGCACCGACCCTG-GACTGGAATGGTGAGCAAGGGCGAGGAG-3';5'-CCGGAATTCGGCTTGTACAGCTCGTCCATG-3'。扩增EGFP的引物为:5'-CCGCATATGGTGAGCAAGGGCGAGGAGC-3';5'-CCGGAATTCGGCTTGTACAGCTCGTCCATG-3'。PCR反应条件为:94℃ 预变性2 min;94℃ 变性 1 min,65℃退火1 min,72延伸1 min,循环30次,72℃延伸7 min。
1.2.2 克隆载体的构建:1%琼脂糖凝胶鉴定并回收PCR产物。平末端PCR产物3'末端加A反应为:PCR纯化产物6 μL,10×LA Taq buffer 1 μL,dNTP(10 mmol/L)2 μL,LA Taq DNA聚合酶1 μL,反应总体系10 μL,72℃ 30 min进行加A反应。加A产物与pMD18-T载体连接过夜后转入感受态大肠杆菌JM109中,在含有氨苄青霉素50 mg/L的LB固体平板上培养12~16 h进行蓝白斑筛选。挑取白色菌落,活化后提取质粒并用Nde I和EcoR I进行酶切鉴定。重组质粒由生工生物工程(上海)有限公司测序。
1.2.3 表达载体的构建:测序后的重组质粒酶切后进行1%琼脂糖凝胶电泳,回收插入的目的条带,与Nde I和EcoR I酶切的pET-22b(+)表达载体连接后转入感受态大肠杆菌BL21(DE3)进行蛋白表达。
1.2.4 目的蛋白的提取纯化与Western blotting检测:含有融合蛋白表达质粒的工程菌在37℃培养过夜,菌液稀释后继续培养至OD600≈0.6,加入终浓度为1 mmol/L的IPTG诱导蛋白表达,6 h后收集菌体超声破碎。上清进行 12% SDS-PAGE蛋白电泳,考马斯亮蓝染色检测目的蛋白表达情况。N端带有His的融合蛋白利用组氨酸亲和层析柱(His·Bind Column)进行纯化。纯化后的蛋白电泳后采用半干式转膜方式转移至PVDF膜上,利用anti-His抗体进行Western blotting检测。
以抗His-tag的鼠单克隆抗体为一抗,室温孵育1 h,二抗为辣根过氧化物酶标记的兔抗鼠的抗体。 孵育1 h后利用ECL发光试剂盒进行暗室曝光检测。
1.2.5 U87△EGFR的细胞培养及共聚焦显微观察:细胞培养基为DMEM高糖培养基(Hyclone),含10%小牛血清(Hyclone), 1%硫酸链霉素和青霉素,培养条件为37℃,5% CO2。将细胞爬片浸入浓硫酸中过夜,75%乙醇浸泡6 h,三蒸水泡3 h,高压灭菌后85℃烘干。烘干后的爬片表面用多聚赖氨酸处理后放入12孔板中,向每个孔加入1×105的U87△EGFR细胞,培养24 h后再加入GL1-EGFP和EGFP至终浓度2 μmol/L,培养30 min后,室温下用PBS清洗3次,每次5 min,4%多聚甲醛(PFA)固定10 min,PBS清洗3次后共聚焦显微镜观察,拍照。
2 结 果
2.1 PCR目的产物的扩增
通过PCR反应,成功地扩增出了EGFP和GL1-EGFP目的基因,其中EGFP和GL1-EGFP的序列大小分别为737 bp和776 bp(图1 泳道1和2)。
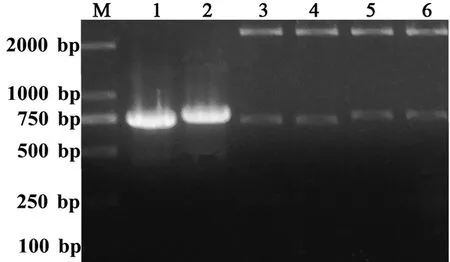
图1 EGFP和GL1-EGFP的PCR扩增和克隆重组质粒的酶切结果
Fig 1 PCR of EGFP and GL1-EGFP and enzyme digestion of cloning recombinant plasmids
M: DL 2000 DNA 分子量标准; 1: EGFP的PCR扩增; 2: GL1-EGFP的PCR扩增; 3、4: EGFP 克隆重组质粒的Nde I和 EcoRI双酶切结果; 5、6: GL1-EGFP克隆重组质粒的Nde I和 EcoRI双酶切结果
2.2 克隆载体和表达载体的构建
PCR产物连接到T载体后转化大肠杆菌,挑选白斑进行质粒提取,Nde I 和 EcoRI双酶切后电泳分析表明: EGFP和GL1-EGFP成功连接到T克隆载体上(图1泳道3和4),测序结果显示EGFP和GL1-EGFP目的基因均无突变。
回收Nde I和EcoR I酶切后的GL1-EGFP和EGFP目的片段,与经过同样酶切的pET-22b(+)载体连接,转化大肠杆菌后挑选重组质粒酶切鉴定,表明GL1-EGFP和EGFP插入到表达载体中(图 2)。
2.3 蛋白的提取纯化及Western blotting检测
含有GL1-EGFP和EGFP表达载体的工程菌经IPTG诱导后提取蛋白, SDS-PAGE电泳表明:经IPTG诱导的总蛋白中,在29 kD和27 kD可以见到明显的GL1-EGFP和EGFP表达条带(图3 泳道2和5),而没加IPTG诱导的总蛋白中未见相应的条带(图3泳道3和6)。GL1-EGFP和EGFP的分子量与软件预测的相同。利用镍亲和层析柱纯化后获得了高浓度的纯化GL1-EGFP和EGFP蛋白(图3 泳道1和4)。

图2 EGFP和GL1-EGFP的表达重组质粒的酶切结果Fig 2 Enzyme digestion of expression recombinant plasmids
M: DL 5000 DNA 分子量标准; 1: EGFP 表达重组质粒的Nde I和 EcoRI双酶切结果; 2: GL1-EGFP表达重组质粒的Nde I和 EcoRI双酶切结果
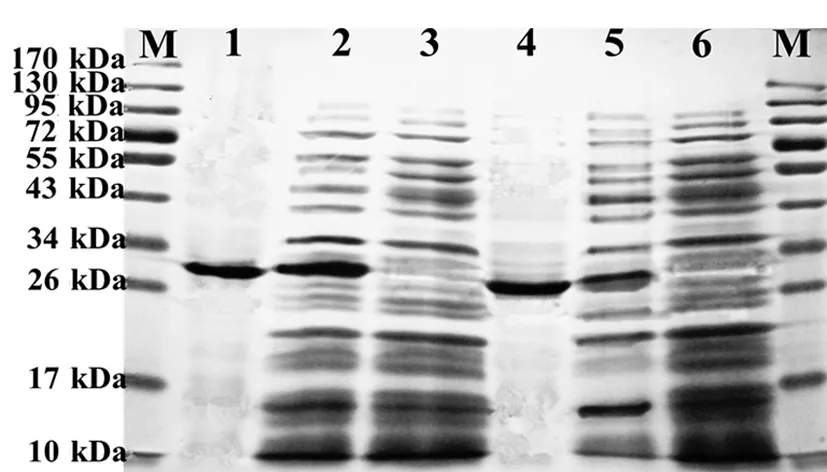
图3 GL1-EGFP和EGFP表达和纯化的SDS-PAGE结果
Fig 3 SDS-PAGE analysis of expression and purification of GL1-EGFP and EGFP
M:蛋白分子量标准; 1: 纯化的GL1-EGFP; 2: IPTG诱导GL1-EGFP表达 3:无IPTG诱导GL1-EGFP表达 (对照); 4: 纯化的EGFP; 5: IPTG诱导EGFP表达; 6: 无IPTG诱导EGFP表达(对照)
Western blotting 检测结果显示,在29 kD和27 kD的相应条带上,能够看到相应的杂交信号,证明纯化蛋白为带有组氨酸标签的GL1-EGFP和EGFP(图 4)。

图4 GL1-EGFP和EGFP 的Western blotting检测
Fig 4 Western blotting analysis of purified GL1-EGFP and EGFP
2.4 GL1-EGFP的体外细胞结合实验
神经胶质瘤细胞U87△EGFR分别与GL1-EGFP和EGFP孵育培养30 min后进行共聚焦显微镜观察。GL1-EGFP作用的U87△EGFR细胞表面有很强的绿色荧光(图5 A),而对照组EGFP作用的U87△EGFR细胞表面看不到荧光(图5 B)。
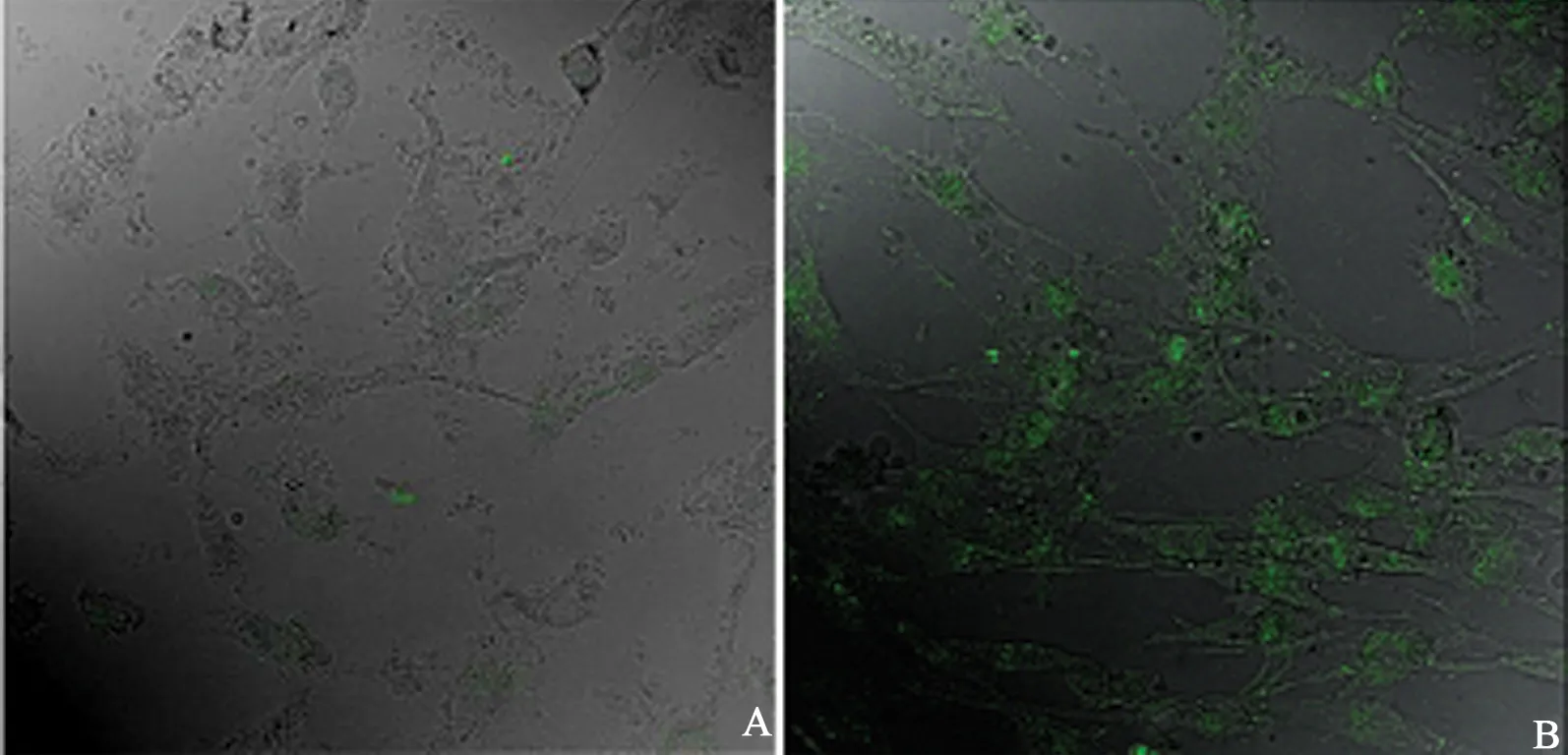
图5 GL1-EGFP对U87△EGFR靶向作用的共聚焦显微镜结果Fig 5 Confocal microscopy analysis of GL1-EGFP binding with U87△EGFR cells in vitroA: EGFP (对照); B: GL1-EGFP
3 讨 论
恶性神经胶质瘤目前仍是致死性的脑肿瘤疾病。近年来的药物靶向传输为治疗提供了一条可行途径。但是脑血屏障的存在和肿瘤细胞的浸润生长特性限制了药物有效地到达肿瘤细胞,进而影响药效,因此利用对脑瘤细胞具有靶向性的小分子多肽来携带药物定向运输到脑肿瘤细胞具有广阔的前景[7]。本研究所用的GL1靶向肽序列是通过噬菌体展示技术针对胶质瘤细胞Gli36分离出来的,研究表明其对其他一些神经胶质瘤细胞,如SNB19、U343MG、SF767和U373MG也具有一定的靶向作用[6]。十二肽的GL1(LLADTTHHRPWT)是相对疏水的,尤其在N端的亮氨酸leucine(L),C端的脯氨酸(P)和色氨酸(W),这样GL1有可能通过疏水部分锚定肿瘤细胞的跨膜域。Hopp等[8]认为,蛋白的抗原性一般与特殊氨基酸的亲水性有关。GL1的亲水指数是-0.3,说明这个肽具有略微疏水特性,不会引起抗原反应。GL1与EGFP融合后,位于EGFP的N端,GL1-EGFP融合蛋白仍然能够有效地表达并发出绿色荧光,说明没有影响EGFP的有效折叠和正确构象。
在构建克隆质粒的过程中,本研究发现,重组T载体转入感受态大肠杆菌XLI-blue中的时候,携带GL1-EGFP的克隆质粒的菌体高效的表达了所需要的目的蛋白,而这种情况在感受态大肠杆菌JM109中却没有发生。测序分析表明:GL1-EGFP插入LacZ基因内部,没有打断原有β-半乳糖苷酶基因α-肽的读码框,并实现了顺码通读,在lac启动子的作用下进行了高效的表达,表达的GL1-EGFP的N端和C端各带有β-半乳糖苷酶α-多肽的片段。
GL1-EGFP与神经胶质瘤细胞的体外结合实验说明GL1能够在30 min时间内就锚定到肿瘤细胞表面,而没有GL1的EGFP对细胞没有结合作用,直观的证明了GL1对神经胶质瘤细胞的靶向作用,为下一步改造GL1应用于脑肿瘤的靶向治疗提供依据。GL1对神经胶质瘤细胞只具有锚定靶向作用,在细胞内部还没有观察到EGFP的绿色荧光。研究表明:细胞穿膜肽(cell-penetrating peptides, CPPs)能够将生物大分子导入细胞内部,常用的CPPs有人类免疫缺陷病毒(HIV)的TAT 的蛋白转导域(protein transduction domain, PTD)和聚赖氨酸[9-10]。GL1如果应用于药物传输系统需要将蛋白或者载荷导入到细胞内部,因此对GL1进行改造
将蛋白或载荷导入肿瘤细胞内部是下一步的研究内容。此外,由于神经胶质瘤的异质性,找到GL1的肿瘤细胞表面作用蛋白和位点也是具有挑战性的工作,这将为脑肿瘤药物的有效靶向运输和治疗提供依据。
[1] Pan XQ, Wang H, Lee RJ. Boron delivery to a murine lung carcinoma using folate receptor-targeted liposomes [J]. Anticancer Res, 2002, 22(3):1629-1633.
[2] Maruyama K, Ishida O, Kasaoka S, et al. Intracellular targeting of sodium mercaptoundecahydrododecaborate (BSH) to solid tumors by transferrin-PEG liposomes, for boron neutron-capture therapy (BNCT) [J]. J Control Release 2004, 98(2):195-207.
[3] Feng B, Tomizawa K, Michiue H, et al. Delivery of sodium borocaptate to glioma cells using immunoliposome conjugated with anti-EGFR antibodies by ZZ-His [J]. Biomaterials, 2009, 30(9):1746-1755.
[4] Del Vecchio CA, Li G, Wong AJ.Targeting EGF receptor variant III: tumor-specific peptide vaccination for malig-nant gliomas[J]. Expert Rev Vaccines,2012, 11(2):133-144.
[5] Chunxiao Wu, Seong Loong Lo, Jerome Boulaire, et al. A peptide-based carrier for intracellular delivery of proteins into malignant glial cells in vitro[J]. J Control Release, 2008, 130(2): 140-145.
[6] Ho IA, Hui KM, Lam PY. Isolation of peptide ligands that interact specifically with human glioma cells [J]. Peptides, 2010, 31(4):644-650.
[7] Bidros DS, Vogelbaum MA. Novel drug delivery strategies in neuro-oncology [J]. Neurotherapeutics, 2009, 6(3):539-546.
[8] Hopp TP,Woods KR. Prediction of protein antigenic determinants from amino acid sequences [J]. Proc Natl Acad Sci USA, 1981, 78(6):3824-3828.
[9] Snyder EL, Dowdy SF. Recent advances in the use of protein transduction domains for the delivery of peptides, proteins and nucleic acids in vivo[J]. Expert Opin Drug Deliv, 2005, 2(1):43-51.
[10] Hitsuda T, Michiue H, Kitamatsu M. A protein transduction method using oligo-arginine (3R) for the delivery of transcription factors into cell nuclei [J]. Biomaterials, 2012, 33(18):4665-4672.
