微核试验和彗星试验检测雄黄的遗传毒性
2012-01-16吴文斌张超超汤家铭
吴文斌,张超超,汤家铭
(上海中医药大学实验动物中心,上海201203)
微核试验和彗星试验检测雄黄的遗传毒性
吴文斌,张超超,汤家铭
(上海中医药大学实验动物中心,上海201203)
目的用短期给药(小鼠骨髓细胞微核试验和彗星试验)和长期给药(利用生殖毒性Ⅰ段试验的大鼠做微核试验和彗星试验)检测雄黄的遗传毒性,探讨利用长期毒性试验或生殖毒性Ⅰ段试验用动物进行遗传毒性检测的可行性。方法小鼠ig给予雄黄0.25,0.5和1.0 g·kg-1,每天1次,2 d后,取骨髓细胞做微核试验和彗星试验;利用生殖毒性Ⅰ段大鼠ig给予0.125,0.25和0.55 g·kg-1,雄性连续给药42 d以上,交配成功后处死;雌性连续ig给药19 d以上,妊娠第15天,取骨髓细胞做微核试验和彗星试验,取血做外周血淋巴细胞微核试验。结果与阴性对照组比较,小鼠雄黄0.25,0.5和1.0 g·kg-1组微核试验微核率分别为3.0‰,4.40‰,7.01‰(P<0.05,P<0.01)和彗星试验拖尾率分别为6.3%,9.7%和11.3%(P<0.05,P<0.01)。与阴性对照组比较,生殖毒性Ⅰ段试验大鼠ig给予雄黄,雄黄0.55 g·kg-1组雄性大鼠的骨髓微核和外周血淋巴细胞微核率分别为2.83‰和6.67‰(P<0.05),雌性大鼠0.25和0.55 g·kg-1的骨髓微核和外周血淋巴细胞微核率分别为1.5‰,2.25‰以及2.58‰和4.40‰(P<0.05,P<0.01);雄黄使雄性和雌性大鼠彗星拖尾率明显升高(P<0.05)。结论利用生殖毒性Ⅰ段试验多次给药后取材做微核试验和彗星试验方法可行;外周血微核试验简便易行;在所观察的剂量下雄黄具有遗传毒性。
雄黄;微核试验;彗星试验;诱变力试验
雄黄(realgar)是矿物类中药,主要成分为三硫化二砷(As2S3)。现代药理学研究表明,雄黄具有抗肿瘤、镇痉、止痛、杀虫和抗菌等作用[1]。长期以来中医认为雄黄有毒,内服宜慎,不可久用,孕妇禁用,因此雄黄一直作为有毒中药受到药监部门的严格控制。雄黄含有对人体有害元素砷,临床上亦有过量服用而中毒的报道[2]。对雄黄的毒理学研究发现,雄黄具有肝肾毒性和细胞毒性[3-5]。但是否具有遗传毒性报道不多,为此本研究采用小鼠骨髓细胞微核试验和雄黄生殖毒性Ⅰ段试验的大鼠处死时取材用微核试验(micronucleus test,MT)和彗星试验(comet assay,CA)对雄黄进行遗传毒性研究。
1 材料与方法
1.1 动物
ICR小鼠,清洁级,体质量35~38 g。利用生殖毒性Ⅰ段试验SD大鼠,体质量雄性426~498 g,雌性310~382 g。以上动物均由上海斯莱克实验动物有限公司提供,动物许可证号:SCXK(沪)2007-0005。温度控制在20~25℃,湿度控制在40%~70%。动物自由摄食,饮水,1周换1~2次垫料。
1.2 药物、试剂和仪器
雄黄,产地贵州,由上海封浜中药饮片厂加工炮制成饮片为橙黄色细粉末,批号:H2007052401,经上海市食品药品检验所检验,三硫化二砷含量为95.5%。羧甲纤维素钠(CMC-Na),批号:F20090508,购自国药集团化学试剂有限公司;环磷酰胺,批号:9J596A,购自Endoxan公司;低熔点和正常熔点琼脂糖、吖啶橙、Giemsa染液及其他试剂均为国产分析纯。
DYY-6C型双稳定时电泳仪,北京六一仪器厂;Motic BA400生物显微镜,带数码照相及图像分析系统,麦克奥迪实业有限公司产品。
1.3 动物分组和给药
微核试验ICR小鼠,按体质量进行分层随机分组,分成正常对照组、环磷酰胺阳性对照组、雄黄0.25,0.5和1.0 g·kg-1组,每组6只,给药前禁食6 h。雄黄组按20 ml·kg-1ig给药,阴性对照组ig给予等容量的0.5%CMC-Na,间隔24 h再次给药。环磷酰胺按16 ml·kg-1给药1次。ICR小鼠的雄黄0.125,0.25和0.55 g·kg-1组和阴性对照组第2次给药后24 h脱颈椎脱臼处死;环磷酰胺阳性对照组给药24 h后脱颈椎脱臼处死。
利用生殖毒性Ⅰ段试验的雄性和雌性SD大鼠各80只,按照生殖毒性Ⅰ段试验实验方案大鼠分别ig给予雄黄0.125,0.25和0.55 g·kg-1,阴性对照组ig给予等容量的0.5%CMC-Na。雄性大鼠给药42 d后交配,交配成功后处死,雌性大鼠给药14 d后至妊娠第6天,妊娠第15天处死。雄黄0.125,0.25和0.55 g·kg-1组各取出6只大鼠的股骨用止血钳夹碎,取骨髓用于骨髓细胞微核试验和彗星试验,取外周血做淋巴细胞微核试验。
1.4 微核试验测定微核率
骨髓微核试验参照文献[6]方法,取适量骨髓在凹孔瓷板内,与大鼠血清混匀,滴加到载玻片上推片,自然干燥。每个标本制作2片。将推片放入甲醇中固定10 min,取出后放入Giemsa染液中染色20~30 min,纯水冲洗,晾干。选择细胞完整、涂片均匀、染色适当的区域,在油镜下观察。用双盲法读片,每只动物计数2000个嗜多染红细胞(polychromatic erythrocyte,PCE),观察含有微核的PCE数,计算微核率。外周血微核试验取抗凝血120 μl加入40 μl新鲜配制的3%明胶溶液混匀,无气泡后放入37℃水浴40 min,吸取上清液,145×g离心5 min,吸取上清液剩余约20 μl混匀后涂片,干燥后甲醇固定,然后放入Giemsa染液中染色20 min,纯水冲洗,选择细胞完整、涂片均匀、染色适当的区域,在油镜下观察[6]。用双盲法读片,每只动物计数2000个淋巴细胞,观察含有微核的淋巴细胞数,计算微核率。
1.5 彗星试验测定拖尾率
参照文献[8-9]介绍的方法,用1 ml预冷的HBSS冲洗股骨骨髓于1.5 ml离心管中。在磨砂载玻片上滴加0.6%正常熔点琼脂糖500 μl,加盖玻片作为第一层,4℃冷却15 min后去掉盖玻片,备用。取10 μl骨髓液与90 μl浓度为0.75%低熔点琼脂糖混合,滴加到第一层凝胶上,加盖玻片,冷却后去掉盖玻片。将载玻片缓慢放入裂解液中,4℃放置1.5 h。经中和处理后将载玻片放入电泳槽中,加电泳液至覆盖玻片,4℃放置45 min。接通电源25 V,电流量300 mA,4℃电泳25 min。经中和处理后,采用吖啶橙20 mg·L-1染色,尽快观察结果,拍照。每张片子在图像分析系统上随机计数50个细胞,记录拖尾细胞数计算拖尾阳性率,测量拖尾长度。
1.6 统计学分析
2 结果
2.1 雄黄对小鼠骨髓细胞的遗传毒性
2.1.1雄黄对小鼠骨髓细胞微核率的影响
与阴性对照组微核率(1.42‰)比较,ig给予雄黄0.25,0.5和1.0 g·kg-1组ICR小鼠微核率显著升高,分别为3.0‰,4.4‰和7.0‰(P<0.01);环磷酰胺0.05 g·kg-1组微核率为28.3‰(P<0.01)。雄黄0.25,0.5和1.0 g·kg-1组PCE与总红细胞比值为0.50~0.55,均属正常范围,且各组间无显著性差异。
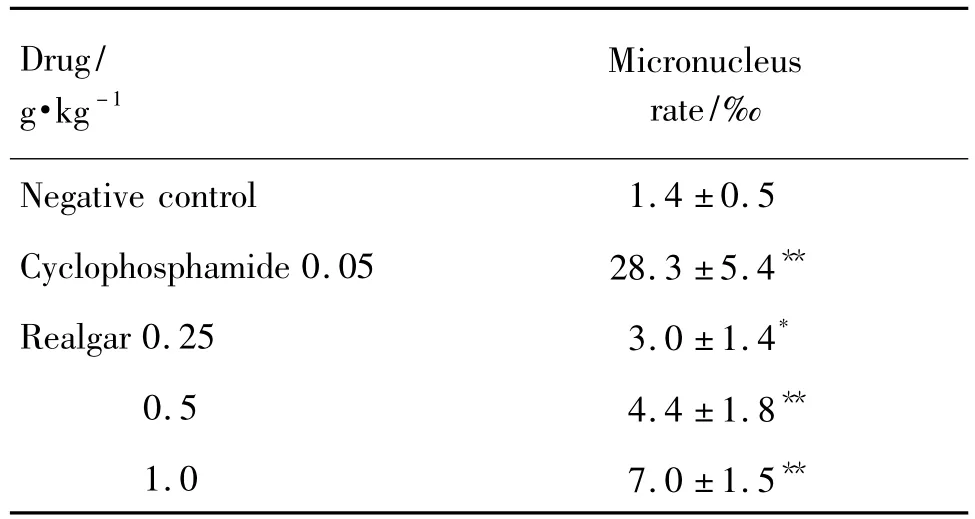
Tab.1 Effect of realgar on micronucleus rate in bone marrow cells in mice
2.1.2 雄黄对小鼠骨髓细胞彗星试验拖尾率的影响
利用小鼠雄黄微核试验的另一侧股骨做骨髓细胞彗星试验,表2结果显示,与阴性对照组比较,雄黄0.25和0.55 g·kg-1组的拖尾阳性率和拖尾长度明显升高(P<0.01)。
Drug/
g·kg-1Tailing rate/%
Tailing length/μm

Tab.2 Effect of reaglar on tailing rate and tailing length of bone marrow cells by comet assay in male mice
2.2 雄黄对生殖毒性Ⅰ段试验大鼠的遗传毒性
2.2.1 雄黄对大鼠骨髓细胞微核率的影响
利用雄黄ig给药生殖毒性Ⅰ段试验的雄性和雌性大鼠做骨髓细胞微核试验,表3结果显示,与阴性对照组比较,雄黄0.25 g·kg-1雌性大鼠微核率显著升高(P<0.05),雄黄0.55 g·kg-1雄性和雌性大鼠微核率显著升高(P<0.05),并随着剂量的增加微核率也增高。

Tab.3 Effect of reaglar on bone marrow cell micronucleus rate in both male and female rats from reproductive toxicology test
2.2.2 雄黄对大鼠外周血淋巴细胞微核率的影响
利用雄黄灌胃给药生殖毒性Ⅰ段试验的雄性和雌性大鼠做外周血淋巴细胞微核试验,表4结果显示,与阴性对照组比较,雄性0.55 g·kg-1组和雌性0.25和0.55 g·kg-1组的微核率显著升高(P<0.01),并随着剂量的增加微核率也增高。

Tab.4 Effect of reaglar on peripheral lymphocyte micronucleus rate in both male and female rats from reproductive toxicology test
2.2.3 雄黄对生殖毒性Ⅰ段大鼠骨髓细胞彗星试验拖尾率的影响
利用生殖毒性Ⅰ段试验处理时的雄性大鼠做骨髓细胞彗星试验,表5结果显示,与阴性对照组比较,雄黄0.125,0.25和0.55 g·kg-1组的拖尾阳性率和拖尾长度明显升高(P<0.05)。

Tab.5 Effect of reaglar on tailing rate and tailing length in comet assay in male rats from reproductive toxicology test
利用生殖毒性Ⅰ段试验的雌性大鼠做骨髓细胞彗星试验,表6结果显示,与阴性对照组比较,雄黄0.125,0.25和0.55 g·kg-1组的拖尾阳性率和拖尾长度均升高(P<0.05)。
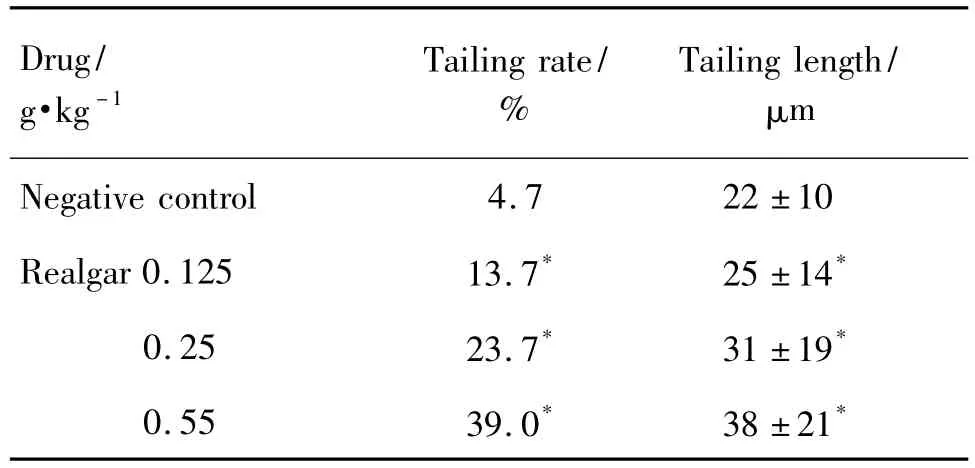
Tab.6 Effect of reaglar on tailing rate and tailing length in comet assay in female rats from reproductive toxicology test
3 讨论
雄黄是一味常用的矿物类中药,《中国药典》中收入的中成药中6.3%含有雄黄。近年来研究表明,雄黄有肝肾毒性和细胞毒性[3-4,9],但是对于雄黄是否有遗传毒性文献报道甚少,为此本研究进行了雄黄的遗传毒性研究。
小鼠骨髓细胞微核试验作为体内遗传毒性检测的首选方法广泛用于评价药物的潜在遗传毒性。彗星试验(单细胞凝胶电泳试验)因其简便、灵敏、客观性强和需要样品量少等优点,已被推荐为整体动物遗传毒性检测第二个靶器官的方法[10]。由于微核试验和彗星试验可在同一动物个体上取材进行试验,因而具有相互印证和互补性的优点,使实验结果更具可靠性。
利用多次重复给药试验,在给药结束阶段取材做体内遗传毒性试验,不仅节省大量的人力物力,减少动物用量,而且长期多次给药更符合中药复方的给药方式,暴露其遗传毒性,揭示潜在的遗传毒性风险,这对于中药的遗传毒性评价来说尤为重要,但是至今未见到此类报道。在一些试验中可以根据试验的特点,将重复给药和遗传毒性实验结合进行,在了解了药物的药理和药代等研究基础上,制定相关的实验方案,选择合适的靶器官分析,根据不同的情况来处理以符合二个实验的技术要求。
根据《中国药典》2005年版记载,雄黄成人用量为0.05~0.1 g。按成人临床最高用量0.1 g,成人按60 kg体质量计算约为1.67 mg·kg-1。在小鼠骨髓细胞微核试验和彗星试验中和利用大鼠生殖毒性Ⅰ段的微核试验和彗星试验中设计雄黄0.125,0.25和0.55 g·kg-1组分别相当于人临床最高等效剂量的12.5倍、25倍和50倍,不同之处在于小鼠仅连续ig给药2 d,而雄性大鼠连续ig给药42 d以上,雌性大鼠19 d以上。结果显示,无论是小鼠骨髓细胞微核试验和彗星试验,还是利用雄黄灌胃给药生殖毒性Ⅰ段试验大鼠大处理时取大鼠骨髓细胞微核试验和彗星试验,雄黄给药各剂量组与阴性对照组比较,微核率和彗星形成率上升,且有明显的量效关系,表明在此剂量条件下雄黄能引起染色体的损伤。
在重复给药试验中由于骨髓细胞的成熟分化进入外周血循环系统,从而可以利用外周血淋巴细胞进行微核检测。用外周血淋巴细胞进行微核试验具有取材方便、淋巴细胞在外周血停留时间长、微核容易判定,甚至可以活体动态连续地反映体内微核数的变化情况,故在重复给药的药物毒性试验中,可以考虑用外周血淋巴细胞微核试验判断药物对遗传物质的损伤作用。
本研究用短期给药(小鼠骨髓微核试验和彗星试验)和长期重复给药(利用生殖毒性Ⅰ段试验大鼠进行微核试验和彗星试验)组合来研究雄黄对小鼠和大鼠染色体的损伤作用,比较了不同给药方式对遗传毒性检出的影响,探讨结合多次重复给药的试验进行遗传毒性研究的可行性。本研究结果表明:①利用生殖毒性Ⅰ段试验多次给药后取材做微核试验和彗星试验在方法上是可行的,可以节省动物资源,更符合动物福利和3R原则;在剂量设计上更符合中药长期给药方式;②外周血微核试验结果显示在重复给药中具有采样方便、观察及判定容易的优点;③同一个体内微核试验和彗星试验的组合在评价药物体内遗传毒性中具有相互印证和互补性;④在设计的剂量下雄黄具有遗传毒性。上述结果可为今后利用重复给药的长期毒性试验或生殖毒性Ⅰ段试验做遗传毒性评价提供试验依据。
[1]Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia(中国药典)[M]∥Beijing:Chemical Industry Press,2005:307.
[2]Bai B,Li XF,Yang K,Song YJ,Sun Y,Ding GH.Pharmacokinetics and toxicokinetics of arsenic after oral administration of realgar in rats[J].China Pharmacist(中国药师),2010,13(5):626-629.
[3]Zhang YM,Ji SF,Cai LZ,Xie FQ,Liu M.The toxicology compared with realgar and realgar prepared with leben fly[J].J Changchun College Trad Chin Med(长春中医学院学报),2000,16(1):46.
[4]Li GM,Liu DQ,Zhang XJ.The effect of nephritic morphology in mice of realgar[J].Hebei Med J(河北医药),2002,24(1):60.
[5]Ye HQ,Gan L,Yang XL,Xu HB.Membrane-associated cytotoxicity induced by realgar in promyelocytic leukemia HL-60 cells[J].J Ethnopharmacol,2006,103(3):366-371.
[6]Yuan BJ,Liao MY,Li B.Drug Toxicological Method and Technology(药物毒理学实验方法与技术)[M]∥Beijing:Chemical Industry Press Biomedical Publication Branch,2007:293.
[7]Cao J,Lin Z,Yu ZP.Micronucleus Test(微核试验)[M]∥Beijing:Military Medical Science Press,2000:92-94.
[8]Singh NP,McCoy MT,Tice RR,Schneider EL.A simple technique for quantitation of low levels of DNA damage in individual cells[J].Exp Cell Res,1988,175(1):184-191.
[9]Peng DH,Jiang Y,Peng KL.The experiment test of single cell gel eletrophoresis[J].Hubei J Prevent Med(湖北预防医学杂志),1998,9(1):54-55.
[10]ICH:International Conference on harmonization of requirements for registration of pharmaceuticals for human use(ICH)S2(R1)[EB/OL].[2011-04-15]http://www.ich.org/products/guidelines/safety/article/safetyguideline.html
Genotoxicity of realgar by in vivo micronucleus test and comet assay
WU Wen-bin,ZHANG Chao-chao,TANG Jia-ming
(Center of Laboratory Animal,Shanghai University of Traditional Chinese Medicine,Shanghai201203,China)
OBJECTIVETo detect the genotoxicity of realgar by using short-term administration(mouse bone marrow cell micronucleus test and comet assay)and long-term administration(rat bone marrow cell micronucleus test and comet assay in which bio-samples were collected from reproductive toxicity test),and to study the possibility of detecting genotoxicity of realgar integrated with reproductive toxicity test.METHODSMice were ig administered with realgar suspension 0.25,0.5,and 1.0 g·kg-1for 2 d,before being sacrificed.Bone marrow cells were collected for micronucleus tests and comet assay.During early embryonic development,rats were ig given realgar 0.125,0.25 and 0.55 g·kg-1.The administration lasted at least 42 d for male rats and 19 d for females before they were allowed to mate.After mating successfully,the male rats were sacrificed the next day and the female rats on the 15th day of pregnancy.Then the bone marrow cells and peripheral blood lymphocytes were collected for micronucleus tests and comet assay.RESULTSCompared with negative control group,the micronucleus rate in bone marrow cells with realgar 0.25,0.5 and 1.0 g·kg-1groups was 3.00‰,4.40‰and 7.01‰,respectively.The tailing rate was 6.3%,9.7%and 11.3%,respectively(P<0.05,P<0.01).In reproductive toxicity rats,the micronucleus rate and lymphocyte micronucleus rate in peripheral blood of male rats with realgar 0.55 g·kg-1group were 2.83‰and 6.67‰while those of female rats with realgar 0.25 and 0.55 g·kg-1groups were 1.5‰and 2.25‰,2.58‰and 4.40‰,respectively.The comet tailing rate in realgar 0.125,0.25 and 0.55 g·kg-1group had significant differences(P<0.05).CONCLUSIONIt is feasible to integrate the in vivo micronucleus test and comet assay into reproductive toxicity tests.Micronucleus tests in peripheral blood lymphocytes are simple.Realgar has genotoxicity at the designed doses.
realgar;micronucleus test;comet assay;mutagenicity test
The project supported by National Mega-project of Science Research of China(2009ZX09502-002)
TANG Jia-ming,E-mail:tangjiaming@hotmail.com,Tel:(021)51322647
R285.1,R394.6
A
1000-3002(2012)04-0550-05
10.3867/j.issn.1000-3002.2012.04.015
国家重大新药创制科技重大专项资助项目(2009ZX09502-002)
吴文斌(1980-),男,助教,主要从事中药毒理学研究,E-mail:wuwenbin2827@sina.com
汤家铭,E-mail:tangjiaming@hotmail.com,Tel:(021)51322647
2011-11-04接受日期:2012-04-24)
(本文编辑:付良青)
