基于LC-MS/MS技术对蓝藻Gloeobacter violaceus PCC 7421细胞膜的蛋白质组学研究
2012-01-12王秀秀
王秀秀, 章 军
(1. 福建省陆海界面生态环境重点实验室, 厦门大学 环境与生态学院, 福建厦门 361005; 2. 厦门大学 生命科学学院,福建厦门, 361005)
基于LC-MS/MS技术对蓝藻Gloeobacter violaceusPCC 7421细胞膜的蛋白质组学研究
王秀秀1, 章 军2
(1. 福建省陆海界面生态环境重点实验室, 厦门大学 环境与生态学院, 福建厦门 361005; 2. 厦门大学 生命科学学院,福建厦门, 361005)
Gloeobacter violaceusPCC 7421是一种在进化上很古老的无类囊体蓝藻, 由于光合作用电子传递链与呼吸系统在其细胞质膜上共存, 这两个系统可能会共享一些元件, 为研究其光合作用系统结构的独特之处, 应用高效液相色谱-串联质谱联用(LC-MS/MS)技术对其细胞膜蛋白进行蛋白质组学分析。经鉴定发现,G. violaceus的细胞质膜上具有PSⅠ、PSⅡ和细胞色素b6等光合作用关键蛋白, 同时具有呼吸作用过程中的关键酶1,5-二磷酸羧化酶/加氧酶、F0F1- ATP酶α和β亚基、细胞分裂蛋白、硝酸盐/亚硝酸盐转运蛋白、青霉素结合蛋白以及多种药物受体ABC转运蛋白。由此可知,G. violaceus的细胞质膜不仅能够同时进行光合作用和呼吸作用, 且营养盐运输等转运功能也同时存在。G. violaceus的全基因数据分析显示其基因序列具有独特性, 其蛋白注释相对比较少, 因此其蛋白功能的研究需要更多数据的支持。
Gloeobacter violaceusPCC 7421; LC-MS/MS; 细胞质膜
蛋白质组学是近年来在海洋生物中的研究热点,在细菌[1]、贝类[2]、节肢动物[3]和赤潮藻类[4]方面都有广泛的应用。Gloeobacter violaceusPCC 7421是一种古老的无类囊体自养蓝藻, 16S rDNA分子发育树分析表明, 它是蓝细菌与叶绿体在分枝之后最早的生物[5]。它具有一系列的独一无二的特性:它没有类囊体膜, 而且显微镜观察发现光合作用元件定位在其细胞质膜上[6], 其细胞质膜不仅是细胞与外界进行物质交换的半透性屏障, 还是其光合作用的场所。由于光合作用电子传递链与呼吸系统在其细胞质膜上共存, 这两个系统可能会共享一些元件[7], 例如质体醌(PQ)等, 且两种系统的电子传递链可能重叠[8]。因此该藻细胞质膜蛋白质种类及其定位的选择必然具有其重要的生物学意义, 其光合作用系统的结构和功能必然有其独特之处。因此进行G. violaceus细胞质膜蛋白的蛋白质组学分析是十分有意义的。
高效液相色谱-串联质谱联用 (LC-MS/MS) 技术是近年来广泛使用的高通量高灵敏度的蛋白质组学分析方法, 在定量分析和低丰度蛋白的分离分析方面, LC-MS/MS比起双向电泳技术为基础的凝胶水平的分离分析更加便利和准确[9]。因此, 我们运用LC-MS/MS技术对G. violaceus细胞质膜上蛋白进行蛋白质组学研究, 用以揭示其细胞质膜上相关蛋白质的种类, 为今后的蛋白功能和定位研究提供数据支持。
1 材料与方法
1.1 藻类的培养
G. violaceusPCC 7421由厦门大学生命科学学院微藻分子与基因工程实验室保存。将G. violaceusPCC 7421按1∶50的比例接种于新鲜配制的BG-11培养基中, 28 ℃静置培养, 24 h连续光照, 光照强度为 80 μmol/(m2·s), 到对数生长期时收集藻体用于提取膜蛋白。
实验中使用的所有水均为Milli-Q水, 所有试剂均为分析纯, 乙腈(ACN)为色谱纯, 胰酶(Sigma公司)为测序纯。
1.2 膜蛋白的提取
将200 mL对数期藻细胞于Beckman 高速冷冻离心机中离心收集, 条件为8 000g, 4 ℃, 离心时间为 10 min。离心结束后去上清, 用无菌的生理盐水(0.85%)重悬沉淀后再次离心收集, 条件同上。离心结束后取沉淀, 将沉淀在缓冲液中进行超声波破碎,当镜检后 99%的细胞无细胞结构后停止。细胞破碎后, 离心去除未破碎的细胞, 离心条件为12 000g, 4℃, 离心时间 10 min, 离心结束后取上清即为细胞全蛋白样品。
膜蛋白的提取方法依据Gutmann的方法进行[10]。在 Beckman超速离心机中, 将全细胞蛋白样在100 000g, 4 ℃, 离心时间为40 min的条件下离心,离心结束后将上清尽量去除干净, 取沉淀即为膜蛋白粗样。将膜蛋白粗样在20 mL预冷的10%三氯乙酸-丙酮中沉淀,于–20 ℃冰箱中沉淀过夜,去除色素等干扰组分。期间数次漩涡振荡, 尽量使沉淀在三氯乙酸-丙酮中分布均匀。沉淀结束后离心收集沉淀,条件为12 000g, 4 ℃, 离心时间20 min。离心结束后用预冷的丙酮重悬沉淀, 再次离心取沉淀, 条件同上。多次重复直至上清为无色, 即认为色素等干扰物已经去除干净, 将沉淀在超净工作台中吹干, 即为膜蛋白样品。
1.3 酶切
将干燥的蛋白溶解于200 μL的含有6 mol/L盐酸胍, 50 mmol/L Tris溶液中(pH 8.3), 然后加入2 μL的1 mol/L二硫苏糖醇(DTT)。混合物在37 ℃孵育2.5 h, 然后加入 10 μL的0.8 mol/L 碘乙酸(IAA)溶液, 避光室温孵育40 min。在此之后, 高速冷冻离心机内在11 000g, 6℃, 90 min条件下将蛋白溶液通过3 K超滤管(Millipore公司), 并交换到50 μmol/L碳酸氢氨溶液中(pH 8.5), 并加入 15 μg胰蛋白酶在37 ℃孵育过夜。未酶切的蛋白和胰蛋白酶通过10 K超滤管去除(条件同上)。消化的多肽混合物在冷冻离心干燥后溶解在 20 μL 0.5%的甲酸(FA)溶液中, 其中10 μL用于质谱分析。
1.4 LC-MS/MS方法鉴定膜蛋白
液相色谱-电喷雾线性离子阱质谱(LC-ESI-MS)分析使用LTQ (ThermoFisher Scientific)质谱仪。色谱分析柱为75 µm ID, 10 cm长的C18反相柱, 流动相为 A:0.1% FA/H2O, B:0.1% FA/ACN, 分流前流速为120 μL/min, 分流后为 2 μL/min。ESI针电压为 3.0 kV,归一化碰撞能量为 35%。数据采集使用数据依赖模式, 包括一个完整的 MS扫描, 核质比从 400到1 800, 收集10个最高丰度的离子进行碰撞诱导解离,得到二级谱图用于多肽鉴定。动态排除参数为:重复计数2次, 重复时间30 s, 排除期120 s。
1.5 数据库搜索
串联质谱数据采用 SEQUEST算法, 在G.violaceusPCC 7421全基因组FASTA数据库中进行搜索, 假阳性率为≤1%。
1.6 蛋白功能注释以及亚细胞定位网址
蛋白功能Uniprot数据库中注释, 蛋白亚细胞定位在PSORTb(版本3.0.2)网站搜索。
2 结果与分析
2.1 LC-ESI-LTQ质谱谱图
G. violaceus的LC-ESI-LTQ谱图如图1所示, 从图中可以看出,G. violaceus蛋白分离清晰, 信号强度较高, 蛋白分离效果良好, 且存在数个高丰度蛋白。

图1 G. violaceus PCC 7421膜蛋白液相色谱图Fig. 1 LC-ESI-LTQ maps of membrane proteins of G.violaceus PCC 7421
2.2 质谱鉴定结果
经过数据库搜索, 共鉴定出 36种(38个)G.violaceus蛋白, 见表1所示。
2.3 蛋白亚细胞定位
分析得到的蛋白的亚细胞定位如图2所示, 经过在线程序 PSORTb(版本 3.0.2)的亚细胞定位分析,分离得到的蛋白中 54%的蛋白为质膜蛋白(21个),31%的蛋白为胞浆蛋白(11个), 15%的蛋白为未知定位的蛋白(6个)。
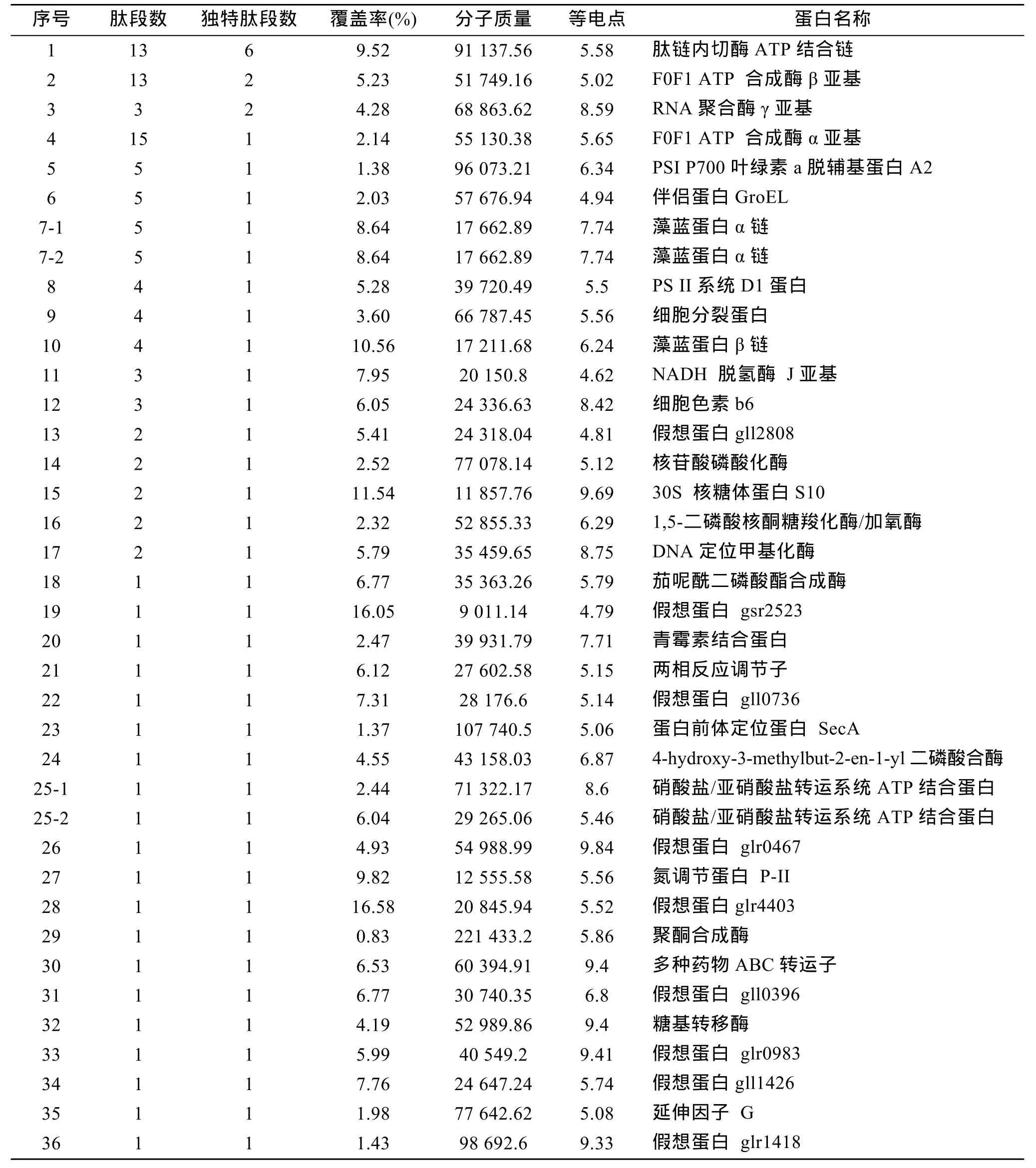
表1 G. violaceus PCC 7421膜蛋白LC-ESI-LTQ鉴定结果Tab. 1 LC-ESI-LTQ results of membrane proteins of G. violaceus PCC 7421
在质膜蛋白中包含PSⅠ的A2蛋白, PSⅡ的D1蛋白, 细胞色素b6, 全部的ATP相关蛋白(3个)、细胞分裂蛋白、硝酸盐转运蛋白、信号转导蛋白以及聚酮合成酶和糖基转移酶等。胞浆蛋白中主要包括1,5-二磷酸核酮糖羧化酶/加氧酶、核苷酸磷酸化酶、RNA合成酶和核糖体亚基。
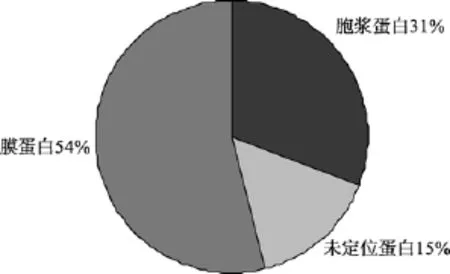
图2 已鉴定蛋白亚细胞定位分布图Fig. 2 Subcellular localizations of the identified proteins
2.4 蛋白动能分类
根据蛋白功能分类, 将蛋白分为 11类, 如图3所示:
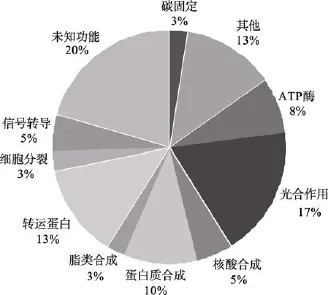
图3 细胞质膜已鉴定蛋白功能分布图Fig. 3 Functions of the identified membrane proteins
如图3所示, 已鉴定的蛋白中根据功能分类, 主要为光合作用相关蛋白(7个)、碳固定相关蛋白(1个)、转运蛋白(5个)、ATP酶(3个)、蛋白质合成相关蛋白(4个)、核酸合成相关蛋白(2个)、脂类合成相关蛋白(1个)、信号转导相关蛋白(2个)、细胞分裂相关蛋白(1个)、其他功能(5个)以及未知功能蛋白(8个)。
3 讨论
双向电泳是蛋白质组学最早使用的分离技术,但是由于它对碱性端的蛋白分离效果比较差, 特别是对低丰度蛋白的分离效果有限, 更加凸显了LC-MS/MS方法的优势, 如图1所示, LC-ESI/LTQ质谱的结果比较理想, 分离得到的蛋白强度较高, 分离效果较好, 且鉴定得到的蛋白其等电点从4.62~9.84, 分子量从9 kD到221 kD, 分布非常宽泛(表1), 这种方法的精度高且对碱性蛋白的分离效果好, 再加上二级质谱对低丰度蛋白具有很好的信号放大作用, 操作简便, 且省时省力, 因此利用LC-MS/MS法在蓝藻膜蛋白的分离鉴定方面非常可行。由于LC-MS/MS的方法是在蛋白分离之前酶解,免除了在割胶时可能带进去污染的问题, 但也造成了分析质谱结果时的假阳性增高的缺点, 因此在数据分析时必须严格设定搜库条件, 假阳性率为≤1%,提高数据可信度。
蓝藻中含量最大的蛋白是藻蓝蛋白, 从图3可以看出, 使用超速离心的方法可以富集膜蛋白, 去除大部分藻蓝蛋白。提取得到的G. violaceusPCC 7421的膜蛋白中经鉴定膜蛋白的比率为 54%, 主要是光合作用相关蛋白、ATP酶以及转运蛋白等。胞浆蛋白占所提取蛋白中的 31%, 主要是与核酸和蛋白质合成过程有关的蛋白, 同时也有部分胞浆蛋白是与光合作用相关的蛋白, 如 1,5-二磷酸核酮糖羧化酶/加氧酶, 这一酶蛋白本身是没有跨膜结构的,它们很可能是在执行功能时附在膜上而同时被分离出来。
2003年 Nakamura的基因组数据报道[7],G.violaceus具有4 324个可编码蛋白的基因, 其中仅有1 301个基因与其他蓝藻具有相似性, 并且其中610个基因为蓝藻特有基因(在已知基因组数据的蓝藻,包括Synechocystissp. PCC 6803,Anabaenasp. PCC 7120和Thermosynechococcus elongatusBP-1中), 高达一半的基因是未知功能的基因。因此,G. violaceus的基因注释比较困难。根据G. violaceus的液相谱图来看, 我们提取到的蛋白种类丰富, 但全范围二级质谱后匹配得到的蛋白只有38个(36种), 比预想的数据低, 且 15%的蛋白为假想蛋白(6/38), 这一结果可能是由于G. violaceus的基因信息比其他模式蓝藻少, 又兼其基因序列的独特性, 它的全基因组序列注释工作比较困难, 因此可供查询的蛋白质序列库的信息不全, 因此对G. violaceus基因和蛋白质序列的生物信息学研究和实验需要更大力度地开展, 用以解开这一古老生物的蛋白编码之谜。
2003年G. violaceusPCC 7421的全基因组序列的公布, 对G. violaceus的具有光合系统的质膜的研究成为一个热点。Inoue等[11]发现G. violaceus的PSⅠ中含有 9个亚基, 其他蓝藻含有 12个亚基, 其亚基的数量较其他蓝藻相比有所减少, 并具有独特的PsaZ亚基。同时, 其PSⅠ第二个电子受体是甲基萘醌类, 而不是常见的叶绿醌[12]。Mimuro[12]发现在–196℃下,G. violaceus的光合作用复合物缺乏PSⅠ的叶绿素荧光, PSⅡ是独特的可以利用光能氧化两分子水产生一份子氧气的蛋白复合物。Koyama等[13]发现虽然G. violaceus的PSⅡ系统的蛋白氨基酸序列有所变化, 并且在细胞质膜上进行, 但是最基本的水氧化反应过程是高度保守的。Sicora等[14]研究发现G. violaceus具有5个PSⅡ的D1蛋白(psbA)基因,并且会调动至少其中 3个支持其 PSⅡ的修复循环,并且可以快速清除没有光活性的D1蛋白。我们的结果同时鉴定到了PSI的A2蛋白和PSⅡ的D1蛋白,没有鉴定到PsaZ蛋白, 可能是因为蛋白浓度丰度较低。也只鉴定出一种D1蛋白, 可能是由于鉴定得到的肽段是5种 D1蛋白的相同功能结构域中的蛋白,鉴定得到5种不同的D1蛋白可能需要具体的分离纯化得到PSⅡ蛋白复合体再进行蛋白的种类鉴定。1,5-二磷酸核酮糖羧化酶/加氧酶是与呼吸作用有关的酶。它是光合作用中卡尔文循环里催化第一个主要的碳固定反应, 将大气中游离的二氧化碳转化为生物体内储能分子, 它所催化的反应是无机态的碳进入生物圈的主要途径[15]。茄呢酰二磷酸酯合酶的催化产物辅酶 Q(ubiquinone)结合蛋白质的辅基(或辅酶)部分, 在呼吸链上不断地被氧化和还原, 起着传递氢(递氢体)或电子(递电子体)的作用[16]。核糖体蛋白鉴定出30S小亚基一个蛋白, 硝酸盐/亚硝酸盐转运蛋白、ABC转运蛋白等典型质膜蛋白也有得到鉴定。
综上所述, 我们的鉴定结果包含了G. violaceus光合作用系统、呼吸作用系统和电子传递链的关键蛋白, 以及藻蓝蛋白和别藻蓝蛋白等光捕获蛋白亚基, 核糖体亚基, 转运蛋白亚基, 以及有关蛋白质合成、核酸合成、脂类合成、信号转导、细胞分裂和代谢相关的多种功能的蛋白, 为今后G. violaceus膜蛋白质组学的研究进行了初步的探索, 有待于今后开展更深入的研究解决这些问题。
[1]吴谋胜, 王三英, 彭宣宪. 温度对嗜水气单胞菌蛋白质表达的影响[J]. 海洋科学, 2002, 26(5):68-71.
[2]田美, 申欣, 程汉良等. 西施舌外套膜蛋白质组双向电泳体系的构建[J]. 海洋科学, 2009, 33(11):32-36.
[3]周茜, 吴长功, 刘凤岐等. 中华卤虫无节幼体蛋白质组的双向凝胶电泳分析[J]. 海洋科学, 2008, 32(7):62-64.
[4]钱方, 朱斌琳, 章军. 蛋白质组学研究在赤潮藻研究中的应用[J]. 海洋科学, 2006, 30(5):83-86.
[5]Honda D, Yokota A, Sugiyama J. Detection of seven major evolutionary lineages in cyanobacteria based on the 16S rRNA gene sequence analysis with new sequences of fi ve marineSynechococcusstrains[J], J Mol Evol, 1999, 48:723-739.
[6]Rippka R, Waterbury J, Cohen-Bazire G. A cyanobacterium which lacks thylakoids[J], Arch Microbiol, 1974,100:419-436.
[7]Nakamura Y, Kaneko T, Sato S, et al. Complete genome structure ofGloeobacter violaceusPCC 7421, a cyanobacterium that lacks thylakoids[J]. DNA Res,2003, 10(4):137-145.
[8]Peschek G A, Obinger C, Paumann M. The respiratory chain of blue green algae (cyanobacteria)[J]. Physiol Plant, 2004, 120:358-369.
[9]Jemal M. High-throughput quantitative bioanalysis by LC-MS/MS[J]. Biomed Chromatogr, 2000, 14:422-429.
[10]Gutmann D A, Mizohata E, Newstead S, et al. A high-throughput method for membrane protein solubility screening:the ultracentrifugation dispersity sedimentation assay[J]. Protein Sci,2007, 16:1422-1428.
[11]Inoue H, Tsuchiya T, Satoh S, et al. Unique constitution of photosystem I with a novel subunit in the cyanobacteriumGloeobacter violaceusPCC 7421[J]. FEBS Lett,2004, 578:275-279.
[12]Mimuro M, Tsuchiya T, Inoue H, et al. The secondary electron acceptor of photosystem I inGloeobacter violaceusPCC 7421 is menaquinone-4 that is synthesized by a unique but unknown pathway[J], FEBS Lett,2005, 579:3493-3496.
[13]Koyama K, Suzuki H, Noguchi T, et al. Oxygen evolution activities in the periplasm of cyanobacteriumGloeobacter violaceusPCC 7421[J]. Biochim Biophys Acta, 2008,1777:369-378.
[14]Sicora C I, Brown C M, Cheregi O, et al. The psbA gene family responds differentially to light and UVB stress inGloeobacter violaceusPCC 7421, a deeply divergent cyanobacterium[J]. Biochim Biophys Acta,2008, 1777:130-139.
[15]Estep F M, Tabita R F, Parker L P, et al. Carbon isotope fractionation by ribulose-1,5-bisophosphate carboxylase from various organisms[J], Plant Physiol, 1978,61(4):680-687.
[16]Ernster L, Dallner G. Biochemical, physiological and medical aspects of ubiquinone function[J]. Biochimica et Biophysica Acta, 1995, 1271:195-204.
LC-MS/MS analysis of plasmic membrane proteins inGloeobacter violaceusPCC 7421
WANG Xiu-xiu1, ZHANG Jun2
(1. Fujian Provincial Key Laboratory of Coastal Ecology and Environmental Studies,College of the Environment and Ecology, Xiamen University, Xiamen 361005, China; 2. Collge of life Science, Xiamen University, Xiamen 361005, China)
Apr.,10,2012
Gloeobacter violaceusPCC 7421; LC-MS/MS; plasma membrane
Gloeobacter violaceus, which lacks thylakoids, is the earliest branched cyanobacteria in the phylogenetic tree. Photosynthetic and respiratory systems coexist in its plasma membrane. To study of feature of the protein location of photosynthetic and respiration systems, we isolated and used LC-MS/MS to analyze plasma membrane proteins ofG. violaceusPCC 7421. The results showed this species had critical photosynthetic reaction center complexes proteins, such as photosystem II protein D1, photosystem I P700 chlorophyllaapoprotein A2, cytochrome b6, and allophycocyanin beta subunit. The ribulose bisophosphate carboxylase was also identified. The ATP synthesis subunits, cell division proteins and nitrate transporters were identified at the same time. Therefore, the plasma membrane not only could carry out photosynthesis and respiration, the nutrient transport and other transport function also existed. Because of the low similarity of its gene with other organisms, many proteins were difficult to be annotated.
Q946 文献标识码:A 文章编号:1000-3096(2012)09-0039-06
2012-04-10;
2012-07-11
福建省自然科学基金项目(2010J01232)
王秀秀(1982-), 女, 河北张家口人, 博士研究生, 主要研究方向为分子生态学, E-mail:xiuxiuwang0420@126.com; 章军, 通信作者, 副教授, 研究方向为微藻基因工程及蛋白质组学, E-mail:jzhang@xmu.edu.cn
张培新)
