环境因子对好氧不产氧光合细菌脂肪酸组成的影响
2012-01-12邹丽洁焦念志
邹丽洁, 焦念志
(厦门大学 环境科学研究中心 海洋环境科学国家重点实验室, 福建 厦门361005)
环境因子对好氧不产氧光合细菌脂肪酸组成的影响
邹丽洁, 焦念志
(厦门大学 环境科学研究中心 海洋环境科学国家重点实验室, 福建 厦门361005)
对赤杆菌属(Erythrobacter)、柠檬酸微菌属(Citromicrobium)和玫瑰杆菌(Roseobacter)分支的 9株好氧不产氧光合细菌(AAPB)的脂肪酸组成进行分析, 并以10株非AAPB菌为参照, 从脂肪酸角度考察光照、温度、营养等重要环境因子对AAPB的影响。结果显示, AAPB的脂肪酸以C18:1w7c为主, 该成分在Roseobacter分支中含量最高, 不同种脂肪酸对环境因子的响应不同, 低温和寡营养条件主要作用于不饱和脂肪酸(UFA); 二羟基脂肪酸在寡营养和光照双重作用下有较明显的升高。此外, 结合非AAPB的比较也为 AAPB脂肪酸研究提供了新的视角, 如温度实验显示, 由于不饱和脂肪酸的比例较高, AAPB可能在寒冷海域有更好的竞争优势, 而从饥饿培养试验来看, AAPB的异养能力似乎比非AAPB更弱。
好氧不产氧光合细菌; 脂肪酸; 环境因子
好氧不产氧光合细菌(Aerobic Anoxygenic Phototrophic Bacteria, AAPB)在海洋中广泛分布, 是能够利用光能推动质子泵产生 ATP的异养细菌类群,这类细菌的光合作用能减少异养呼吸代谢过程中CO2的释放, 增加保存于真光层的有机碳。到目前为止, 已报道的AAPB类群包括33个属的52个种[1],随着对这类细菌的分布和生态意义的深入研究[2-4],该类群的生理生态多样性也被广泛揭示:具有光合能力的“Citromicrobium”属的AAPB被发现于没有光照的深海热液口[5], 该属细菌JL354的基因组中存在两套光合操纵子[6];Roseobacter分支的情况更为复杂, 它们占据多样的生态位, 利用的有机物类型广泛, 个体间异养能力差异很大[7-9]。尽管如此, 环境因子对这几类 AAPB都有显著的调控作用:寡营养条件能刺激细胞进行反馈调控, 诱导puf操纵子的表达以合成更多细菌叶绿素[10](Bacteriochlorophyll,BChl); 温度可直接影响细胞内各种酶类的活性而影响细菌整个生理代谢过程, AAPB的生态分布与温度的相关性得到了 Sargasso Sea和东海等生态调查的支持[11-12]; 光照主要影响细菌的光合能力, 对长赤细菌(Erythrobacterlongus)、玫瑰杆菌(Roseobacter denitrificans)等多株AAPB的培养实验均证明瞬时光照可刺激细菌生长, 甚至光暗周期的比例也能影响细菌叶绿素的合成[13-16]。由此可见, 自然海区环境的复杂性使AAPB进化出多样的适应机制。
生命过程是形成海洋碳库的重要环节, 微食物环概念的提出更突出了微生物对海洋溶解有机质的分流改造作用, 因此不同环境条件下微生物生理指标的研究必不可少。脂肪酸作为细胞膜的重要组成成分对外界环境变化敏感, 常被用作评估微生物生存状态的指标[17-18], 脂肪酸对温度的响应主要有两种形式, 一方面通过结构变化调整相变温度, 维持细胞膜的流动性, 另一方面, 脂肪酸可以参与蛋白修饰调控, 如在光修复过程中脂肪酸能够加速D1蛋白的合成[19]。已有的研究显示本实验涉及的 AAPB种属含不饱和脂肪酸(Unsaturated fatty acids, UFAs)的比例较高[20], 杨等[21]还报道了一种特殊的脂肪酸并认为这可能是AAPB所特有的。然而到目前为止, AAPB这个功能类群的脂肪酸研究主要集中在菌株的脂肪酸组成及生物合成, 与环境因子相关的报道很少, 本文即以此为出发点, 结合非AAPB(非AAPB是指遗传上与AAPB相近但缺乏puf基因而不具备光合能力的类群)一起探讨AAPB的脂肪酸如何响应环境变化。
1 材料和方法
1.1 菌株信息及培养条件
菌株信息如表1所列。根据16S rDNA序列, 所选菌株分别属于Erythrobacter,“Citromicrobium”和Roseobacter分支。
细菌在28℃的RO平板上黑暗培养。培养基为:酵母浸膏 1.0 g/L; 蛋白胨 1.0 g/L; 乙酸钠 1.0 g/L;维生素(B12:20 µg/L; Biotin:2.05×10-9mol/L)、微量元素及15%琼脂。细胞在接近平台期收获, 整个培养过程大约需要 4~5 d。除了正在考察的环境因素随实验设计变化外, 其他所有菌株均在上述标准化的培养条件下生长。
1.2 脂肪酸提取和分析
脂肪酸检测采用 MIDI方法(Microbial Identification System 6.0), 收获和提取步骤按照 Sherlock MIS公司提供的标准操作流程执行, 具体如下:

表1 实验用菌株信息Tab. 1 Information of the studied strains
收获:从四分划线培养的平板上的第三分区上取约40 mg的菌体细胞放入洁净培养管中;
皂化:每管加入 1.0 mL试剂 1(45g氢氧化钠,150 mL甲醇, 150 mL蒸馏水), 盖子密封, 振荡后沸水浴30 min;
甲基化:培养管冷却后加入2 mL试剂2(325 mL 6.0 mol/L盐酸, 275 mL甲醇), 加盖后短暂振摇, 80℃水浴10 min;
抽提:管子冷却后加入1.25 mL试剂3(200 mL乙烷, 200 mL甲基-3-丁基醚), 封盖后在医用摇台上轻轻翻转10 min左右, 开盖将管底的水相部分抽出抛弃;
碱洗:在有机相中加入3 mL试剂4(0.3 mol/L氢氧化钠溶液), 翻转5 min后取2/3有机相加入气相色谱管中待测。
脂肪酸成分分析采用配备氢火焰离子化检测器(FID)和 Ultra²2色谱柱的 Agilent 6850气象色谱仪,通过样品出峰峰值及保留时间与标准样品(MIDI,Inc.)的比较来确定脂肪酸的种类及相对含量, 借助MIDI公司提供的菌种库信息可进行细菌种属鉴定。
1.3 数据分析
脂肪酸组成的统计学分析采用 Past软件(PAlaeontological STatistics, ver. 1.34), 16s rDNA序列经Clustal X(1.8)比对后用Mega3.1软件进行NJ法聚类和建树。脂肪酸聚类分析由MIS Sherlock软件完成。Erythrobacter litoralisHTCC2594的基因组信息来自 KEGG (Kyoto Encyclopedia of Genes and Genomes)。
2 结果
2.1 细胞脂肪酸组成
本文对19株细菌进行了脂肪酸检测, 结果显示这些细菌共含有56种不同的脂肪酸成分, 链长从9碳到20碳不等, 大部分种类集中在14碳至18碳, 支链脂肪酸及二羟基脂肪酸也比较常见。表2列举了部分主要脂肪酸的检测结果, C14:0,C16:0及 C18:0等饱和偶碳链脂肪酸类型为绝大多数菌株共有。从脂肪酸比例上看,C18:1、C18:0、C16:0为所测菌株的主要脂肪酸, 其中 C18:1w7c含量较高, 在AAPB及非AAPB中分别占63.45% 和48.93%。检测的19株菌中有18株含有C18:1w7c11-methyl,该成分也是α-变形菌中常见的种类[20]。此外, AAPB脂肪酸组成中还包括一些奇数脂肪酸如 C17:0, C17:1及少量环式脂肪酸如 C19:0cyclow8c。

表2 脂肪酸检测主要结果Tab. 2 Main Results of Cellular Fatty Acid Compositions
从检测结果来看脂肪酸组成与系统分类密切相关,Roseobacter分支的显著特点是含有较多不饱和脂肪酸(均值为82.93%), 尤其是C18:1w7c的比例达到61.12%到88.33%, 这类物质被认为是α-变形菌纲的典型脂肪酸[22], 从检测值看C18:1w7c在AAPB菌中的均值达到为77.2%, 高于非AAPB的64.17%(p=0.034), 而 C16:0则表现出相反的趋势。Erythrobacter和“Citromicrobium”含羟基脂肪酸种类较多, 以 14碳至 16碳的二羟基饱和脂肪酸为主,这可能与这两个属含有鞘糖脂有关。二者在不饱和脂肪酸含量上并没有显著差异。
图1比较了基于16s rDNA和基于脂肪酸组成所构建的系统进化树, 从进化距离分析,Roseobacter分支的菌株在脂肪酸建树上聚类较接近而在 16s rDNA树上进化距离较远,Erythrobacter的菌株则相反, 这种差异在JL1033和JL990的比较中更为明显,虽然两株菌的16s rDNA非常相似, 但脂肪酸组成差异显著:JL990具有较多的支链脂肪酸, 而总不饱和脂肪酸比例比JL1033低30%。16s rDNA的聚类建立在基因水平上而脂肪酸建树体现的是表达水平的聚类, 这两者的差异是进化过程中不同的环境压力和细菌适应性造成的, 因此我们建议在以16s rDNA为主要参考指标的系统进化研究中应当结合功能基因的分析, 才能得到更准确的推断。
2.2 温度、光照及营养的影响
温度实验用到三株非 AAPB和四株 AAPB菌,设置的温度梯度为12℃ , 20℃, 28℃。结果显示, 较低的温度能够增加 AAPB的不饱和脂肪酸的比例,降低 C16:0和 C18:0, 而支链脂肪酸、正反式脂肪酸等没有显著变化。图2显示的是12℃ , 20℃相对于28℃时细菌总不饱和脂肪酸的变化率。AAPB的变化幅度为2.5% 到12.7%, 平均5.8%, 其中发生主要变化的成分是 C18:1w7c; 非 AAPB 对低温的响应方式与AAPB类似但不饱和脂肪酸的变化幅度较大, 为9.2% 到 47.3%, 均值 20.3%, 其中 C16:1是主要变化成分。此外大部分菌株的二羟基脂肪酸在低温时比例下降, 这与Sphingomonassp.等的报道一致。
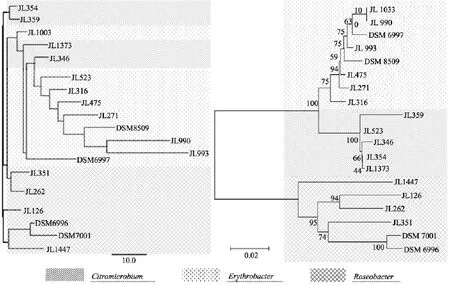
图1 基于脂肪酸组成(左)和基于16s rDNA(右)构建的系统进化树比较Fig. 1 Comparison of fatty acid-based (left) and 16S rDNA-based (right) neighbor-joining phylogenetic trees.

图2 不同温度下细菌总不饱和脂肪酸的相对变化率Fig. 2 Change rates of total unsaturated fatty acids (UFAs)at different temperatures
光照的响应主要是通过比较持续光照和持续黑暗两种处理方式对细菌脂肪酸的影响来考察。然而实验发现在 RO培养基充足的营养条件下两种处理方式没有显著的差别。考虑到海洋细菌普遍长期处于营养限制环境中, 因此本文也观测了 AAPB脂肪酸随营养物质消耗的变化, 采用的菌株为 AAPB菌JL475和非AAPB菌 JL316, 实验方案为:细菌在标准的RO液体培养基中预培养3d以耗尽培养基中的营养物质, 随后取100 mL培养物与400 mL灭菌海水混合, 24 h后一半培养物进行光照处理, 另一半继续黑暗培养。结果显示, JL316的不饱和脂肪酸在整个培养过程中保持稳定而AAPB菌的UFA%逐渐下降, 该趋势在20 h后更加明显, 至培养结束时AAPB的 UFA%共减少了 28%, 其中变化最大的成分是十八碳不饱和脂肪酸(图3)。光照的引入并没有对脂肪酸整体组成产生显著影响, 但值得关注的是羟基脂肪酸的变化, JL475光照培养体系(JL475L)的主要羟基脂肪酸C14:02OH的比例从开始的8.7%上升至13.1%最后回到9.2%(图4), 在引入光照的18 h内有50%的增长, 而对照组JL475黑暗培养体系(JL475D)以及JL316的光(JL316L)、暗(JL316D)培养中都没有观察到这种现象。
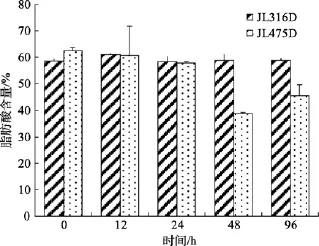
图3 随营养消耗 18碳不饱和脂肪酸含量的时间序列曲线Fig. 3 Time serial contents of 18-carboned UFAs under nutrient deficiency.
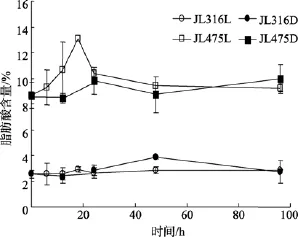
图4 光照和营养条件影响下C14:02OH比例随时间的变化Fig. 4 Time series detection of both light and nutrient impacts on C14:02OH
3 讨论
3.1 不饱和脂肪酸
对于海洋细菌而言, 低温对脂肪酸的影响主要有提高不饱和度, 缩短链长, 增加支链脂肪酸或反式脂肪酸的比例等[23]。本研究中, 温度的降低(28℃至12℃)提高了AAPB的UFA%同时伴随饱和脂肪酸比例的下降, 这种适应机制在海洋细菌中非常普遍,在碳链中引入双键降低了相变温度, 因而在低温下能够保证细胞膜的流动性。低温下JL316中C16:1增加的现象已在多株嗜寒细菌中发现[24], 该成分被认为是寒冷诱导的主要脂肪酸成分之一[25], 而 AAPB菌响应的成分主要是18碳的不饱和脂肪酸, 这可能与AAPB中C16:1的比例很低有关。
不饱和脂肪酸也参与细胞的营养调控[26], 脂肪酸的早期研究显示饥饿状态下细菌的磷脂含量会显著下降, 给细胞膜流动性带来显著的影响[27]。本实验中, 碳源不足可能是导致 AAPB脂肪酸合成终端的18碳不饱和脂肪酸比例下降的原因,Erythrobacter litoralisHTCC2594的基因组分析显示该属的细菌脂肪酸合成主要是从头合成方式, 即通过脂肪酸合酶途径不断增加两个碳单位的乙酰辅酶 A 合成 C16:0,C16:0作为18烷酰CoA去饱和酶的底物合成 C18:0及C18:1, 因此在碳源缺乏的情况下细菌倾向于维持C16:0而减少 C18:1的含量, 这与我们在 AAPB 中观察到的现象一致。此外, 细胞的油酸和硬脂酸的比例是细胞膜流动性和信号传导的指示[28,29], 因此 AAPB中较低的 C18:1/ C18:0比例可能也反过来限制了碳源利用。
本研究所涉及的 AAPB种属普遍具有较高的不饱和脂肪酸, 尤其在Roseobacter分支中, 虽然Bchl.a与脂肪酸之间的联系尚未发现, 然而研究普遍认为碳碳双键是细胞氧化的敏感部位, 这似乎与 AAPB集中分布于氧化威胁较大的真光层相互矛盾[3,30]。由此, 考察了 AAPB的生理特性, 其中类胡萝卜素的特殊性可能有助于解释这个矛盾。类胡萝卜的主要功能有两方面, 一是作为辅助色素参与捕光, 二是起到抵御氧化胁迫的作用。目前的研究认为, AAPB普遍含有较多的类胡萝卜素, 不论在总量上还是在类胡萝卜素和细菌叶绿素的比值上[31,32,33], 大量极性类胡萝卜素是均匀分布的, 即说明 AAPB的大部分类胡萝卜素没有参与能量传递[34], 因此,抗氧化的功能尤为凸显, 虽然至今没有实证, 但研究者普遍认为抗氧化机制是其主要功能之一[1], 因此类胡萝卜素的保护作用可能是关键所在。
3.2 羟基脂肪酸
羟基脂肪酸是本研究中对环境变化较敏感的成分, JL475和JL316被认为具有类似的二羟基脂肪酸分布[21], 然而光照下二羟基脂肪酸在两个功能类群中体现出不同的变化趋势, 那么这类脂肪酸在AAPB发挥特殊生理功能时具有怎样的作用呢?羟基脂肪酸主要通过饱和或不饱和脂肪酸的羟基化或者说分子修饰而来, 最近在 AAPB菌Erythrobacter.sp的研究中发现了特殊的酶氧化作用,该酶能作用于烯酸并产生相应的羟基脂肪酸, 巧合的是这个过程同样受到光照和低温的诱导, 与本研究的调控类似。尽管二羟基脂肪酸的合成机制未明, 脂肪酸的羟基化并不能直接拿来比较, 但这些过程为我们提供了可能联系。本实验中, 羟基脂肪酸的这种变化仅出现在AAPB中, 而这个类群区别于非 AAPB的最本质的特征是具有 Bchl.a, 因此,推测羟基脂质可能响应于光照刺激, 如果是这样, 寡营养条件下 JL475的 C14:02OH在光诱导下的变化(图4)就可以解释了:在黑暗预培养阶段 AAPB积累大量 Bchl.a, 光照刺激下, 细胞光合作用活跃, 二羟基组分积累, 而Bchl.a合成受持续光照的抑制, 因此, 18 h以后光合作用削弱并伴随着羟基脂肪酸的下降。非 AAPB菌JL316因为不含细菌叶绿素而没有这种波动现象, 这暗示了羟基脂肪酸可能参与Erythrobacter属的AAPB光合调控。
3.3 从脂肪酸对环境的响应看 AAPB的生理生态特征
研究显示,细胞膜流动性的改变可能作为初级信号启动去饱和酶基因的表达[24,35], 但也有学者指出去饱和酶基因对温度的变化并不敏感, 如负责引入第一个双键的desC基因[36,37], 但改变细胞膜流动性依然是海洋微生物应对低温胁迫的主要方式之一。本研究所有菌株中都观察到了不饱和脂肪酸比例随温度的降低而增加, 但 AAPB菌的 UFA%变化率比非 AAPB小, 这个现象得到膜电位研究的支持[38],报道显示,在不同温度条件下AAPB的膜电位保持相对较高且较稳定的状态。膜电位高说明细胞膜的通透性较低, 相应的流动性变化较小即与本实验中脂肪酸不饱和度的变化小相对应, 这种状态下 AAPB的细胞状态优于非 AAPB, 说明稳定性利于细胞生存, 由此,推测 AAPB在低温海域将得益于脂肪酸的稳定性而获得生存优势。这个推测也得到了野外试验的证明, 如Cottrell等[39]报道的AAPB在冬天比夏天更具有相对与普通异养细菌的竞争优势。
AAPB的特殊光合能力被认为有利于该类群在寡营养海域的分布, 本研究发现, 富营养条件下AAPB的脂肪酸主要成分几乎未受光照影响, 而饥饿和光照同时作用时, 十八碳单不饱和脂肪酸的比例明显降低, 主要表现出饥饿胁迫的效应, 因此,从脂肪酸变化情况来看, 虽然 AAPB能够利用光能,但它们首先是异养细菌, 首要受营养条件的影响,光照不会对细胞膜结构造成显著影响。此外,与非AAPB的对照发现, JL316的主要脂肪酸在整个营养试验过程中均没有显著的变化, 可能源于该类群较好的异养能力, 这也可能是AAPB在缺少DOC的大洋环境中比例较低的原因之一。
AAPB作为重要的海洋功能类群, 还有许多特征有待发现和深入了解, 本文初步探讨了脂肪酸方面的研究, 并结合 AAPB的生理生态特征指出些许功能类群相关的特性, 同时也为 AAPB研究提供了新的视角。
[1]Yurkov V, Csotonyi J. New light on aerobic anoxygenic phototrophs[M]. The Netheriands:Springer.2009.
[2]Jiao N, Zhang Y, Zeng Y, et al. Distinct distribution pattern of abundance and diversity of aerobic anoxygenic phototrophic bacteria in the global ocean[J]. Environ Microbiol, 2007, 9:3091-3099.
[3]Kolber Z S, Plumley F G, Lang A S, et al. Contribution of aerobic photoheterotrophic bacteria to the carbon cycle in the ocean[J]. Science, 2001, 292:2492-2495.
[4]Shiba T, Shioi Y, Takamiya K, et al. Ecology of aerobic phototrophic bacteria[J]. Trends Microb Ecol, 1993,171:55-58.
[5]Yurkov V V, Krieger S, Stackebrandt E, et al. Citromicrobium bathyomarinum, a novel aerobic bacterium isolated from deep-sea hydrothermal vent plume waters that contains photosynthetic pigment-protein complexes[J]. J Bacteriol, 1999, 181:4517-4525.
[6]Jiao N, Zhang R, Zheng Q. Coexistence of two different photosynthetic operons in citromicrobium bathyomarinum jl354 as revealed by whole-genome sequencing[J]. J Bacteriol, 192:1169-1170.
[7]Brinkhoff T, Giebel H A, Simon M. Diversity, ecology,and genomics of the roseobacter clade:A short overview[J]. Arch Microbiol, 2008, 189:531-539.
[8]Labrenz M, Lawson P A, Tindall B J, et al.Roseisalinus antarcticusgen. nov., sp. nov., a novel aerobic bacteriochlorophyll a-producing alpha-proteobacterium isolated from hypersaline ekho lake, antarctica[J].Int J Syst Evol Microbiol, 2005, 55:41-47.
[9]Martinez-Checa F, Quesada E, Martinez-Canovas M J,et al.Palleronia marisminorisgen. nov., sp. nov., a moderately halophilic, exopolysaccharide-producing bacterium belonging to the 'alphaproteobacteria', iso-lated from a saline soil[J]. Int J Syst Bacteriol, 2005, 55:2525-2530.
[10]Suyama T, Shigematsu T, Suzuki T, et al.Photosynthetic apparatusin roseateles depolymerans 61a is transcriptionally induced by carbon limitation[J]. Appl Environ Microbiol, 2002, 68:1665-1673.
[11]Sieracki M E, Gilg I C, Thier E C, et al. Distribution of planktonic aerobic anoxygenic photoheterotrophic bacteria in the northwest atlantic[J]. Limnol Oceanogr,2006, 51:38-46.
[12]Zhang Y, Jiao N. Dynamics of aerobic anoxygenic phototrophic bacteria in the east china sea[J]. Fems Microbiology Ecology, 2007, 61:459-469.
[13]Biebl H, Wagner-Dobler I. Growth and bacteriochlorophyll a formation in taxonomically diverse aerobic anoxygenic phototrophic bacteria in chemostat culture:Influence of light regimen and starvation[J].Process Biochem, 2006, 41:2153-2159.
[14]Cooney M J, Johnston W A, Pohl S, et al. Influence of photoperiod on pigmentation and metabolic efficiency of the marine aerobic anoxygenic photosynthetic bacterium erythrobacter longus strain nj3y[J]. Aquat Microb Ecol, 2006, 43:303-309.
[15]Li Q, Jiao N Z, Peng Z Q. Environmental control of growth and bchl a expression in an aerobic anoxygenic phototrophic bacterium, erythrobacter longus(dsmz6997)[J]. Acta Oceanologica Sinica, 2006, 25:138-144.
[16]Yurkov V V, Gemerden H. Impact of light/dark regimen on growth rate, biomass formation and bacteriochlorophyll synthesis in erythromicrobium hydrolyticum [J]. Arch Microbiol, 1993, 159 84-89.
[17]Berge J P, Barnathan G. Fatty acids from lipids of marine organisms:Molecular biodiversity, roles as biomarkers, biologically active compounds, and economical aspects[J]. Mar Biotechnol, 2005, 96:49-125.
[18]Nichols D S, McMeekin T A. Biomarker techniques to screen for bacteria that produce polyunsaturated fatty acids[J]. J Microbiol Methods, 2002, 48:161-170.
[19]Tyystjarvi T, Herranen M, Aro E M. Regulation of translation elongation in cyanobacteria:Membrane targeting of the ribosome nascent-chain complexes controls the synthesis of d1 protein[J]. Mol Microbiol,2001, 40:476-484.
[20]Rontani J F, Christodoulou S, Koblizek M. Gc-ms structural characterization of fatty acids from marine aerobic anoxygenic phototrophic bacteria[J]. Lipids,2005, 40:97-108.
[21]Yang H, Ma X, Li Q, et al. Distributions of phospholipid and glycolipid fatty acids in two strains of different functionalErythrobactersp. Isolated from south china sea [J]. Front Earth, 2009, 3:91-99.
[22]Labrenz M, Collins M D, Lawson P A, et al.Antarctobacter heliothermusgen. nov., sp. nov., a budding bacterium from hypersaline and heliothermal ekho lake[J].Int J Syst Bacteriol, 1998, 48 Pt 4:1363-1372.
[23]Whyte L G, Slagman S J, Pietrantonio F, et al. Physiological adaptations involved in alkane assimilation at a low temperature by rhodococcus sp. Strain q15[J]. Appl Environ Microbiol, 1999, 65:2961-2968.
[24]Mannisto M K, Puhakka J A. Temperature- and growth-phase-regulated changes in lipid fatty acid structures of psychrotolerant groundwater proteobacteria[J]. Arch Microbiol, 2001, 177:41-46.
[25]Wada M, Fukunaga N, Sasaki S. Effect of growth temperature on phospholipid and fatty acid compositions in a psychrotrophic bacterium, pseudomonas sp. Strain e-3[J]. Plant Cell Physiol, 1987, 28:1209-1217.
[26]Kieft T L, Wilch E, Oconnor K, et al. Survival and phospholipid fatty acid profiles of surface and subsurface bacteria in natural sediment microcosms[J]. Appl Environ Microb, 1997, 63:1531-1542.
[27]Oliver J D, Stringer W F. Lipid composition of a psychrophilic marineVibriosp. During starvation- induced morphogenesis[J]. Appl Environ Microbiol, 1984, 47:461-466.
[28]Ntambi J M, Miyazaki M. Regulation of stearoyl-coa desaturases and role in metabolism[J]. Prog in Lipid Res, 2004, 43:91-104.
[29]Sampath H, Ntambi J M. The fate and intermediary metabolism of stearic acid[J]. Lipids, 2005, 40:1187-1191.
[30]Waidner L A, Kirchman D L. Aerobic anoxygenic phototrophic bacteria attached to particles in turbid waters of the delaware and chesapeake estuaries[J].Appl Environ Microbiol, 2007, 73:3936-3944.
[31]Harashima K, Nakada H. Carotenoids and ubiquinone in aerobically grown cells of an aerobic photosynthetic bacterium, erythrobacter species och114[J]. Agric Biol Chem, 1983, 47:1057-1063.
[32]Shiba T.Roseobacter litoralisgen. nov, sp.nov. and roseobacter denitrificans sp.nov., aerobic pink-pigmented bacteria which contain bacteriochlorophyll a[J].System Appl Microbiol, 1991, 14:140-145.
[33]Yurkov V V, Beatty J T. Aerobic anoxygenic phototrophic bacteria[J]. Microb Mol Biol Rev, 1998, 62:695-724.
[34]Koblizek M, Beja O, Bidigare R R, et al. Isolation and characterization ofErythrobactersp. strains from the upper ocean[J]. Arch Microb, 2003, 180:327-338.
[35]Singh S C, Sinha R P, Hader D-P. Role of lipids and fatty acids in stress tolerance in cyanobacteria[J]. Acta Protozool, 2002, 41:297-308.
[36]Deshnium P, Paithoonrangsarid K, Suphatrakul A, et al.Temperature-independent and -dependent expression of desaturase genes in filamentous cyanobacterium spirulina platensis strain c1 (Arthrospirasp. Pcc 9438)[J]. FEMS Microbiol Lett, 2000, 184:207-213.
[37]Kis M, Zsiros O, Farkas T, et al. Light-induced expression of fatty acid desaturase genes[J]. Proc Natl Acad Sci U S A, 1998, 95:4209-4214.
[38]Jiao N, Yang Y, Luo T. Membrane potential based characterization by flow cytometry of physiological states in an aerobic anoxygenic phototrophic bacterium[J]. Aquat Microb Ecol, 2004, 37:149-158.
[39]Cottrell M T, Kirchman D L. Photoheterotrophic microbes in the arctic ocean in summer and winter[J].Appl Environ Microbiol, 2009, 75:4958-4966.
Impact of environmental factors on fatty acid patterns of aerobic anoxygenic phototrophic bacteria
ZOU Li-jie, JIAO Nian-zhi
(State Key Laboratory of Marine Environmental Sciences, Xiamen University, Xiamen 361005, China)
Jun.,6,2011
Aerobic Anoxygenic Phototrophic bacteria; Fatty acid; Environmental factors
Fatty acid regulation is a crucial acclimation process which seems neglected by investigators of Aerobic anoxygenic phototrophic bacteria (AAPB). In the present study, cellular fatty acid compositions of 9 AAPB strains phylogenetically related to generaErythrobacter,“Citromicrobium” andRoseobacterclade were analyzed, along with 10 non-AAPB strains for comparison. The dominant fatty acid component in tested strains was C18:1w7c, which has the highest content inRoseobacterclade. Fatty acid compositions respond differently to environmental factors.Low temperature and oligotrophic conditions mainly affect unsaturated fatty acids (UFAs). An increase of 2-OH fatty acids was detected when nutrient and light act as the joint pressure for AAPB. In addition, taking non-AAPB strains into consideration provided a new perspective in AAPB research and some explanations related to ecological phenomenon were suggested. For example, AAPB may have advantages in cold marine areas owing to the high percentage of UFAs and the heterotrophic ability of AAPB was comparatively weaker than non-AAPB strains.
Q938 文献标识码:A 文章编号:1000-3096(2012)09-0009-08
2011-06-06;
2011-12-19
国家973计划项目(2011CB808800); 国家海洋局项目(201105021); 国家基金委项目(41191021)
邹丽洁(1984-), 女, 浙江嘉兴人, 硕士研究生, 主要从事海洋微生物生态学研究, E-mail:2008354@163.com; 焦念志, 通信作者,电话:0592-2187869, E-mail:jiao@xmu.edu.cn
康亦兼)
