硫酸小诺霉素注射液无菌检查方法的建立及验证
2012-01-12朱晓玥钱文静
杨 昊, 朱晓玥, 钱文静
(江苏省食品药品检验所,江苏南京210009)
硫酸小诺霉素(micronomicin sulfate)为第3代氨基糖苷类抗生素,具有快速杀菌和抑菌能力,不易产生耐药性,且注射时不需进行皮试,具有疗效好、副作用小、价格较低等特点[1]。该药原料和注射液已被多版《中国药典》和日本药局方收载[2-3]。
为确保临床用药安全,需对硫酸小诺霉素注射剂进行无菌检查。但对具有抗菌活性的注射剂进行无菌检查时需选择适宜的方法消除其抗菌作用,以保证检查结果的准确性和可靠性。例如,采用薄膜过滤法对硫酸小诺霉素进行无菌检查时即可用适量0.1%无菌蛋白胨氯化钠水溶液冲洗,从而在保证所有阳性对照菌正常生长的前提下,检查染菌情况。由此可见,冲洗液的冲洗量和敏感菌的选择对具有抗菌活性的注射剂的无菌检查至关重要:冲洗量过少时,不能消除抗生素的抑菌作用,因而会出现阳性对照菌不生长的现象,从而导致漏检,但冲洗量过大,则可能使膜的通透性增加,或损伤菌体,同样也会导致漏检,因此,应在保证消除抑菌作用的情况下,选用尽量少的冲洗量;而选择恰当的敏感菌不但可简化实验步骤,还可避免假阴性,提高染菌的检出率。然而,《中国药典》对冲洗量及敏感菌的选择尚无具体规定。为此,笔者按《中国药典》2010年版二部附录ⅪH“无菌检查法”中的原则性要求进行试验,确定了硫酸小诺霉素注射剂无菌检查的具体条件,弥补了检验标准的不足。
1 材料
1.1 仪器
HTY-2000A型智能集菌仪(泵速设为160 r· min-1,杭州泰林生物技术设备有限公司),配全封闭三联集菌培养器(杭州泰林生物技术设备有限公司);隔水式恒温培养箱(上海博讯实业有限公司医疗设备厂)。
1.2 药品
硫酸小诺霉素注射液,规格为2mL∶60mg(6万单位),批号为1103312、1103082和1102141,由江西制药有限责任公司提供。
1.3 培养基和试剂
硫乙醇酸盐流体培养基(批号:110419),改良马丁培养基(批号:1104192),营养琼脂培养基(批号:101013),营养肉汤培养基(批号:101112),改良马丁琼脂培养基(批号:100818),均由北京三药科技开发有限公司提供。0.9%无菌氯化钠溶液和0.1%无菌蛋白胨氯化钠溶液,均按照《中国药典》2010年版二部附录ⅪH“无菌检查法”项下要求配制及灭菌。
1.4 菌种
金葡菌(Staphylococcus aureus)[CMCC(B)26 003],枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63 501],大肠埃希菌(Escherichia coli)[CMCC(B)44 102],生孢梭菌(Clostridium sporogenes)[CMCC(B) 64 941],白色念珠菌(Candida albicans)[CMCC(F) 98 001],黑曲霉(Aspergillus niger)[CMCC(F)98 003],均由中国药品生物制品检定所提供。
2 方法与结果
2.1 供试菌液的制备
接种金葡菌、大肠埃希菌和枯草芽孢杆菌的新鲜培养物至10 mL营养肉汤培养基中,接种生孢梭菌的新鲜培养物至10 mL硫乙醇酸盐流体培养基中,35℃培养20 h,取这4种培养物,用0.9%无菌氯化钠溶液制成含菌数小于100 cfu·mL-1的菌悬液,用营养琼脂培养基平板计数;接种白色念珠菌的新鲜培养物至10 mL改良马丁培养基中,25℃培养24 h,取培养物,用0.9%无菌氯化钠溶液制成含菌数小于100 cfu·mL-1的菌悬液,用改良马丁琼脂培养基平板计数;接种黑曲霉的新鲜培养物至10 mL改良马丁琼脂培养基上,25℃培养5 d,加0.9%无菌氯化钠溶液4 mL将孢子洗脱,取洗脱液,用0.9%无菌氯化钠溶液稀释至含孢子数小于100 cfu·m L-1的孢子悬液,用改良马丁琼脂培养基平板计数(见表1)。
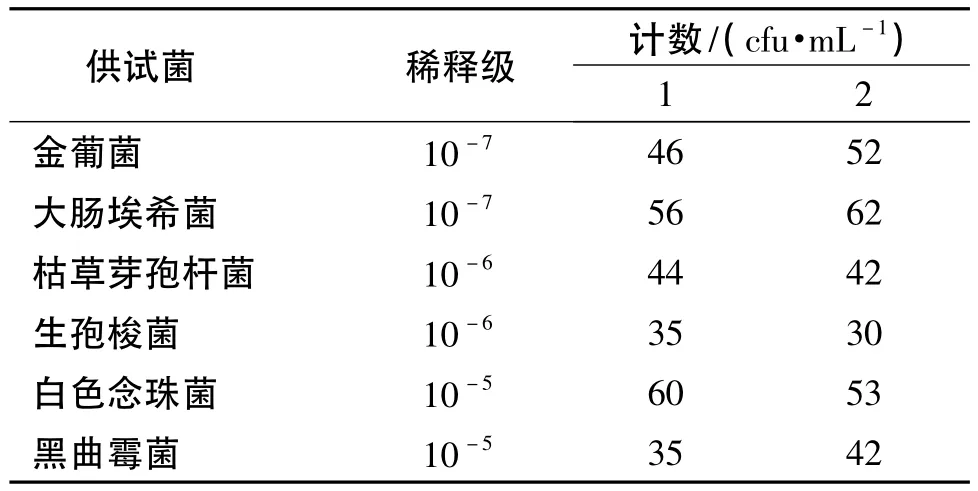
表1 供试菌液的计数Table1 The count of tested bacteria liquid
根据《中国药典》2010年版二部附录ⅪH“无菌检查法”规定,上述菌液所含菌(孢子)数均小于100 cfu·mL-1,可作为工作菌液使用。
2.2 培养基适用性检查
取每管装量为12 mL的硫乙醇酸盐流体培养基9支,分别用“2.1”项下制备的金葡菌、大肠埃希菌、枯草芽胞杆菌和生孢梭菌菌悬液各接种2支,每支接种量为1 mL,余下1支不接种,作为细菌空白对照;取每管装量为9 mL的改良马丁培养基5支,分别用“2.1”项下制备的白色念珠菌和黑曲霉菌菌悬液各接种2支,每支接种量为1 mL,余下1支不接种,作为真菌空白对照;将各支培养基置规定温度下(细菌35℃,真菌25℃,以下同)培养14 d,逐日记录观察结果(见表2)。由表2可见,加菌后的培养基上呈现菌落生长,空白对照培养基上无菌生长。表明无菌检查用的硫乙醇酸盐流体培养基及改良马丁培养基符合培养基的无菌性检查及灵敏度检查的要求。

表2 培养基适用性检查结果Table2 Results of the examination for the applicability ofmedium
2.3 无菌检查方法验证
2.3.1 试验组无菌检查 取一次性全封闭三联集菌培养器,用少量0.9%无菌氯化钠溶液润湿滤膜;取硫酸小诺霉素注射液60支,转移至300 mL的0.9%无菌氯化钠溶液中,摇匀,全量通过集菌培养器,随后用0.1%无菌蛋白胨氯化钠溶液冲洗,每次每筒注入冲洗液100 mL[2],充分振摇,荡洗筒壁,完全排空后再循环操作,在最后一次的冲洗液中分别加入金葡菌、大肠埃希菌和枯草芽孢杆菌菌悬液,菌落数为10~100 cfu(每筒加1种菌),再向3个筒内各注入硫乙醇酸盐流体培养基100 mL;另取本品60支,同法操作,在最后一次的冲洗液中分别加入生孢梭菌、白色念珠菌和黑曲霉菌菌悬液,菌落数为10~100 cfu(每筒加1种菌),然后向加入生孢梭菌菌液的筒内注入硫乙醇酸盐流体培养基,加入白色念珠菌和黑曲霉菌菌液的筒内注入改良马丁培养基,注入量均为100 mL;将各培养基置规定温度下,培养3~5 d,逐日观察,记录冲洗量分别为每筒100 mL和每筒200 mL(即每筒冲洗2次)时各培养基上菌落生长情况。重复做3批,结果见表3。
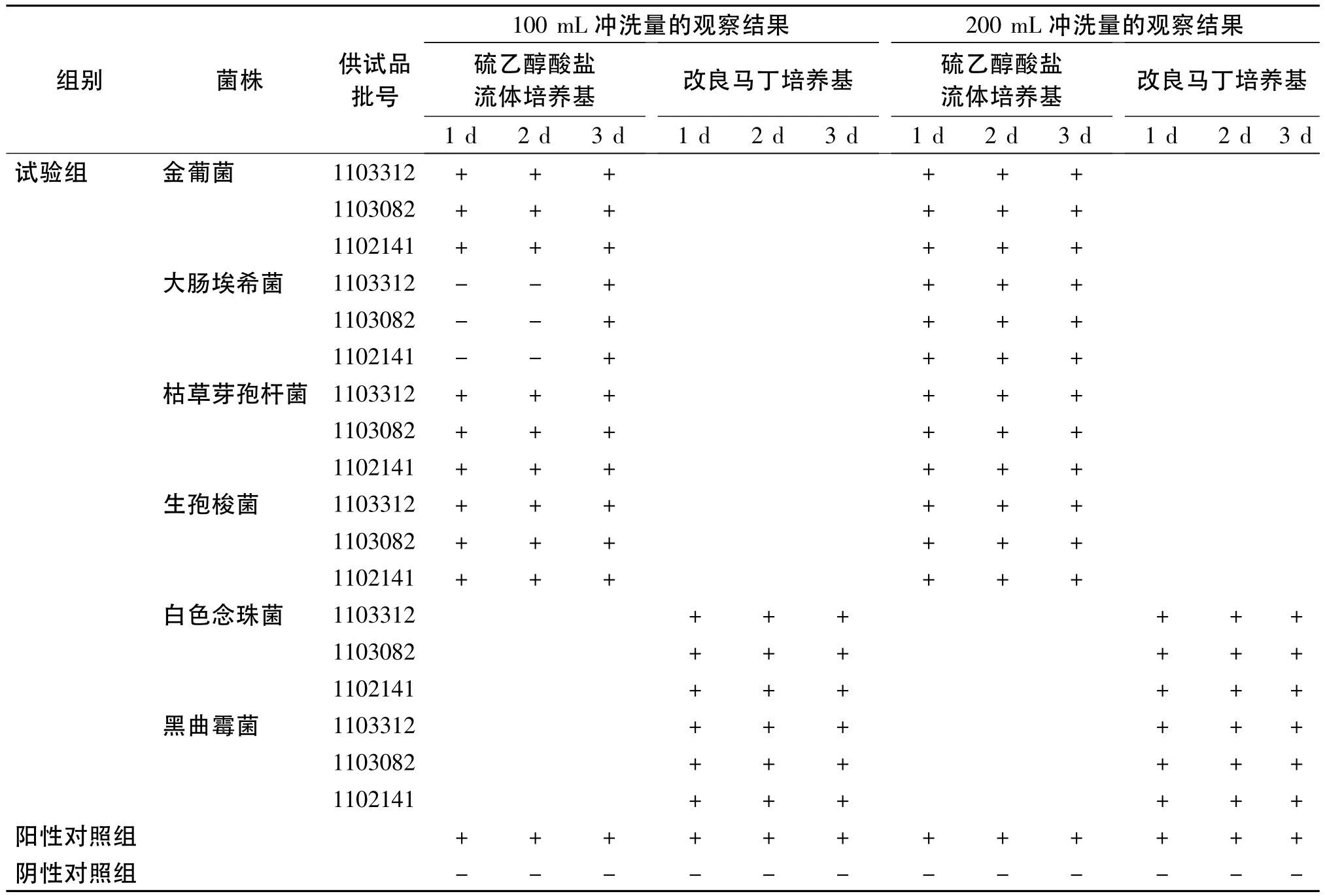
表3 各试验菌的验证结果Table3 Results of the bacteria validation
2.3.2 阳性对照组无菌检查 取一次性全封闭三联集菌培养器,不加供试品,按照“2.3.1”项下方法进行冲洗,共得6筒,在最后一次冲洗液中分别加入金葡菌、大肠埃希菌、枯草芽孢杆菌、生孢梭菌、白色念珠菌和黑曲霉菌菌悬液,菌落数为10~100 cfu (每筒加 1种菌),再分别注入相应的培养基100 mL,作为阳性对照。将各培养基置规定温度下培养3~5 d,逐日观察,记录冲洗量分别为每筒100 mL和每筒200 mL时各培养基上菌落生长情况,结果见表3。
2.3.3 阴性对照组无菌检查 取一次性全封闭三联集菌培养器,过滤300 mL的0.9%无菌氯化钠溶液和100 mL的0.1%无菌蛋白胨氯化钠水溶液,然后分别注入硫乙醇酸盐流体培养基和改良马丁培养基各100 mL,作为阴性对照。将各培养基置规定温度下,培养3~5 d,逐日观察,记录0.1%无菌蛋白胨氯化钠水溶液用量为每筒100 mL和每筒200 mL时各培养基上菌落生长情况,结果见表3。
2.4 供试品的无菌检查
取本品(批号:1103312)60支,转移至300 mL的0.9%无菌氯化钠溶液中,摇匀,全量通过全封闭三联集菌培养器,用0.1%无菌蛋白胨氯化钠水溶液冲洗,每筒冲洗2次,每次100 mL;第2次冲洗后,2筒注入硫乙醇酸盐流体培养基各100 mL(其中1筒接入大肠埃希菌作为阳性对照),1筒注入改良马丁培养基100 mL。另取一套全封闭过滤器,过滤300 mL的0.9%无菌氯化钠溶液和200 mL的0.1%无菌蛋白胨氯化钠水溶液,然后分别注入硫乙醇酸盐流体培养基和改良马丁培养基各100 mL,作为阴性对照。将各培养基置规定温度,培养14 d,逐日观察(见表4)。由表4可见,供试品组和阴性对照组澄清,阳性对照菌则生长良好。表明供试品无菌检查符合规定。
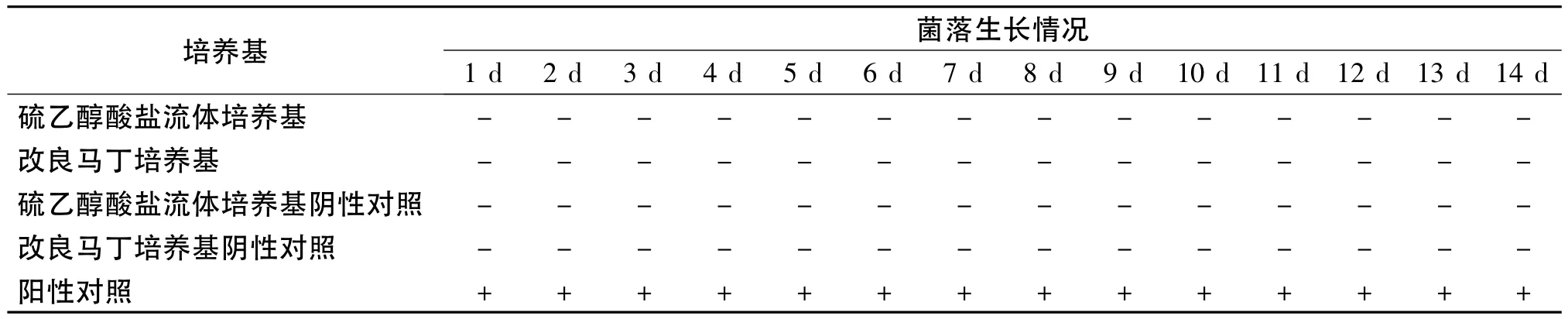
表4 供试品无菌检查结果Table4 Results of the sterility test
3 讨论
在对无菌检查方法进行验证时发现,当冲洗量为100 mL时,试验组所有黑曲霉和白色念珠菌均能生长,表明硫酸小诺霉素对真菌的抑菌作用弱于对细菌的抑制作用,而大肠埃希菌生长情况不良,表明冲洗量为每筒100 mL时不能消除抗生素的抑菌作用;当冲洗量增加到每筒200 mL时,所有菌均生长良好,表明在该冲洗条件下可消除硫酸小诺霉素的抑菌作用,故在对供试品进行无菌检查时将冲洗量定为每筒200 mL。由表3可知,生长情况最差的菌株为大肠埃希菌,故选用大肠埃希菌作为硫酸小诺霉素的敏感菌株。据此,本文建立了以大肠埃希菌作为敏感菌、采用0.1%无菌蛋白胨氯化钠水溶液冲洗2次(每次100 mL)的薄膜过滤法作为硫酸小诺霉素注射液无菌检查方法。
[1]李晖,康秉学,贺浪冲.小诺霉素临床研究进展[J].西北药学杂志,1995,10(6):267-269.
[2]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2010:960.
[3]Society of Japanese Association of Law Books.The Japanese Pharmacopoeia[M].15th ed.Tokyo:Society of Japanese Pharmacopoeia,2006:893.
