人羊膜上皮细胞在大鼠受损肝组织中分化为肝细胞
2012-01-11宫黎明陈代雄万卫红余丽梅赵春华
宫黎明,方 宁,陈代雄*,万卫红,章 涛,余丽梅,赵春华
(1.遵义医学院附属医院贵州省细胞工程重点实验室,贵州遵义563003;2.中国医学科学院基础医学研究所组织工程中心,北京100005)
人羊膜上皮细胞在大鼠受损肝组织中分化为肝细胞
宫黎明1,方 宁1,陈代雄1*,万卫红1,章 涛1,余丽梅1,赵春华2
(1.遵义医学院附属医院贵州省细胞工程重点实验室,贵州遵义563003;2.中国医学科学院基础医学研究所组织工程中心,北京100005)
目的 探讨人羊膜上皮细胞在大鼠损伤肝原位植活及向肝细胞分化。方法 用胰蛋白酶消化法从羊膜组织中分离人羊膜上皮细胞(hAECs),用流式细胞术和免疫荧光染色进行表型分析和细胞鉴定。腹腔注射D-氨基半乳糖溶液建立大鼠肝损伤模型,随机分为hAECs移植组和对照组,每组20只。造模后24 h用微量注射器于肝左、中、右叶3点分别移植L-DMEM悬浮的hAECs悬液50 μL(约1×106个细胞),对照组注射等量L-DMEM。于移植后48 h、1、2和4周处死各实验组5只大鼠,取肝脏制备冰冻切片,用免疫荧光双染色检查hAECs在受损肝原位的植活、分布及其向肝细胞分化的标志物表达。结果 1)FCM分析和免疫荧光染色结果显示,所分离的hAECs表达CD29、CD166及CK19,几乎不表达CD44、CD80、CD86、HLA-DR及波形蛋白;2)免疫荧光双染色结果显示,hAECs移植后1周主要定植于肝小叶且表达AFP,至2周表达CK18,至4周表达Alb。结论 hAECs在大鼠受损肝组织中能被植活且可分化为肝细胞,提示hAECs移植在临床肝病的治疗方面可能具有潜在应用价值。
人羊膜上皮细胞;移植;分化;肝细胞;肝损伤
人羊膜上皮细胞 (human amnion epithelial cells,hAECs)在特定的体外诱导培养条件下,可分化成来自3个胚层的各种细胞,包括神经细胞、心肌细胞、成骨和软骨细胞、胰岛素分泌细胞等[1-5]。提示 hAECs在细胞替代治疗方面具有广阔的应用前景。但是,作为细胞替代治疗的供体细胞hAECs还有很多问题,如在病损组织原位向特化功能性细胞的分化能力、对病损器官的修复和功能重建能力、生物安全性等值得探讨。为了评价hAECs在病损组织中的分化潜能,本实验以大鼠实验性肝损伤为受试模型,观察其在肝原位向功能性肝细胞分化的能力。
1 材料与方法
1.1 材料
经产妇知情同意后,无菌采集健康足月剖宫产胎盘。清洁级SD雌性大鼠40只,体质量(200±20)g(第三军医大学大坪医院动物实验中心[许可证号:SCXK(渝)2007-017]),实验中动物处置符合2006年科技部《关于善待实验动物的指导性意见》的规定。胰蛋白酶(Amreseo公司);胎牛血清(fatal bovine serun,FBS)和 LG-DMEM(Gibco公司);CD29-PE-Cy5、CD44-PE、 CD80-FITC、 CD86-PE、CD166-PE、HLA-DR-PerCP和小鼠 IgG1-PE(BD公司);D-氨基半乳糖(江苏启东市久丰工贸有限公司);鼠抗人CK19抗体(Gene Tech公司);鼠抗人波形蛋白抗体、兔抗人CK18抗体和兔抗人AFP抗体(Sigma公司);MAB1281抗体(鼠抗人细胞核抗体)(Millipore公司);兔抗人Alb抗体、羊抗鼠IgG-FITC和羊抗兔IgG-Texas Red(Santa Cruz公司)。
1.2 方法
1.2.1 hAECs的分离和培养:无菌条件下,用机械法将羊膜从胎盘组织上剥离,用D-PBS液反复冲洗,剪碎羊膜,加入含0.5 g/L胰蛋白酶+EDTA消化液,37℃旋转(200 r/min)消化10 min,弃上清,再加消化液,37℃旋转消化30 min,300目不锈钢滤网过滤,收集细胞滤液,加入等体积含10%胎牛血清的LG-DMEM培养基终止消化。组织碎片再重复消化2次。合并3次消化所得的hAECs悬液,1 500 r/min离心10 min,细胞沉淀悬浮于LG-DMEM培养基(含10%胎牛血清、2 mmol/L的L-谷氨酰胺、1%非必需氨基酸、55 μmol/L的 2-巯基乙醇、1 mmol/L丙酮酸钠、10 μg/L表皮生长因子、100 U/mL青霉素和100 g/L链霉素),以1.25×108/L浓度接种于培养瓶,于37℃、5%CO2、饱和湿度培养箱内培养,3 d更换新的培养基。hAECs连生面积达80% ~90%后,用2.5 g/L胰蛋白酶+EDTA溶液消化,收集细胞进行鉴定及传代培养。
1.2.2 流式细胞仪检测:取新鲜分离的hAECs用0.1%牛血清白蛋白(bovine serum albumin,BSA)的PBS调细胞浓度至1×106/mL,取细胞悬液200 μL分别加入10 μL荧光标记人单抗 CD29-PE-Cy5、CD44-PE、CD80-FITC、CD86-PE、CD166-PE 和 HLADR-PerCP混匀,室温避光孵育25~30 min,每管加入2 mL含0.1%叠氮钠的PBS,混匀,1 000 r/min离心5 min,弃上清,振荡重悬细胞,每管加入300 μL含1%多聚甲醛的 PBS溶液,混匀,用流式细胞仪(FACS Calibur,BD公司)检测,每一样品采集细胞数≥20 000个,用Cellquest软件采集和分析。同型对照为相应荧光素标记的小鼠IgG。
1.2.3 免疫荧光染色:hAECs接种于预置盖玻片的24孔板中,制备细胞爬片。细胞爬片用PBS振荡洗涤3次,4%多聚甲醛室温固定10 min,PBS冲洗,0.3%Triton-X100室温下作用15~20 min,PBS冲洗。1%BSA封闭30 min,PBS冲洗,加鼠抗人细胞角蛋白19(cytokeratin 19,CK19)抗体或鼠抗人波形蛋白抗体,37℃孵育30 min,PBS冲洗,加入FITC标记的羊抗鼠IgG,37℃孵育30 min,PBS冲洗,90%甘油封固,荧光显微镜(BX5 Video Test-FISH2.0,Olympus公司)下观察。阴性对照以PBS代替一抗。
1.2.4 肝损伤模型制备和hAECs移植:标准饲料喂养大鼠,不限饮水,饲养1周后用于实验。术前12 h禁食,D-氨基半乳糖(400 mg/kg)溶液一次性腹腔内注射制备肝损伤模型[6],随机分为hAECs移植组和对照组,每组20只。参照文献[7]方法,造模后24 h,各组大鼠腹腔注射10%水合氯醛麻醉,常规备皮、消毒,沿腹正中切口开腹,暴露肝脏,用微量注射器与肝平面45度角进针,深度约0.5 cm,肝内缓慢注射,留针时间1 min,移植组于肝左、中、右叶3点分别注射用LG-DMEM悬浮的P3代hAECs细胞悬液50 μL(约1×106个细胞),对照组注射等量的LG-DMEM,棉球压迫止血,关腹。术后注意保暖,给予糖盐水饮用。
1.2.5 hAECs在肝内定植及分化标志物的检测:各实验组于移植后1、2和4周处死大鼠5只,切取约1 cm×2 cm大小含移植部位的肝组织,OCT包埋剂包埋,冰冻切片8 μm,冷丙酮固定10 min,室温晾干,PBS冲洗,0.3%的 Triton-X100室温 15~20 min,3%H2O2室温避光孵育10 min,PBS冲洗,山羊血清室温封闭30 min,弃封闭液,进行人细胞核与甲胎蛋白(α-fetoprotein,AFP)或细胞角蛋白18(cytokeratin18,CK18)或白蛋白(albumin,Alb)免疫荧光双染色:滴加混合抗体(MAB1281抗体+兔抗人AFP抗体,或 MAB1281抗体 +兔抗人 CK18抗体,或MAB1281抗体+兔抗人Alb抗体),37℃孵育1 h,PBS冲洗;滴加FITC标记的羊抗鼠 IgG与 Texas Red标记的羊抗兔IgG混合二抗,37℃孵育30 min,PBS冲洗,抗荧光衰减剂封片,荧光显微镜下观察。阴性对照用PBS替代一抗。
2 结果
2.1 hAECs的生长特性与表型特征
hAECs原代(P0)培养第3天以后贴壁细胞数量迅速增多,形态多为卵圆形和三角形;传代培养的hAECs较原代容易贴壁,且增殖速度加快,4~5 d细胞汇合率可达90%以上,细胞形态变化不大,呈铺路石样排列(图1)。
FCM分析表明,新鲜分离的 hAECs高表达CD29(98.91% ±0.97%)和CD166(97.33% ±1.01%),几乎不表达 CD44(0.58% ±0.21%)、CD80(0.34% ±0.15%)、CD86(0.25% ±0.07%)及 HLA-DR(0.18% ±0.12%)(图2)。
免疫荧光染色结果显示,经过传代纯化后的hAECs均表达CK19(图3),但不表达波形蛋白。
2.2 hAECs肝损伤原位移植后的植活与分布
MAB1281抗体免疫荧光染色显示,移植后48 h可见大量hAECs植活,主要分散于肝小叶内的肝血窦中,中央静脉亦可见hAECs(图4)。
2.3 hAECs肝原位移植后向肝细胞分化的特征
免疫荧光双染色显示,hAECs肝原位移植后1周表达AFP(图5A~C),移植后2周表达CK18(图5D~F),移植后2和4周表达Alb(图5G~I)。
3 讨论
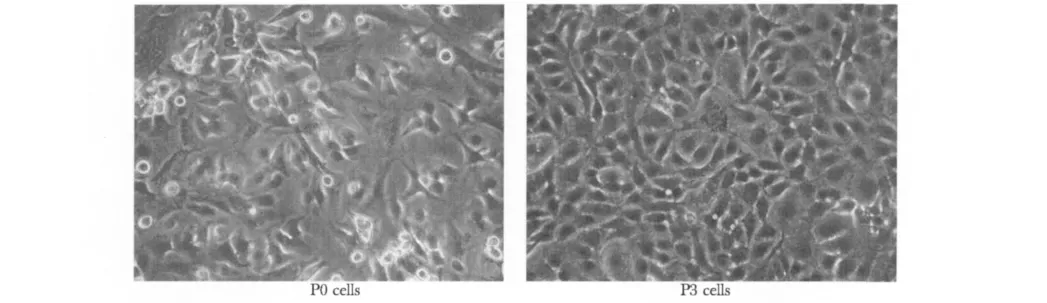
图1 hAECs培养形态Fig 1 Morphology of cultured hAECs(×200)
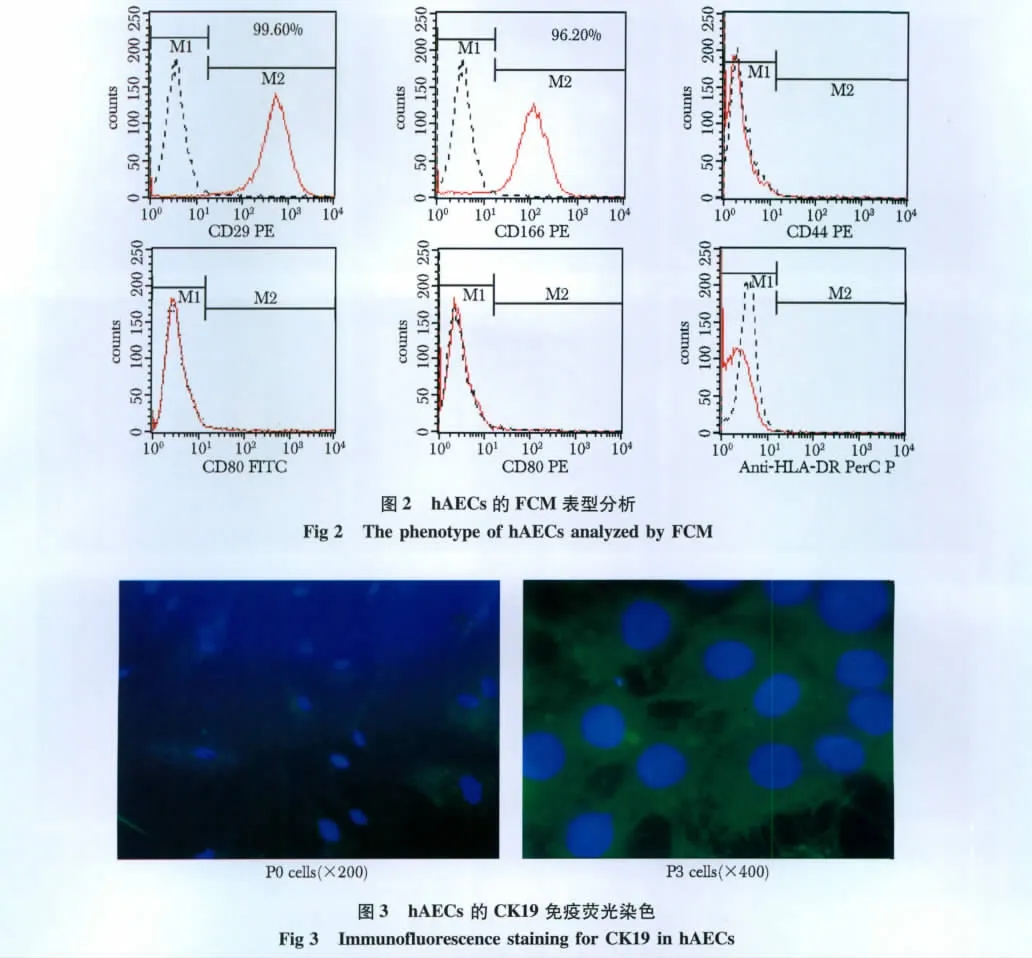
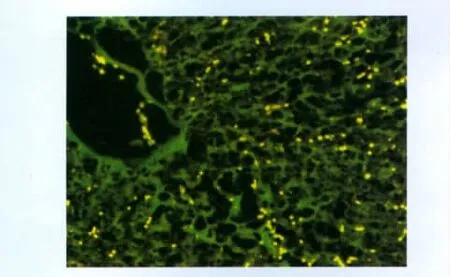
图4 hAECs肝损伤原位移植后48 h的植活与分布Fig 4 The survival and distribution of transplantation hAECs into rat injured liver at 48 h after being transplanted(×100)
原代hAECs的表面标志因受酶消化影响较大,通过流式细胞仪分析的表型特征描述报道不一,本室对原代hAECs的表型鉴定常规采用流式细胞仪分析和上皮细胞标志CK19免疫细胞化学染色。本实验分离的目标细胞高表达CD29和CD166,不表达 CD44、CD80、CD86 和 HLA-DR;表达 CK19,不表达波形蛋白。说明实验所分离的目标细胞为较高纯度的hAECs。鉴于羊膜间充质细胞具有先于上皮细胞贴壁的特性,可通过传代培养进一步纯化后用于后续的移植实验。
已有研究证明,hAECs同种异体和异种间移植不会引起排斥反应[1]。本实验人细胞核免疫荧光染色结果显示,移植后48 h肝小叶区内可见大量人细胞核阳性细胞,说明hAECs肝原位移植后在一定时间内可以植活而不被排斥,这可能与其不表达MHC-Ⅱ类抗原HLA-DR和共刺激分子(CD80和CD86)有关。显然,hAECs的这种免疫赦免特性非常有利于其同种异体间的移植。
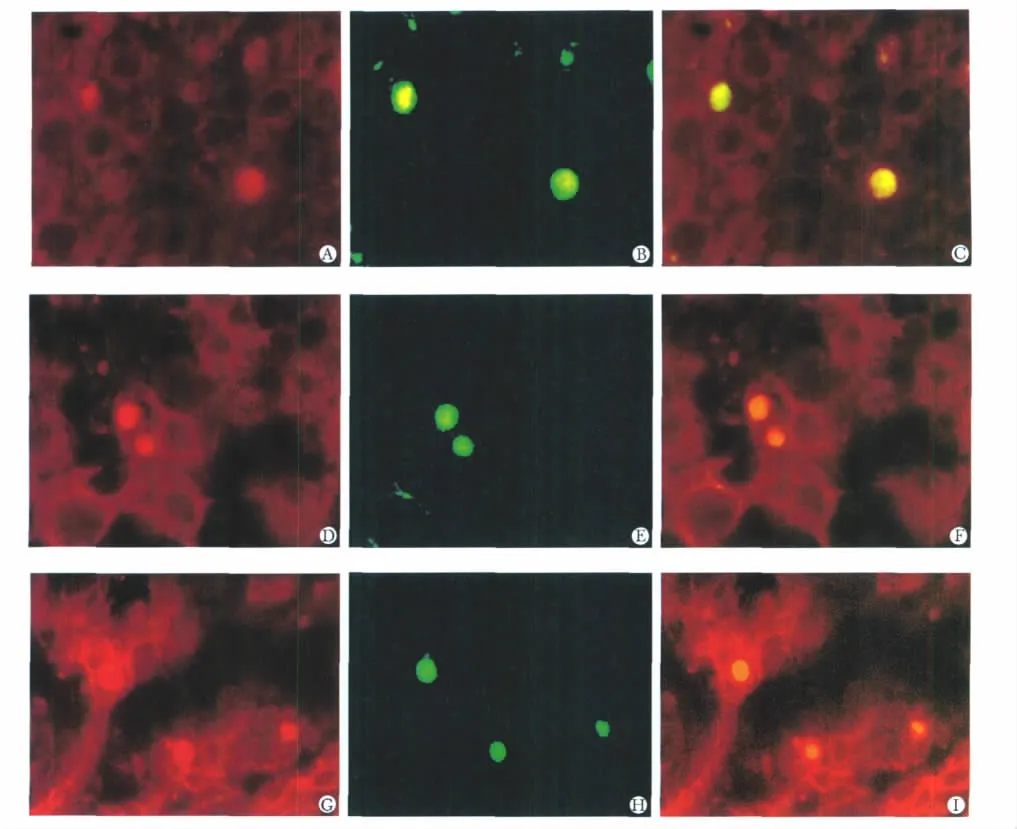
图5 hAECs肝原位移植后AFP、CK18和Alb的表达Fig 5 The expression of α-fetoprotein,cytokeratin18 and albumin after injecting hAECs into rat injured liver(×400)
已有研究报道,在体外诱导条件下hAECs可分化为肝细胞样细胞或肝上皮样细胞,人羊膜片移植入SCID小鼠腹腔后可分泌 Alb,经门静脉移植hAECs给SCID小鼠后2周,肝组织表达人Alb和AFP[8-10]。本实验以 D-氨基半乳糖致大鼠肝损伤模型作为hAECs原位移植受体,肝组织免疫荧光双染色结果显示,hAECs移植后1、2和4周依次表达肝细胞相关标志物AFP、CK18及Alb,表明hAECs在损伤肝原位可向肝细胞分化。至于hAECs移植能否再生修复病损肝脏并重建肝功能,有待进一步通过大动物模型治疗实验进行组织学和功能学的评价。关于供体细胞在肝原位分化为肝细胞的机制尚不明确,通过细胞融合或细胞转分化路径是目前比较流行的观点。hAECs向肝细胞分化是通过细胞融合,还是转分化诱导机制,值得探究。
[1]Parolini O,Alviano F,Bagnara GP,et al.Isolation and characterization of cells from human term placenta:outcome of the first international workshop on placenta derived stem cells[J].Stem Cells,2008,26:300 -311.
[2]Ilancheran S,Michalska A,Peh G,et al.Stem cells derived from human fetal membranes display multi-lineage differentiation potential[J].Biol Reprod,2007,7:577 -588.
[3]张路,方宁,陈代雄,等.人羊膜上皮细胞有向心肌样细胞分化的特性[J].中国组织工程研究与临床康复,2008,12:401 -405.
[4]宋秀军,陈代雄,方宁,等.人羊膜上皮细胞分化为成骨细胞的特性[J].中国组织工程研究与临床康复,2008,12:7518-7521.
[5]Hou Y,Huang Q,Liu T,et al.Human amnion epithelial cells can be induced to differentiate into functional insulinproducing cells[J].Acta Biochim Biophys Sin,2008,40:830-839.
[6]刘霞,王泰龄,赵静波,等.D-半乳糖胺致大鼠急性肝损伤模型制作的改进[J].中日友好医院学报,1996,10:305-308.
[7]Sato Y,Araki H,Kato J,et al.Human mesenchymal stem cells xenografted directly to rat liver are differentiated into human hepatocytes without fusion[J].Blood,2005,106:756-763.
[8]史明霞,李维佳,李炳宗,等.人羊膜来源成体干细胞的多向分化潜能[J].生物工程学报,2009,25:754-760.
[9]Takashima S,Ise H,Zhao P,et al.Human amniotic epithelial cells possess hepatocyte-like characteristics and functions[J].Cell Struct Funct,2004,29:73 -84.
[10]Sakuragawa N,Enosawa S,Ishii T,et al.Human amniotic epithelial cells are promising transgene carriers for allogeneic cell transplantation into liver[J].J Hum Genet,2000,45:171-176.
Differentiation of human amnion epithelial cells into hepatocytes in rat injured liver
GONG Li-ming1,FANG Ning1,CHEN Dai-xiong1*,WAN Wei-hong1,ZHANG Tao1,YU Li-mei1,ZHAO Chun-hua2
(1.Key Laboratory of Cell Engineering of Guizhou Province,Affiliated Hospital of Zunyi Medcial College,Zunyi 563003;2.Tissue Engineering Center,Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences,Beijing 100005,China)
ObjectiveTo investigate the survival and differentiation into hepatocytes of hAECs in rat.MethodshAECs were isolated from human amnion treated with trypsin,and the phenotype and characteristics of immunocytochemistry were analyzed by FCM and immunofluorescence staining.Healthy and clean grade female SD rats were administered intraperitoneal injection of D-galactosamine diluted in normal saline at a dose of 400 mg/kg body weight,to establish liver injury model.Rats were then devided into hAECs group and control group stochastically,with twenty in each group.Twenty-four hours after modeling,50 μL cell suspension(approximately 1 ×106cells suspended in L-DMEM)of hAECs was injected slowly into the left,middle and right lobe respectively with micro-syringe,while equivalent volume of L-DMEM injected into the control group.Results1)Freshly isolated hAECs expressed CD29 and CD166;immunofluoresce staining showed that cytokeratin 19 was positive in hAECs,while vimentin was negative.2)hAECs transplanted into injured liver were located in hepatic lobules at 48 h,and expressed AFP at 1w,CK18 at 2w,and Alb at 4w after transplantation.ConclusionshAECs xenografted to rat injured liver can differentiate into hepatocytes suggesting hAECs may have the potential value for treating clinical liver injury.
human amnion epithelial cell;transplantation;differentiation;hepatocyte;liver injury
Q 813;R 318
A
1001-6325(2012)09-0998-06
2011-04-21
2011-12-26
“重大新药创制”国家科技重大专项(2009ZX09503-025);贵州省科技计划发展项目(黔科合计字2051号;黔科合SZ字3017号)
*通信作者(corresponding author):cellgene@163.com
