荧光增白剂CCBBSS的毒理学数据及其使用安全性
2012-01-10董仲生沈日炯
董仲生,沈日炯
(沈阳化工研究院,辽宁 沈阳 110021)
荧光增白剂CCBBSS的毒理学数据及其使用安全性
董仲生,沈日炯
(沈阳化工研究院,辽宁 沈阳 110021)
荧光增白剂CBS是QB/T 2953-2008《洗涤剂用荧光增白剂》标准规定的两类典型产品之一,在国内外洗涤剂行业已有几十年的使用历史,多年来其安全性也一直受到人们的关注。本文简单介绍了洗涤剂用荧光增白剂CBS的理化性质和使用特点,同时根据欧盟2003年和日本2007年就该产品对人类和环境的风险评估报告及其他相关资料,从荧光增白剂CBS的急性毒性、皮肤毒性、刺激性、致敏性、遗传毒性、重复剂量毒性、致畸性、致癌性、体内蓄积以及河流、土壤中的浓度等方面,将该产品的毒理学试验数据及其对环境的影响进行了详细介绍,目的是让人们对该产品的安全性有一个比较全面地了解。
荧光增白剂CBS;毒理学数据;FWA-5;染毒; LD50;LC50;环境;降解;接触(暴露);暴露限值(MOE);评估
1. 荧光增白剂CBS概况
1.1 登记号、名称和结构
荧光增白剂CBS在染料索引(Colour Index)中的结构登记号为C.I.荧光增白剂351,在化学文摘(Chemical abstract)中的化合物登记号为CAS No 27344-41-8。
国内、外生产荧光增白剂CBS的厂商众多,商品牌号和名称也不少。国内常见的商品名称有荧光增白剂CBS、351、新荧CF-351、CBS-120、CPC、SFW-X、CBS-X以及超级增白剂CBW等。在国外,其商品名称有Tinopal CBS-X、CBS、SK;Uvitex NFW、SL-PA;Permabrite SPX;Blankophor PAS以及White NFW等。在欧洲的一些文献资料中,CBS也被称为荧光增白剂FWA-5。
荧光增白剂CBS的英文名称为Benzenesulfonic acid,2,2'-([1,1'-biphenyl]-4,4'-diyldi-2,1-ethenediyl)bis-,disodium salt,中文名称为4,4'-双(2-磺酸钠苯乙烯基)联苯。其结构式如图1所示。
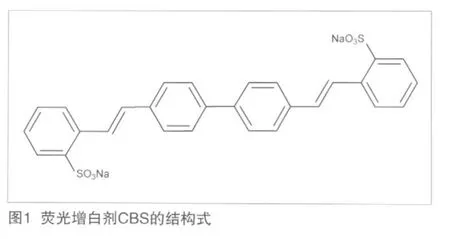
1.2 荧光增白剂CBS的理化性质
荧光增白剂CBS产品有固体和液体两种剂型。固体产品外观为亮黄绿色均匀粉末或颗粒,液体产品外观为淡黄色或黄绿色。产品均呈阴离子型,易溶于水,固体产品在水中的溶解度为25g/L(25℃)、300g/L(95℃)。其辛醇-水分配系数为-2.32(pH 6.8 和25℃),光谱最大吸收波长为349nm,对酸、碱、次氯酸钠和过氧化物稳定。
1.3 荧光增白剂CBS的使用特点
作为洗涤剂中广泛使用的功能性添加剂,荧光增白剂CBS具有以下显著优点:
(1) 适用于多种纤维和织物的增白,如棉、羊毛、真丝、粘胶、涤/棉、涤/粘、锦纶等多种纤维和织物的增白。它还具有明亮的中性色光、较好的色牢度性能。
(2) 性能稳定,用途广。由于其对酸、碱、次氯酸钠和过氧化物具有较高的稳定性,低温溶解度大,所以可广泛应用于洗衣粉、洗衣膏、洗衣液、肥皂、织物整理剂中。它的最佳使用温度为10~60℃,在更低或更高的温度下也有很好的增白效果,在短时间内就可使织物达到很高的白度。因此,荧光增白剂CBS特别适合于亚洲地区冷水洗涤习惯下的织物护理产品。
(3) 累积洗涤白度高,经反复洗涤后不会使织物泛黄或变绿。
(4) 能够显著地增加洗衣粉粉体和肥皂(或香皂)皂体等洗涤产品白度,改善其外观。
(5) 用量少,增白效果好。用于织物洗涤用品时,很少的用量就可以获得很好的增白效果。一般用量范围为0.01%~0.4%。
(6) 毒性极低并且易于光降解和生物降解,对人与环境安全。
正是以上这些特点,使该荧光增白剂成为目前世界上合成洗涤剂行业公认最优秀、最具竞争力的功能性添加剂之一,是高档洗涤剂中不可或缺的组分,其总产量的90%以上用于洗涤剂行业。所以,有的生产厂商又将其称为“超级荧光增白剂”。但是,因价格相对较高,影响了其在低档洗涤剂和肥皂中的应用。
2. 荧光增白剂CBS的毒理学数据
荧光增白剂CBS是QB/T 2953-2008《洗涤剂用荧光增白剂》标准中规定的两类典型产品之一,在国内外的洗涤剂行业已有几十年的使用历史。多年来,其使用安全性一直受到人们的关注,为此人们也进行了大量的毒理学试验。
本文主要根据欧州2003年和日本2007年就该产品对人类和环境的风险评估(HERA)报告及其他相关资料中的试验数据整理而成,供对此感兴趣的读者参考。为叙述方便,下文中将荧光增白剂CBS简述为FWA-5。
2.1 人类毒理学数据
关于FWA-5的人类毒理学数据,研究成果主要关注其可能的皮肤刺激、皮肤致敏反应等方面。
2.1.1 皮肤刺激
Verona公司用10名男性志愿者进行人体实验,研究了FWA-5对人体的刺激性。FWA-5的剂量为0.5g,置于棉毛垫中,然后整天绑缚在10名志愿者的前臂上,持续绑缚6天,结果没有发现刺激性反应。
2.1.2 皮肤致敏
Glashoff、Herzberg和Greffith等采用不同的皮肤接触方式在很多人身上作过实验,有50位志愿者参与FWA-5皮肤接触试验。结果表明,皮肤与5%的FWA-5水溶液接触没有发现皮肤过敏反应,因此认为FWA-5没有皮肤致敏性。
2.2 动物毒理学数据
2.2.1 急性经口毒性
Pericin和Thomann等毒理学家按OECD试验方法进行了试验。每个剂量组各性别至少有5只动物,急性致死试验的受试物使用FWA-5纯品或含量为21.3%的市售商品。结果见表1。表1中的数据表明,FWA-5的经口致死LD50均在2000mg/kg体重以上。
我国在1999年也用大鼠对FWA-5进行了急性经口毒性实验,实验分四个剂量组,分别为464、1000、2150和4640mg/kg体重。结果显示,雌、雄性大鼠的经口致死LD50均在4640mg /kg体重以上。
2.2.2 急性吸入毒性
Duchosal使用Wistar大鼠进行了急性吸入毒性试验。试验分三组,每组雌、雄大鼠各五只,单次经鼻暴露于三种不同浓度的受试物FWA-5中4h。FWA-5含量为90%(氯化钠7%;水3%)的粉末,暴露期间氧浓度稳定在20.902%(体积)。
观察暴露期间和暴露后28天(第三组)的毒性临床症状和死亡率。记录暴露前、后每周的体重,对所有动物进行尸检和肉眼观察。暴露条件和结果见表2。从总的研究结果得出结论,急性吸入的LC50=3.92mg/L空气。
另有一实验:将大鼠置于含有5.5mg/L研细的粉状FWA-5的气溶胶中(粒子线度为2~5mm(40%)、6~25mm(58%)以及26~145mm(2%))中4h,然后观察。在初始阶段观察到大鼠的活动降低,但几小时后恢复正常,无任何病理/解剖变化。
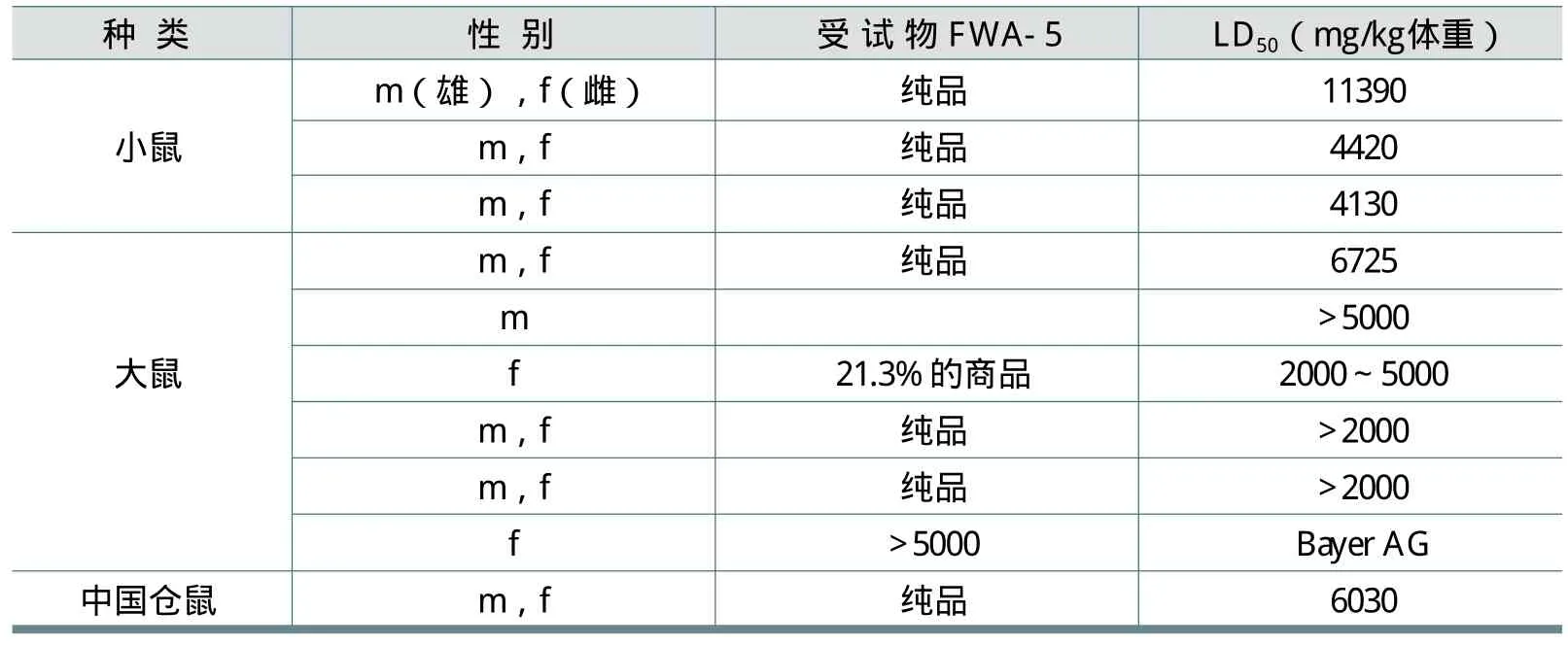
表1 FWA-5的急性经口(灌胃)毒性
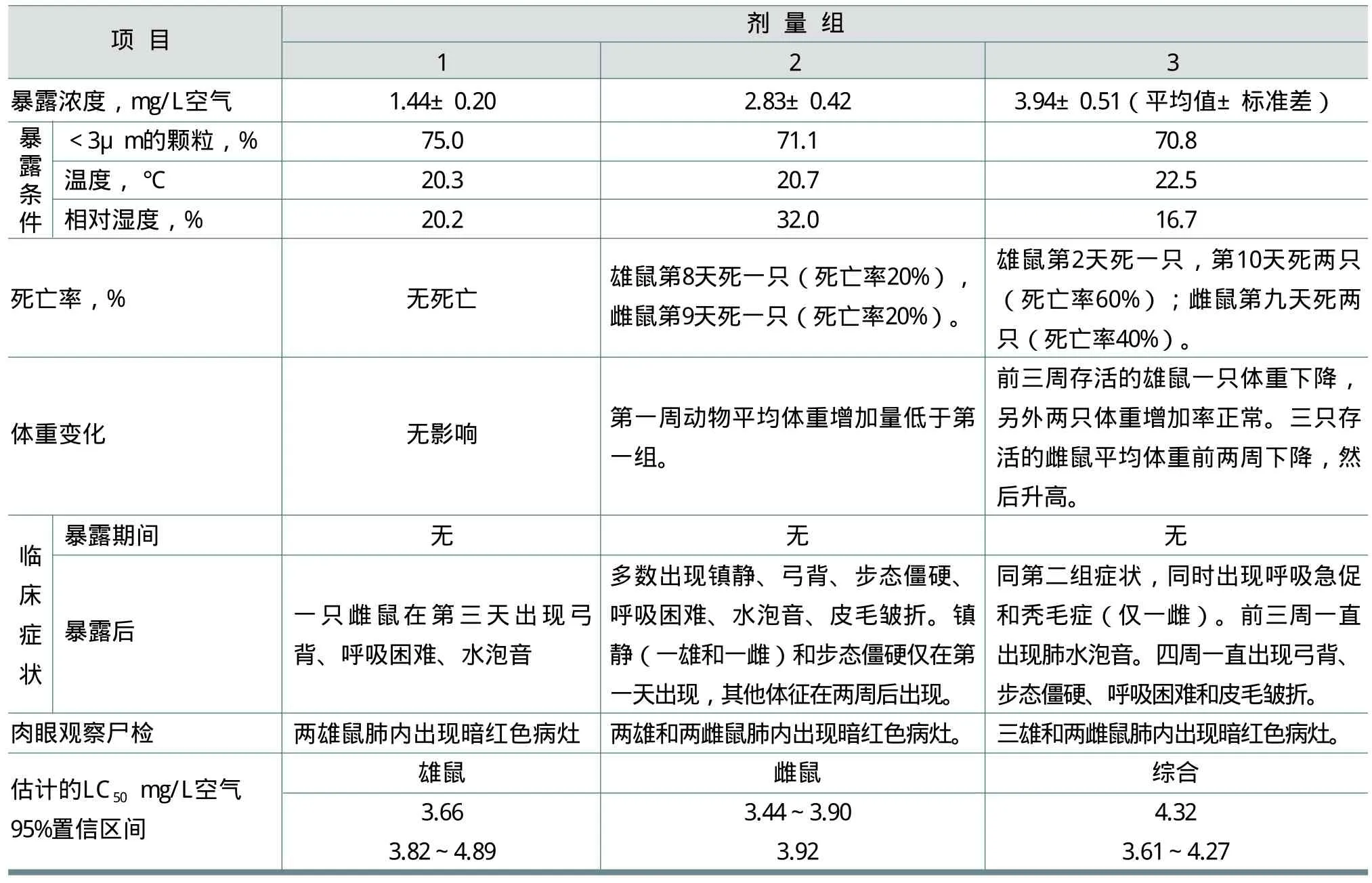
表2 FWA-5急性吸入毒性试验和估计的急性LC50
实际上,非常低的蒸汽压(25℃<7E-16Pa)和很低的亨利常数(25°C时<1E-15)都证实,FWA-5并不会分布在空气中。
2.2.3 急性皮肤毒性
Ullman等用2000mg/kg剂量的FWA-5经皮处理WIST(SPF)雌、雄性大鼠各5只。粉状FWA-5含量为90%(氯化钠7%,水3%),用前制备浓度为0.5g/mL的FWA-5水溶液。大鼠背部去毛后涂FWA-5溶液体积为4mL/kg体重,然后半封闭包扎24h。第一天检查动物的临床体征四次,第2~15天每天检查一次,同时记录死亡率/存活率。给药前1天、第8和第15天分别记录体重。所有动物均进行尸检和肉眼观察。
试验结果:无动物死亡;动物处理部位均出现轻微结痂和变黄;无毒性临床症状;局部症状均在七天后恢复;动物的体重也在正常范围内;尸检时肉眼观察未发现异常。
由于无死亡发生,所以两性别大鼠单次经皮给予FWA-5观察14天的试验,无法得到半数致死剂量。因此,LD50估计值大于2000mg/kg体重。
我国1999年对FWA-5进行了实验,采用Wistar品系大鼠,实验设计了4个剂量组,分别是215、464、1000和2150mg/kg,每个剂量组10只动物,雌雄各半。染毒后持续观察14天,各剂量组均未观察到中毒症状和死亡发生。此实验得到的半数致死量LD50分别为:雄性>2150mg/kg;雌性>2150 mg/kg。
2.2.4 皮肤腐蚀、刺激
FWA-5的皮肤腐蚀/刺激试验的设计和最终报告符合OECD指南第404的要求(1981)。
试验用3只体重2.2~2.3kg的年轻成年雄性新西兰白兔,分养在金属笼中,笼中温度20±3℃,相对湿度30~70%,12h/d循环光照。兔粮为标准粒状,自由进食饮水。实验前,动物适应性饲养至少5d。受试物为21.3%的FWA-5水溶液。
试验前约24h,兔子背部两侧去毛,面积约6cm2。一侧用含0.5mL受试物的2.5×2.5cm纱布覆盖,对侧用对照纱布覆盖,纱布再用不渗透的材料覆盖,然后用胶带固定。持续处理4h。移除纱布后1h、24h、48h和72h对皮肤反应评分。计算各种损伤得分的平均值,结果见表3。
由表3可以得出结论:在目前的试验条件下,FWA-5对皮肤无刺激、无腐蚀。
我国在1999年也用大耳白兔对FWA-5进行了皮肤刺激实验,受试物剂量为0.5g,于染毒后1h、4h、1d、2d、3d、4d和7d进行观察,然后进行刺激反应评分。结果显示,该FWA-5对皮肤刺激强度为“无刺激性”。
2.2.5 眼腐蚀、刺激
Wnorowski等人进行了7项研究。将消费品中常用FWA-5浓度对眼腐蚀、刺激的危害,通过其不同浓度的试验进行了评估。结果见表4。
由表4可见,FWA-5对体重无影响。在10%以上的高浓度会出现眼刺激性,但未发现腐蚀性;1%溶液未发现对眼的刺激作用。
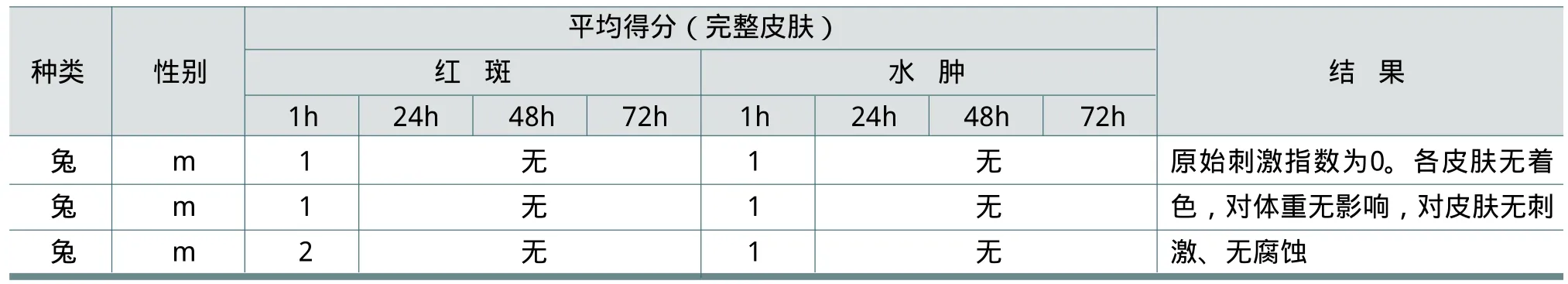
表3 FWA-5的皮肤刺激、腐蚀
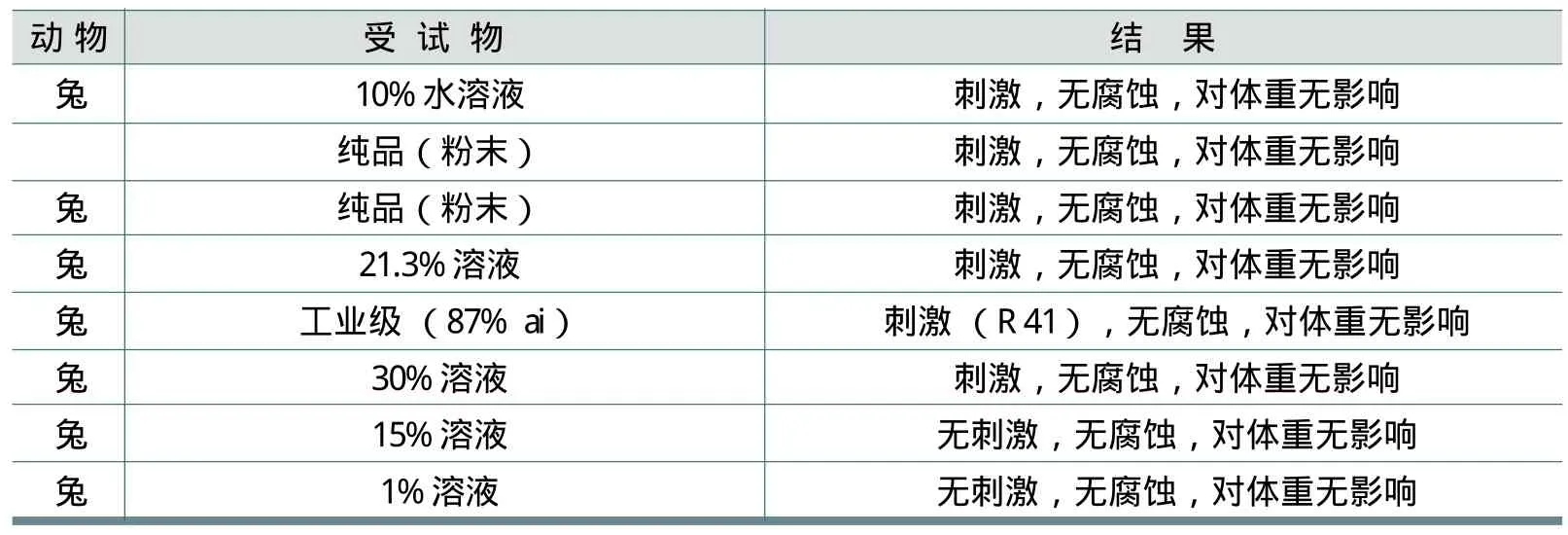
表4 FWA-5的眼腐蚀性、刺激性
我国1999年也用大耳白兔对FWA-5进行了眼刺激实验:雌、雄白兔各两只,动物左眼用于实验,右眼为自身对照。受试物剂量为0.1g,于染毒后1h、4h、1d、2d、3d、4d和7d进行观察,然后进行刺激反应评分。结果显示,FWA-5对眼刺激分级为“轻度刺激性”。
2.2.6 皮肤致敏性
为了评价FWA-5的潜在皮肤致敏性,Ullmann等用30只雌性白化豚鼠进行了最大值试验。受试物FWA-5含量为90%(氯化钠7%,水3%)。
雌性白化豚鼠用表5中的稀释液进行皮内致敏诱导,用含最高无刺激浓度的受试物进行表皮致敏诱导。表皮诱导2周后涂抹含25%受试物的凡士林进行激发。结果见表5。
由表5的结果可以得出结论:在上述试验条件下,FWA-5不具有致敏性。
2.2.7 遗传毒性
Poth、Heidemann、Vo..lkner和Fautz等遗传学家通过以下几个试验,对FWA-5的遗传毒性进行了研究。其试验方法和结果见表6。
细菌回复突变试验:用鼠伤寒沙门菌株TA1535、TA1537、TA1538、TA98和TA100,采用平板掺入法进行Ames试验,以检测FWA-5的致基因突变的能力。
体外染色体畸变试验:用中国仓鼠肺成纤维细胞(V79)检测FWA-5及其经S9代谢活化后致染色体畸变的能力。
小鼠骨髓细胞微核试验:用于检测FWA-5诱导小鼠骨髓嗜多染红细胞微核形成情况。
Wistar大鼠肝细胞非常规DNA合成试验:用于检测FWA-5在体内、外诱导DNA损伤并启动修复合成的能力。
综合上述实验的结果:体内、体外遗传毒性评价试验证据的权重表明,FWA-5不具有致突变性。
2.2.8 重复剂量毒性
Basler用大鼠进行了一项符合GLP的慢性-致癌性终生喂养研究试验。在饲料中加入0、500、5000和50000ppm剂量的FWA-5。根据饲料的化学分析和摄食量结果得到的等效剂量雄鼠为19、190和2300mg/kg/d,雌鼠为21、226和2620mg/kg/d。受试物FWA-5 含量为86%(氯化钠7%,水7%)。结果见表7。
由此可以得出结论:该试验中雄鼠未观察到有害作用剂量(NOAEL)为190mg/kg/d,雌鼠为226mg/kg/d。高剂量组大鼠出现胰脏增生和外分泌腺腺瘤。胰腺癌出现在高剂量组的雄鼠体内,可能与受试物FWA-5处理有关。
针对上述胰腺出现腺瘤和癌可能与FWA-5处理有关的结论,Bouis、Weber和Woutersen等毒理学家通过以下试验对胰腺致瘤性的机制开展了进一步研究。
Bouis通过表8中两个试验研究了FWA-5对大鼠胰腺外分泌的急性刺激作用。试验中消胆胺为胆汁酸盐与树脂的结合物,可以营养大鼠的胰脏;camostat(卡莫斯他)是一种胰蛋白酶抑制剂和外分泌胰腺生长促进剂;ODC为胰脏鸟氨酸脱羧酶。大鼠染毒一定时间后处死。试验结果见表8。

表5 FWA-5的致敏性

表6 FWA-5遗传毒性试验方法和结果
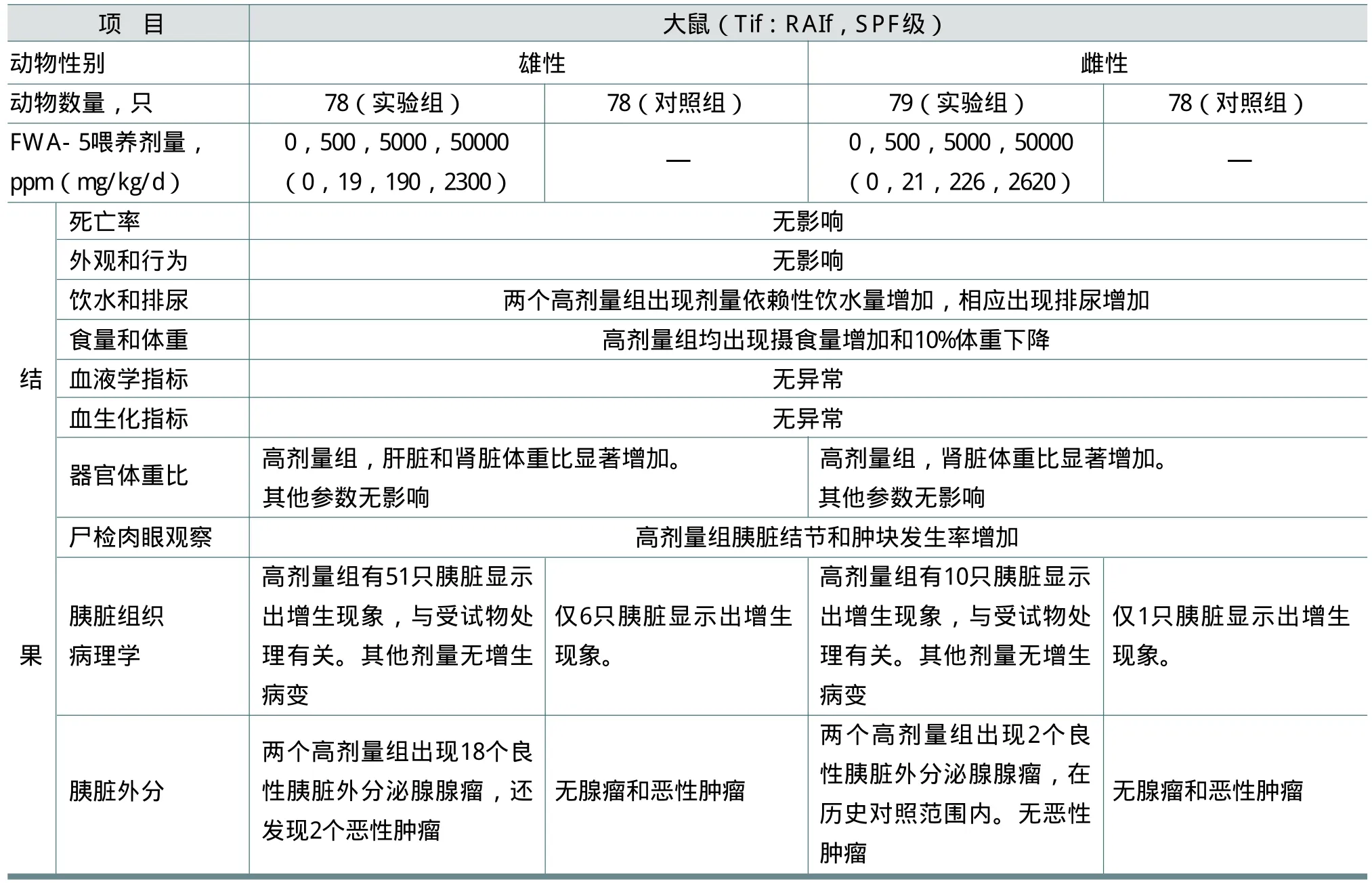
表7 FWA-5的重复剂量毒性试验
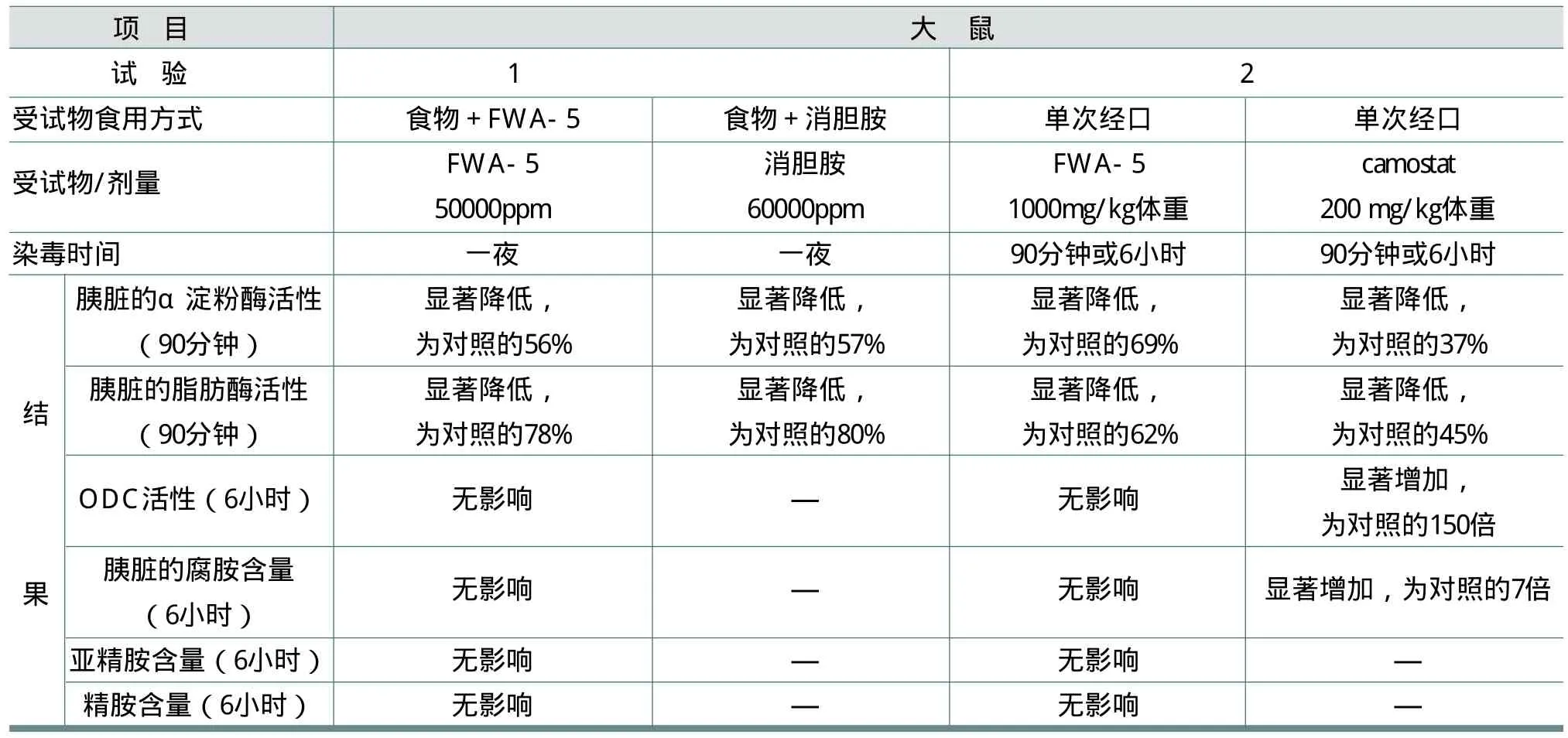
表8 胰腺致瘤性的机制研究
从表8可见,FWA-5同消胆胺和卡莫斯他一样可以刺激胰脏酶的分泌,但不影响胰脏ODC活性和多胺的含量。
Weber通过表9中的试验来研究FWA-5对雄性大鼠胰脏外分泌的刺激作用。大鼠在不同时间期限喂食混有10000ppm或50000ppm的FWA-5直到28d。其他动物在相同的时期通过口腔插管给予200mg/kg/d的卡莫斯他。
由于混有FWA-5的食物热量低,导致大鼠食物利用能力降低,体重降低,摄食率增加。胰脏相对重量的增加是由于用50000ppm FWA-5处理引起胰脏肥大和胰腺腺泡细胞增殖增加以及胰脏蛋白含量一定程度的增加所致。用卡莫斯他处理引起胰脏明显的肥大和增生,导致胰脏重量明显的增加和胰腺蛋白含量一定程度的增加。
胰脏多胺类物质在细胞增殖和分化中发挥重要的作用。Loser和Weber等人的研究表明,卡莫司他和喂食50000ppm FWA-5 28天可以引起胰脏多胺类物质明显增加和刺激雄性大鼠胰腺外分泌的生长。
Woutersen等人的研究认为,刺激胰腺生长可以促进非遗传性胰腺肿瘤的形成。胰腺刺激的最初迹象在喂食50000ppm FWA-5 28天后出现,因而终生暴露可有充足的暴露时间按照常规的进程引起恶性肿瘤:如Basler进行的两年大鼠喂养试验中看到的增生和腺瘤导致的胰腺癌。
由于FWA-5不具致突变性和遗传毒性,根据非遗传致癌的观点,存在低于观察不到亚慢性改变继而不引起肿瘤发生发展的阈值(Purchase 1994)。从目前的数据看,5000ppm和10000ppm FWA-5在亚慢性效应的阈值之下。因此,在这些剂量下,终生致癌性研究观察不到肿瘤的发生(Basler 1990)。
综上所述得出如下结论:胰腺的肿瘤发生不是一个遗传效应,是一个有阈值事件。也就是说,喂食大剂量FWA-5(50000ppm)的大鼠胰腺发现了肿瘤,是由于FWA-5的刺激终生施加在胰腺上所致,与遗传毒性引起的肿瘤不同。这种肿瘤产生的阈值可认为是在无毒性反应剂量以下的用量不会产生肿瘤。
2.2.9 致癌性
Forbes和Urbach等人进行了一项FWA-5光致癌性试验。用0.1%的FWA-5水悬液浸润无毛小鼠,每天光照20min,每周5d,持续40w周,动物未出现肿瘤。
还有一项关于FWA-5的动物光毒性和光致癌性试验:试验动物为突变型无毛小鼠(Skh∶hairless-1),6~8周龄,饲养在定制的不锈钢照射笼内,试验期间自由进食饮水。光源为6kw的长氙弧灯。用滤光片滤去波长小于290nm的紫外线和减弱红外线,以便模拟中纬度海平面的太阳光谱。
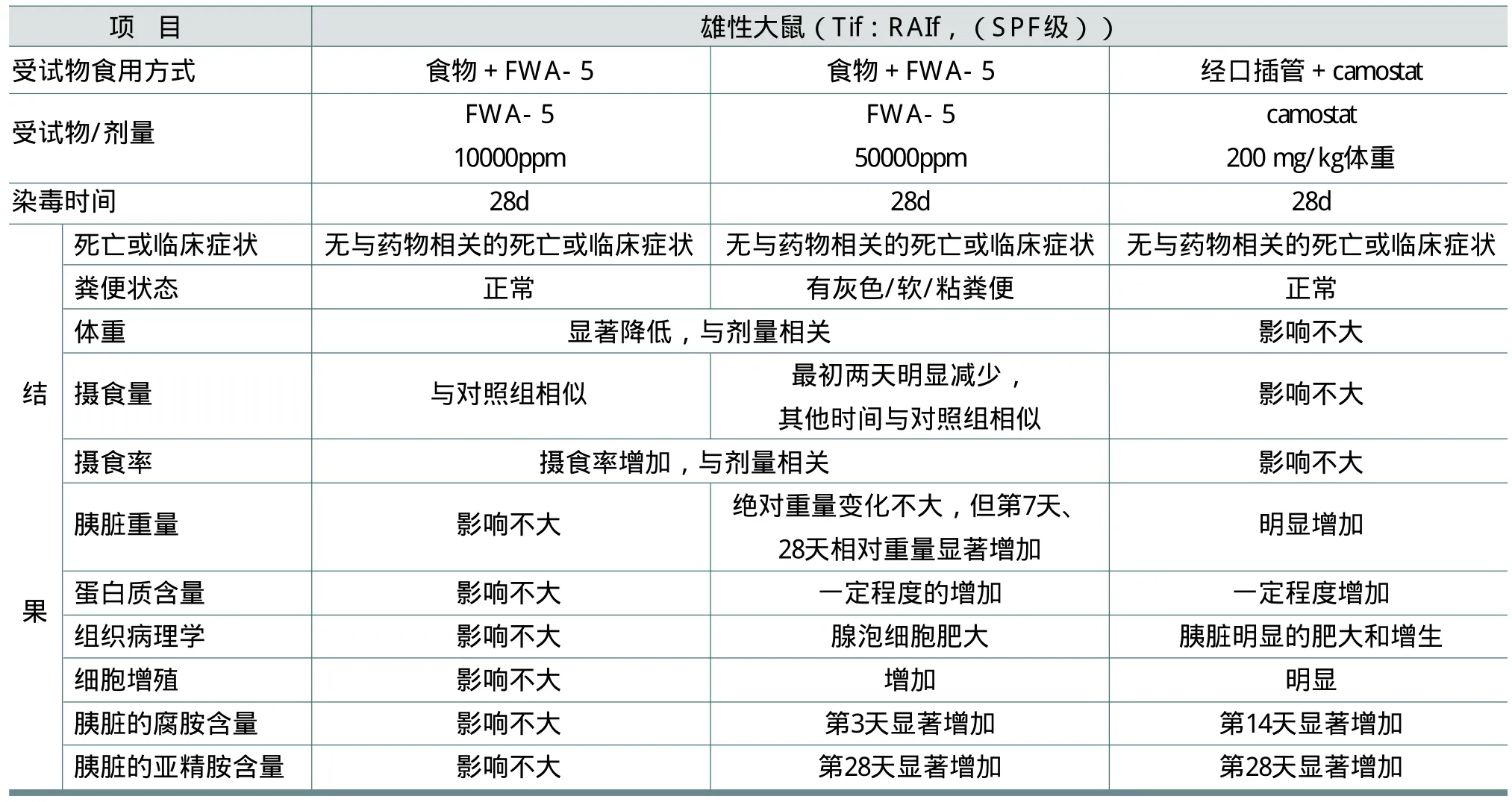
表7 FWA-5的重复剂量毒性试验
氙灯长轴竖直悬挂,照射笼排放在灯管周围。笼子边缘的紫外线通量由锆WL767光电管进行监测。平均紫外照射通量为0.042W/m2红斑有效能量(EEE),每天照射2h(周一至周五),每日最大表面剂量为300J/m2。
试验过程:为减少笼子位置因素对试验结果的影响,笼子应每日转换位置,每周清理一次。每个笼子中有6只位于独立小室中的无毛小鼠。
受试物溶液为室温(27℃),存放在玻璃盘中。光照开始前30~60min将鼠笼置于玻璃盘上,使受试物溶液液面达到距笼子顶部1cm处。小鼠头部外露,其他部位全部浸于受试物溶液中,保持2min。小鼠能很快适应这种处理方式,其生长及寿命与正常饲养相比均没有明显差别。在小鼠第一次光照处理前,用这种方式每日用受试物溶液处理2周。
受试物溶液(见表10)每日现用现配,溶剂为蒸馏水。其中8-MOP为8-甲氧基补骨脂素。
在光毒性试验中,用表10中溶液按上述方式处理小鼠,30min后用长氙弧灯照射2小时。
在光致癌性试验中,24只小鼠用表10中的溶液按上述方式处理后用长氙弧灯照射,照射5天/周,持续40周。另有24只小鼠作为对照组不接受照射。结果见表10。
试验还发现,肿瘤多出现在小鼠的体侧,背部中线,头部,耳部,口鼻部及腹部肿瘤出现少。
鉴于试验动物实际接触FWA-5的剂量未知(两周受试物浸润小鼠后,经过与单次接触不同浓度的FWA-5甲醇溶液的小鼠的紫外光照射对比,估计FWA-5在皮肤表面的含量约为1mg/cm2),所用动物数量较少及评估动物反应的信息不足,此试验的可靠性有限。但是,该研究为“在接触含有FWA-5的洗涤剂并同时受紫外线辐照的最坏情况下,FWA-5也不具有光毒性和致癌性”的结论提供了证据支持。
2.2.10 对生殖的影响
Haley采用大鼠三代繁殖试验来检测FWA-5对生殖的影响,试验分为饲料中加入FWA-5的试验组和不加FWA-5的对照组,结果见表11。
表11的试验结果表明:FWA-5对大鼠的生殖没有影响。但是,Haley试验是在工业生物检测实验室(Northbrook, Illinois, USA)进行的,HERA(欧洲家用洗涤产品成分对人类及环境的风险评估)报告中认为这项研究提供的数据不完全可靠。
Basler在大鼠终生喂养试验中也发现,雌、雄大鼠性器官重量,肉眼观察及组织学检查均未发现与FWA-5处理相关的有害效应。这个间接的试验证据,也可以推测FWA-5不具有生殖毒性。
2.2.11 发育毒性(致畸性)
FitzGerald用白化鼠对FWA-5的母体毒性、胚胎毒性、胎儿毒性和致畸性进行了试验研究。经剂量选择,确定FWA-5剂量为1000mg/kg.bw。FWA-5的含量为86.4%,溶于羧甲基纤维素(CMC,0.5% w/w),灌胃染毒;CMC溶液作为对照组。
大鼠:将雌性、未生育的2月龄SPF级大鼠随机分为两组,每组24只。用确定可生育的同种雄鼠与雌鼠1∶3合笼。若阴道灌洗发现精子或阴栓,将雌、雄鼠分离并定为孕第0天。在雌鼠孕第6至第15天,以0或 1000mg/kg.bw的剂量灌胃,灌胃量为20mL/kg.bw(基于每日体重)。
雌鼠在有柔软垫料的笼中单笼饲养,室温23±3℃,湿度30~70%,12小时/天循环光照,自由进食饮水。交配前雌鼠至少适应7天。孕第21天处死,剖腹取出胚胎并检查。每窝中取出约半数胚胎,经固定用威尔逊切片技术进行内脏器官检查;剩余胚胎经固定、KOH溶液清洗及茜素红S染色以进行骨骼生长发育状况检查。结果见表12。

表11 FWA-5对生殖的影响试验
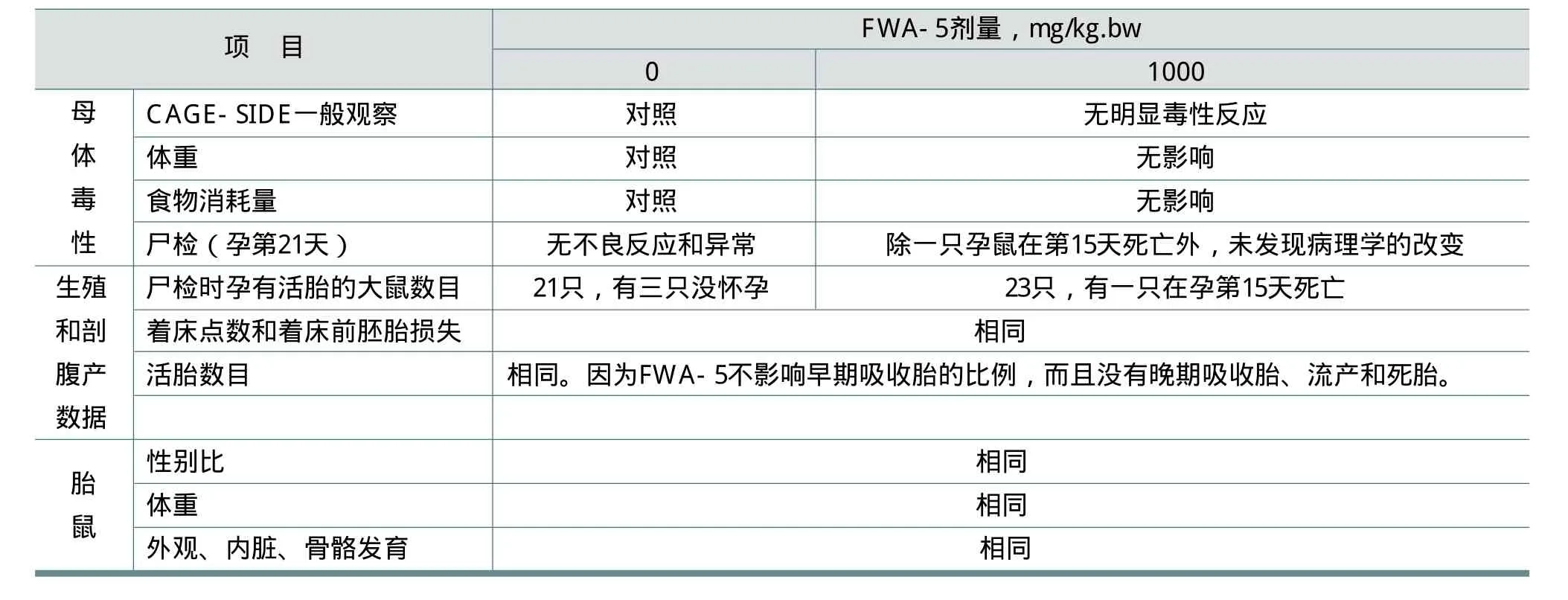
表12 FWA-5发育毒性(致畸性)试验
从观察终点的数据分析可见,处理组与对照组没有明显差别。FWA-5在1000mg/kg的限定剂量下对亲代大鼠和胎鼠没有毒性。没有发现潜在胚胎毒性和致畸性的证据。
2.2.12 新陈代谢(体内蓄积)
Rose于1972年进行了一项研究。一次经口给予大鼠14C-FWA-5 5mg/kg体重(2.09mCi/mg),96小时后处死,检测组织中的标记物14C。每日分别收集给药的雄、雌性大鼠各4只呼出的二氧化碳、尿液和粪便。结果显示,FWA-5在雄、雌性大鼠的肝、肾、脑、肌肉、身体脂肪和血液中都没有蓄积,在尿中发现微量的FWA-5(剂量的0.03%)。呼出气中没有带标记的二氧化碳。
粪便是排出FWA-5的主要途径:给药48h后在粪便中发现90%给药剂量的FWA-5。这一点被粪便提取物与FWA-5标准品的硅胶板薄层色谱的比对所证实。雄性大鼠的排泄半衰期为8.2h,雌性为13.6h。这项研究放射性物质的回收率为94%~96%。
另外,FWA-5拥有较强的水溶性和比较低的辛醇-水分配系数KOW,这也提示FWA-5在生物体中蓄积性很小。
2.2.13 经皮吸收
Wollny对猪皮肤体外14C-FWA-5的渗透情况进行了研究。猪耳在猪屠宰当天(被蒸汽清洁前)获得,用冷水冲洗、洗净外耳,仔细刮去猪毛后,剥离、取皮,皮肤厚度在2~3mm。使用前将皮肤样品存放在冰箱中(一周之内)。在渗透试验过程中与受试物FWA-5接触的皮肤表面积为1.13cm2。
为了检测FWA-5的吸收情况,将皮肤放在直径1.13cm2(皮肤面积)体积为7mL的玻璃扩散池中。扩散池分为上(供给室)、下(接受室)两部分。记录放入每一个扩散池中的接受室内生理盐水(0.9%氯化钠溶液)的体积,供给室中加入200uL用二次蒸馏水溶解的FWA-5。
FWA-5有三种浓度(1、10和100ug/mL室体积),每种浓度使用四个池,用胶膜盖住供给室的顶部。将扩散池放入37℃的保温箱中。在0、0.5、1、4、8和24小时后从接受室中取出样品(0.5mL),进行液体闪烁计数分析。每次从接受室中取出样品后立即补加0.5mL新鲜的接受液以保持接受小室中液体体积恒定。通过绘制时间与接受室中受试物浓度增加的关系曲线测得渗透率。
用已知可以透过猪皮肤的14C-甘露醇作为阳性对照。对照显示出14C-甘露醇渗透与时间的相关性,渗透常数为1.3×10-4cm/h。由于100ug/mL FWA-5组中一个室发生渗漏,所以四个扩散池中只有三个可用于评估。暴露于猪皮肤的FWA-5在长达24小时的时间内,任何浓度的FWA-5都没有在经皮透过的接受液中检测到。
由于试验设计合理,并且欧盟化妆品和非食品类产品委员会(SCCNFP,1999)认为猪皮肤作为人类皮肤的代表物是合适的,所以这项检测皮肤穿透性的试验结果可信。
此项研究结果表明,FWA-5不能透过全层皮肤。然而,目前对体外经皮渗透研究结果(SCCNFP,1999)的解释指出,一种可以被皮肤吸收的物质不仅要在接受室(透过)检测到,而且要在角质层下的皮肤层检测到。皮肤层中检测到的物质可以经皮肤血液循环而被吸。因此,可以保守地假定部分皮肤通过血液循环吸收FWA-5是存在的。
FWA-5分子与织物具有亲和力。那么,假设它与皮肤有亲和力而使它的经皮渗透受到限制也不是不可能的。
2.2.14 雄、雌激素受体的体外结合实验
该试验研究了浓度为5×10-4~5×10-10的FWA-5,在体外与来自大鼠前列腺的雄激素受体新鲜的胞液制备物结合的潜能;并与氚标记的雌二醇(Twomey 2003a)阳性对照物进行了比较。结果显示,FWA-5不能与雄激素受体结合,不能取代或与雄激素竞争受体。
在第二个实验中研究了浓度为5×10-4~5×10-10的FWA-5,在体外与来自大鼠子宫的雌激素受体的新鲜的胞液制备物结合的潜能;并与氚标记的甲雄三烯醇酮(Twomey 2003b)阳性对照物进行了比较。结果显示,FWA-5不能与雌激素受体结合,不能取代或与雌激素竞争受体。
3. FWA-5对人类的安全性评估
关于FWA-5对人体健康的影响,根据FWA-5在洗涤剂中的应用和消费者可能接触(暴露)FWA-5的途径(如洗涤衣物时或穿着洗过的衣物时从洗涤液转移到皮肤的量,穿着时从衣服转移到皮肤的量等),估算出通过皮肤吸收到体内的吸收率,即可算出人体的总暴露量。再从安全性试验的结果求出每日容许的摄入量(即假设一生中即使每天摄取,也不会产生影响的摄取量),同暴露量进行比较。根据比较的结果推断FWA-5影响人体健康的风险,或通过未观察到有害作用剂量(NOAEL)和全身估计接触(暴露)剂量(SED)的比值——暴露限值(MOE),来推断FWA-5对人体的安全性。
3.1 欧州
3.1.1 消费者接触(暴露)FWA-5的途径
根据FWA-5的用途,欧州有关FWA-5对人类及环境的风险评估(HERA)报告中认为,消费者可能接触(暴露)FWA-5的途径如下:1)皮肤直接接触含有FWA-5的洗涤产品;2)从衣物纤维中释放出FWA-5;3)吸入洗衣粉的粉尘;4)手洗衣物或餐具时FWA-5浸入皮肤;5)经口摄入残留在橱具和餐具上的FWA-5;6)舔或吸吮经FWA-5处理过的纤维;7)食物和饮水;8)眼睛接触到含有FWA-5的产品;9)无意或有意地过量暴露。
3.1.2 消费者可能接触(暴露)FWA-5的量以及暴露限值
在HERA指导文件中,欧洲肥皂与洗涤剂工业联合会(AISE/HERA,2002)发表了有关消费者暴露及“西欧消费产品的使用方法与习惯表”,表中给出了洗涤产品的使用数据,如克/次、使用频率、每次洗涤的时间等。尽管表中给出了最小、最大以及典型的使用频率和使用量,但是在FWA-5的HERA中取了平均值或中位数用于暴露评估,以便需要时进行优化。有时需要作出进一步的假设,如手洗衣物时皮肤接触水量是基于假设一个厚0.01cm(EU TGD,1996欧盟风险评估的技术指导文件)的膜均匀地分布在面积为1980cm2的皮肤表面等。
根据上述消费者接触FWA-5的途径,在FWA-5的HERA报告中给出了各种情况下可能的最大接触量(mg/kg体重/天或mg/kg BW/d),结果见表13。表13中,MOE为暴露限值,即为未观察到有害作用剂量(NOAEL)与全身估计接触(暴露)剂量(SED)的比值,MOE值越大,FWA-5的使用越安全。
由于FWA-5主要应用于洗涤产品中,而消费者在很长一段时间内会重复多次使用洗涤产品。大鼠终生喂养FWA-5试验(见2.1.8)与在消费品中使用FWA-5的情况是最相似的。所以,选择雄性大鼠两年终生喂养试验的NOAEL =190(mg/kg体重/天)用于上述风险评估,以求得消费者与FWA-5各种接触(暴露)途径下的暴露限值(MOE)。
在家庭中无意或有意地直接过量暴露于FWA-5很不常见,但消费者可能会通过某种消费产品而暴露于FWA-5。FWA-5在产品中用量很低(欧洲为0.14%),而可以引起急性致死的剂量为2000mg/kg体重,可见急性暴露于FWA-5的风险很低,所以评估时对此没有关注。
眼睛偶然暴露于FWA-5只出现在使用配方产品的消费者中,这种暴露不大可能引起身体吸收。由于1%的FWA-5溶液对兔眼没有刺激性,并且FWA-5的使用浓度通常小于1%,因此认为FWA-5的眼刺激对配方产品的总体眼刺激危害没有贡献,可忽略。
由表13还可以发现,人类暴露于FWA-5的暴露限值MOE值很大。这样大的MOE值足以覆盖任何不确定的毒理学(危险性)数据以及从动物实验向人类安全性外推的不确定性。因此,人类通过消费产品接触(暴露)FWA-5是安全的。
3.2 日本
3.2.1 消费者接触(暴露)FWA-5的途径
日本肥皂洗涤剂工业协会2007年关于FWA-5对人体健康和环境影响的风险评估报告中认为,人体可能暴露于FWA-5的典型途径有三种:1)洗涤过程中的经皮暴露;2)衣类穿着中的经皮暴露;3)食品和饮用水引起的经口暴露。
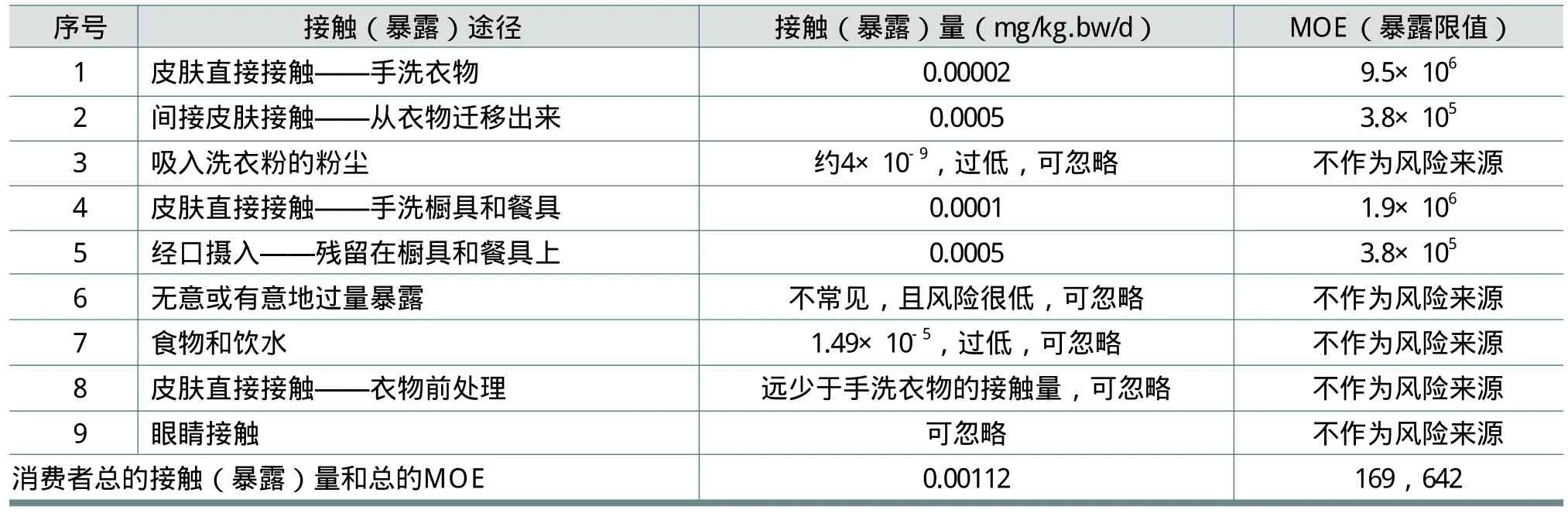
表13 欧洲消费者与FWA-5的接触途径、接触(暴露)量和MOE
3.2.2 消费者可能接触(暴露)FWA-5的量以及日容许摄入量
日本洗协以欧洲FWA-5风险评估报告中雄性大鼠终生喂养试验(见2.1.8)的未观察到有害作用剂量(NOAEL)190mg/kg bw/d为基础,考虑到人与动物的差别为10倍,个体差异为10倍,采用100作为评价系数(不确定系数),认为人体每日容许摄入量(TDI)为1.9mg/kg.bw/d,用于风险评估。表14所示为从各途径估算的暴露量。
从表14可见,消费者总的暴露量0.000472mg/kg.bw/d,远低于人体每日容许摄入量(TDI)1.9mg/kg.bw/d。由此可以得出结论,FWA-5影响人体健康的风险很低。
4. 环境中的FWA-5
4.1 FWA-5的吸附、降解和降解途径
表15为不同试验条件下FWA-5的吸附、生物降解和光降解情况。
根据OECD 301,总的来说荧光增白剂不容易生物降解。但是,在瑞士的实地研究证实了其在河流和湖泊中的快速光诱导反应。据介绍,溶解在水中的FWA-5,一旦暴露在阳光下,几分钟之内便转换成光异构体。其中85%的FWA-5不发生变化,为具有荧光的反式异构体,另15%的FWA-5转化为无荧光的顺式异构体。
光降解作用使FWA-5最初产物有1a(苯甲醛-2-磺酸盐)和另一个光不稳定产物1b。1b缓慢降解为1c(4,4'-联苯二甲醛)。1a和1c两种光降解产物在OECD 301F中都被证实易于生物降解。因此,降解由两步组成,光解之后是生物降解。结合率和DOC(可溶性有机碳)的降低都能证实二苯乙烯联苯衍生物能被生物降解。FWA-5光照条件下的降解途径如图2所示。
4.2 河流中FWA-5的浓度
Hochberg 等在德国进行的研究中,合理地考虑了最坏的情况,选择了人口密度较高并且有标准污水处理厂的5条河流(两条在德国东部),对上、下游FWA-5浓度作了监测,结果见表16。
瑞士的水样数据来自于11个能代表三种不同类型集水区的水文控制站点,每个站点采集了13个水样(包括两周混合水样)。分析结果见表17。表17中,Ⅰ为阿尔卑斯河流:人类活动的影响小;Ⅱ为大河:位于高原,与湖泊相连,受人类活动影响;Ⅲ为小河:人口稠密的集水区。数据采集时间为1995年1月~1996年1月。
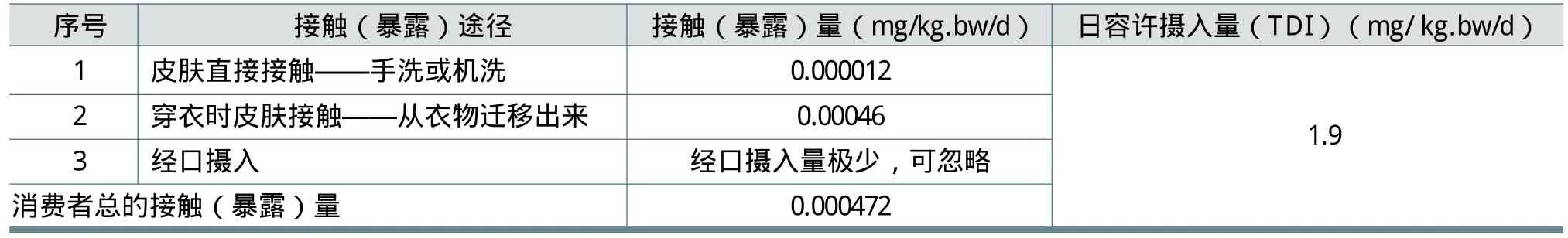
表14 日本消费者与FWA-5的接触途径和接触(暴露)量
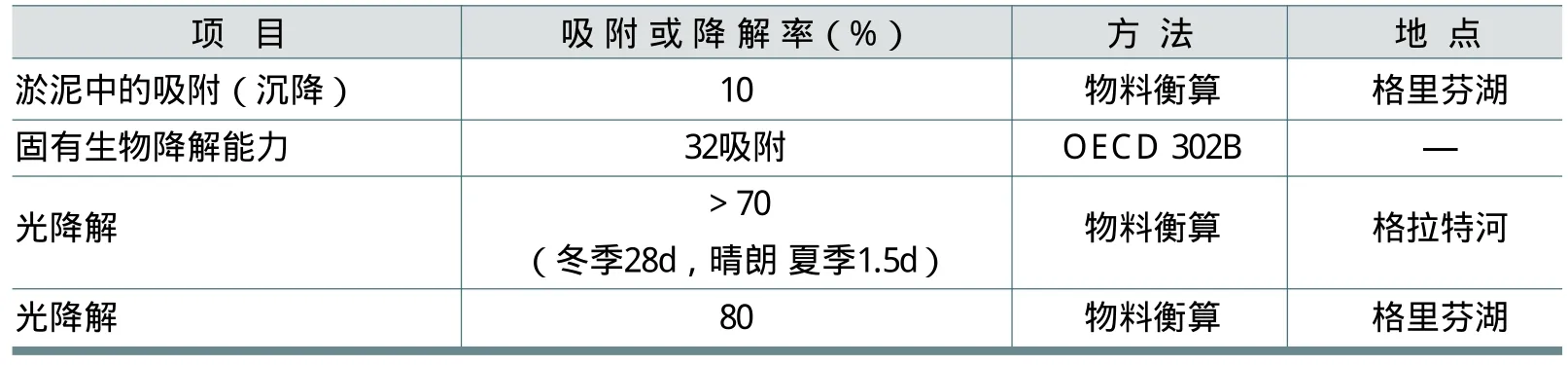
表15 FWA-5的吸附、生物降解和光降解
表中Glatt河处于人口密度最大的集水区,几乎代表了欧洲最差的河流状况。稀释因子低至2.5。
据介绍,德国和瑞士监测的所有河流的FWA-5浓度都比较低。在德国和瑞士的20多条河流和湖泊中,测量得到的FWA-5平均浓度范围为20到644ng/L之间,中位数大约为50ng/L左右。
在日本,大部分含FWA-5的生活污水都经过处理,少部分被直接排放到公共水域,造成水中存在着微量的FWA-5。1997~1998年在关东地区的多摩川和隅田川进行的调查中,检测出FWA-5浓度在 1~6.4μg/L之间(林等,2002)。在2004年对全日本18河流进行的调查中,检测出FWA-5浓度在0.002~3.66mg/L之间(真名垣等,2005),见表18,其中BOD为生化需氧量。在此类调查中,FWA-5最高浓度为6.4mg/L。
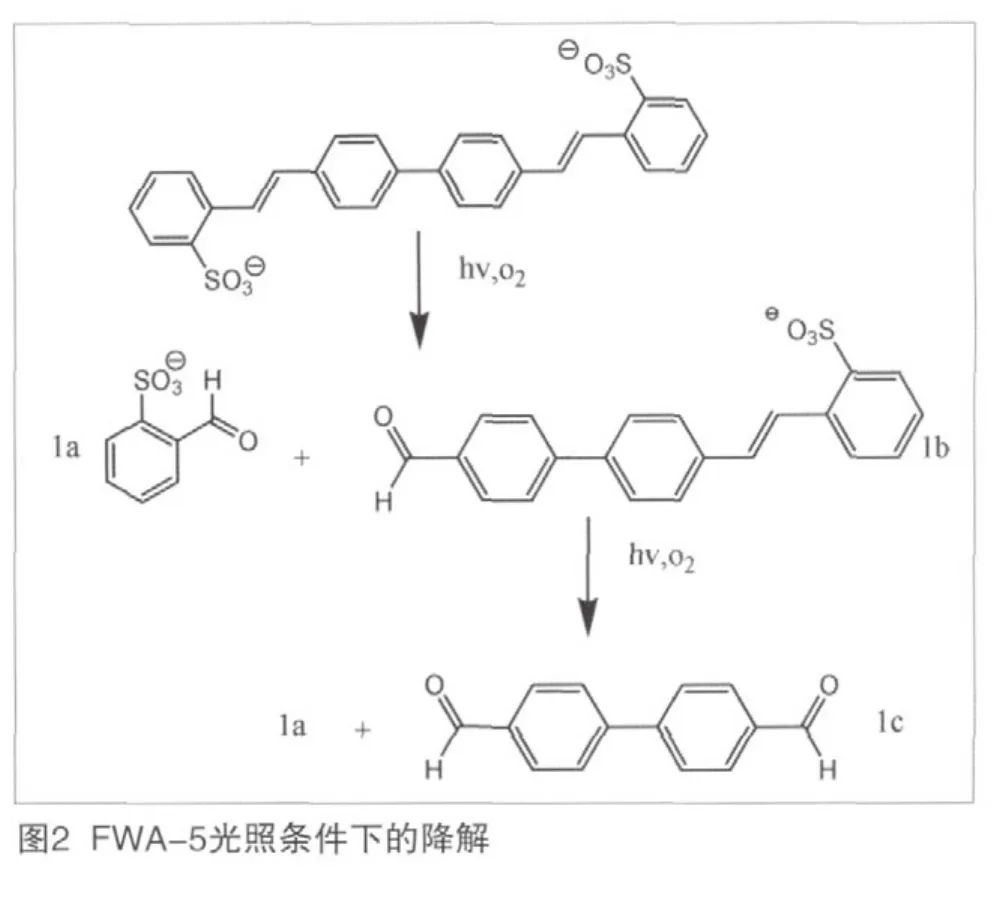
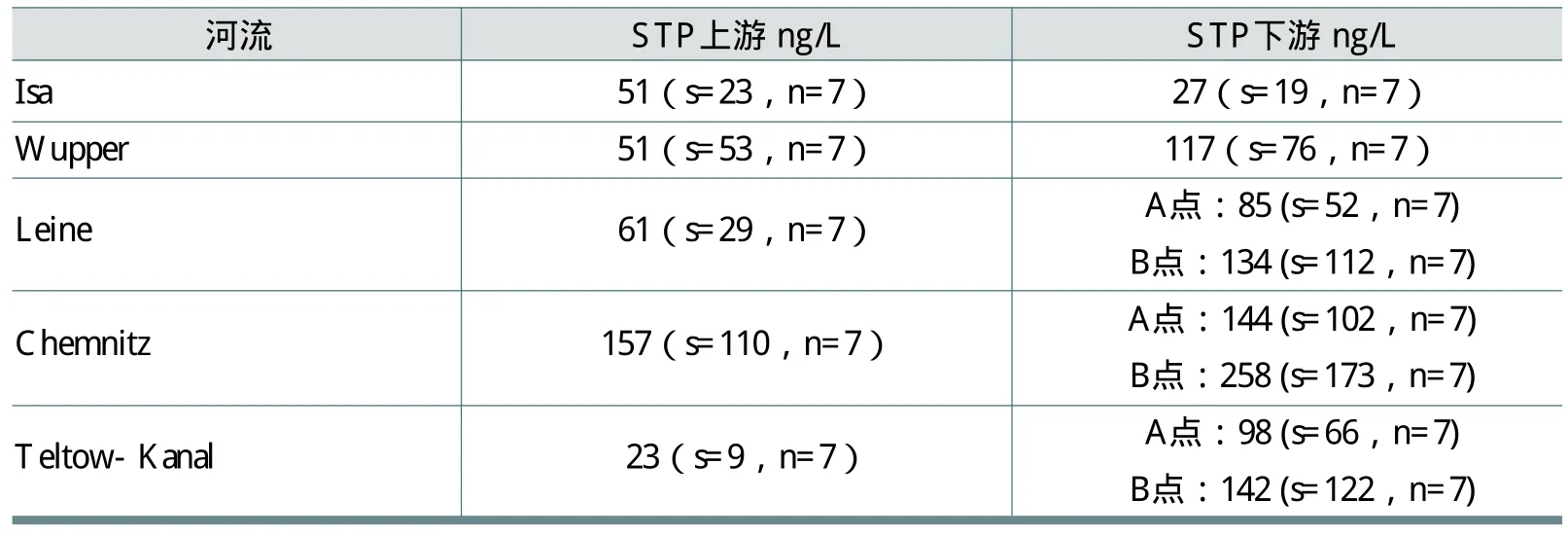
表16 德国河流中FWA-5的浓度
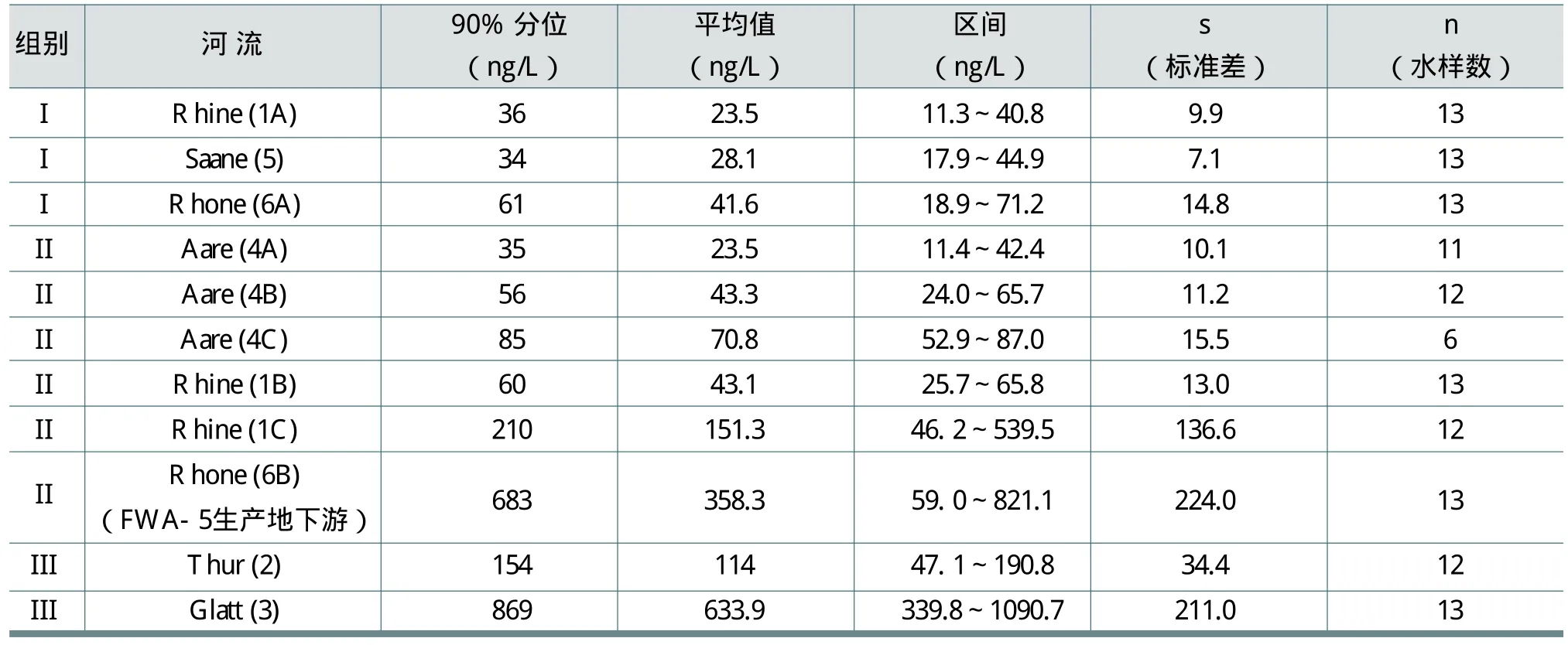
表17 瑞士河流中FWA-5的浓度
以上这些检测数据虽然来自于日本全国范围的调查,但毕竟调查地点有限。为此,日本学者对现有的数据进行了BOD和FWA-5浓度的相关性分析,对于未调查水域水中FWA-5浓度进行了估算。其估算结果为,稍微汚染的河流为5.04mg/L,污浊的河流为10.86mg/L,这与实际调查结果无大差距。
4.3 湖泊沉积物中FWA-5的浓度
瑞士格里芬湖(Greifensee)代表了欧洲状况最差的一个水域,湖中沉积物FWA-5浓度见表19(监测分析时间为1993~1994年)。
4.4 土壤中FWA-5的浓度
由于污水、污泥会作为肥料使用,所以FWA-5在土壤中的风险问题也受到关注。瑞士联邦理工学院开展了一项关于水资源与水污染控制的研究,但在FWA-5的HERA报告发布时还没有得到结果,预测土壤的RCR(见表24)将<0.0001。
4.5 雌激素效应
人们普遍关注排入下水管道的FWA-5的雌激素活性。Blair等人将FWA-5与188种自然及异源性化合物结构进行了仔细对比,未推断出相似性。在大鼠体外实验中(见2.2.14),也没有观察到内分泌和雄激素作用。
4.6 对植物的影响
有的研究者用含有FWA-5的营养液培养植物如玉米和豆类,营养液渗入其根部膜皮,但FWA-5只在植物根部表面积累而不会透入其根茎、叶、花和果实中。也就是说,植物并没有在其内部富集FWA-5的能力,而是将其吸附在其根部。这表明,FWA-5对农作物有很高的安全性。
4.7 水生生物、陆生生物和微生物的毒理学数据
表20 列出了欧洲水生生物、陆生生物和微生物的检测方法和结果。表中NOEC为无可观察的毒性效应浓度。
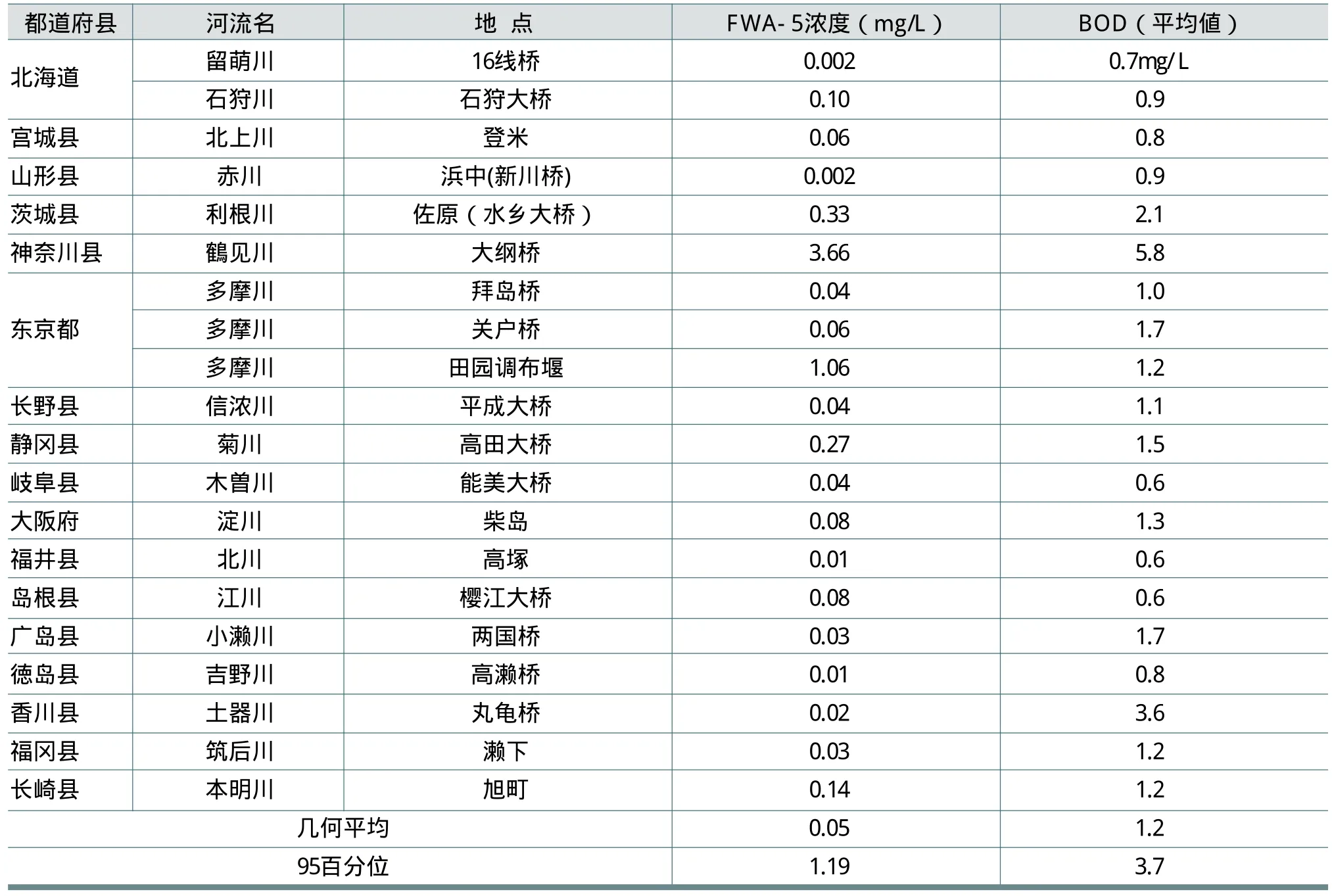
表18 河流中的FWA-5浓度(真名垣等,2005)
在日本环境省的生态毒性评估工作中,也调查过FWA-5对水生生物的毒性(1996年),结果见表21。
5. FWA-5对环境的安全性评估
由于FWA-5水溶性很好,辛醇-水分配系数KOW很低,表明其在生物体内的蓄积可忽略不计。很低的蒸汽压和低的亨利常数证实了其并不分布在空气中。此外,FWA-5没有水解作用。通过这些发现,可以把FWA-5最终的转归评估重点放在水、污泥、沉积物和土壤中。
5.1 欧洲
在HERA报告中,关于FWA-5对环境影响的评估,采用的是“欧盟物质评估系统(EUSES)”软件,它包括数学模型和由TGD描述的评估过程。其基本的模型是评估化学品在水、污泥、沉淀物、土壤中的分布及其对环境的风险。通过对环境模块(水、污泥、沉积物、土壤)计算/测量得到的数据,推导出预测的环境浓度(PEN)和预测的无效应浓度(PNEC),然后根据它们的比值RCR(RCR=PEC/ PNEC)评估FWA-5对环境的风险:RCR值越小,其对环境的风险越小,使用越安全。
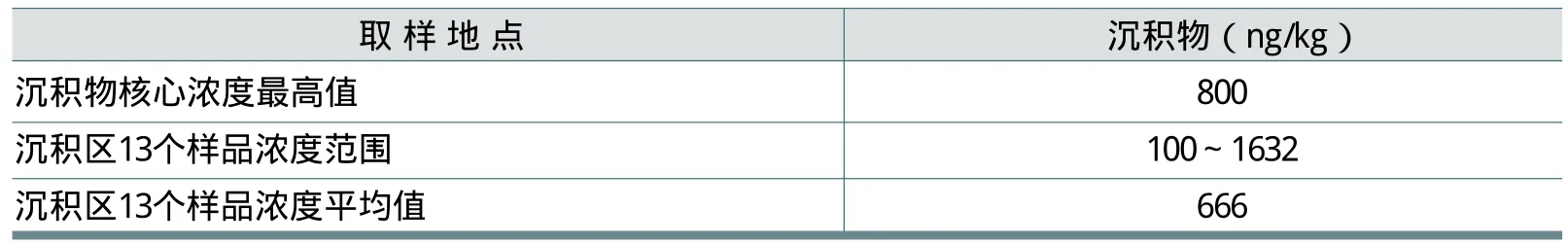
表19 格里芬湖湖中沉积物浓度
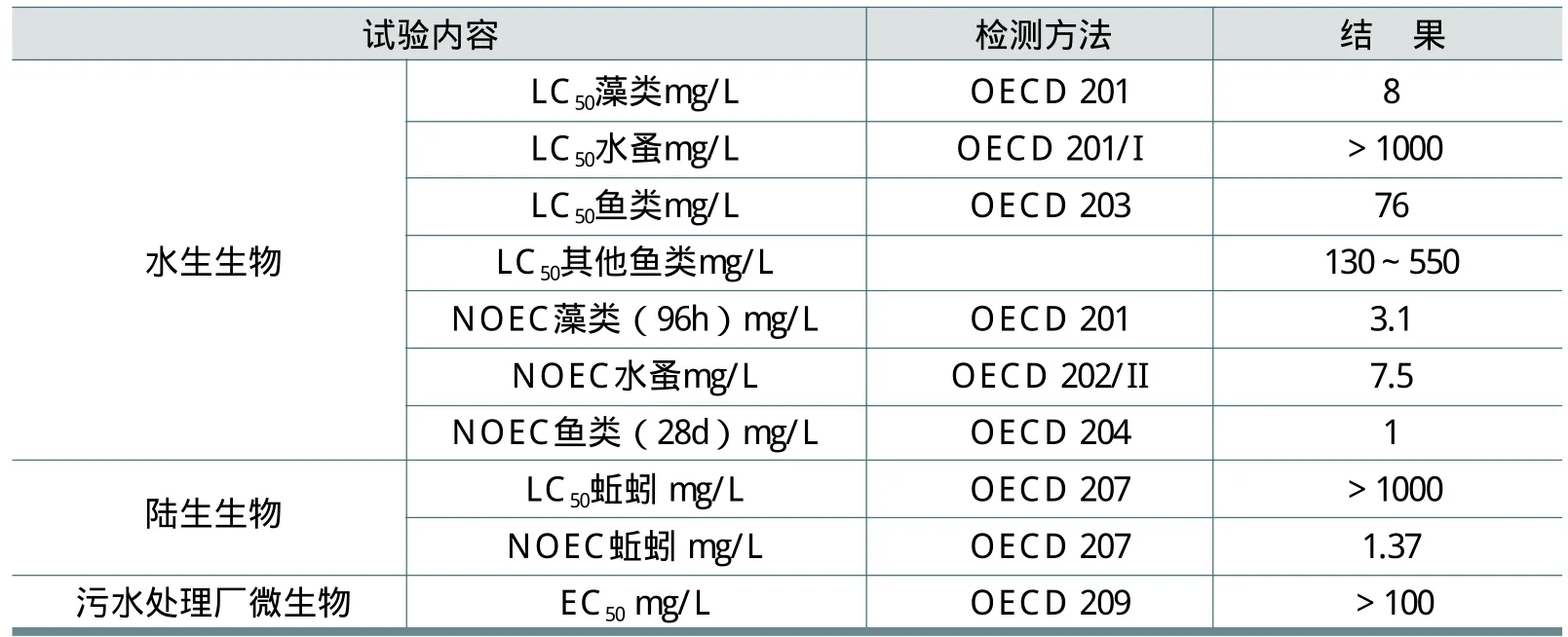
表20 水生生物、陆生生物和微生物的检测方法和结果
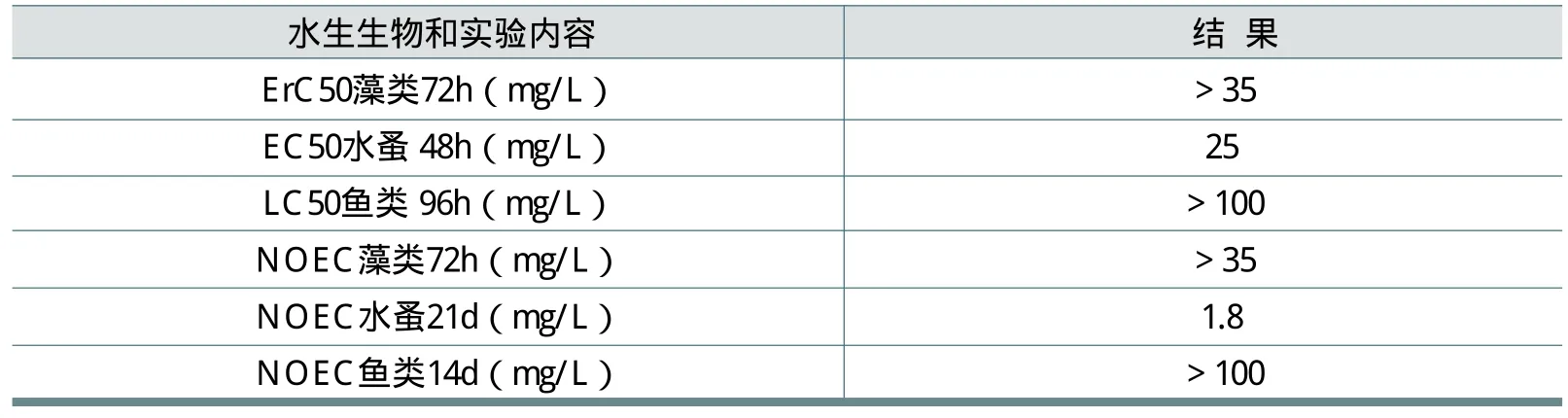
表21 日本水生生物的毒性结果
由于有广泛的数据支持,用EUSES1.0的默认值和HERA的洗涤剂特定方案与对瑞士和德国18条河流的监测数据进行比较,可以进行环境风险评估。根据EUSES默认方案和HERA洗涤剂特定方案得到的PEC(预测环境浓度)结果和监测数据的比较如表22所示。
根据毒性试验数据和TGD中的评估系数推导出来的预测无效应浓度(PNEC)见表23。
根据PEC和PNEC对两种方案数据与监测数据的风险表征,见表24。
对EUSES方案和HERA方案与监测的数据进行比较可以发现,HERA方案评估得到的结果比检测的结果更加保守,但是比EUSES方案更加接近监测值。
由各环境模块(水、污泥、沉积物、土壤)计算/测量得到的数据表明,预测的环境浓度与预测的无效应浓度的比值RCR远小于1。所以,据此可得出结论:FWA-5在洗涤剂中使用不会引起环境风险。荷兰国家环境保护署(Dutch RIVM)也证实了这一结论。
5.2 日本
关于FWA-5对环境的影响,比较实际测得的环境浓度与水生生物的预测无效应浓度(PNEC)后进行风险评估。经调查检测,公用水域FWA-5的最高浓度为6.4mg/L(见2.4.2)。对水生生物的慢性毒性影响中最小的无效应浓度为水蚤21天的生殖毒性的1.8mg/L(见表21),用评估系数50(按EU-TGD),预测无效应浓度(PNEC)为36mg/L。
结论:水环境中FWA-5的最高浓度为6.4mg/L,没达到预测无效应浓度(PNEC),在此调查范围内可以认为FWA-5对生态环境影响的风险很低。
6. 结论
针对人们关心的问题,毒理学家采用不同方法进行了认真、科学的试验,并根据实验或监测得到的数据,对FWA-5的安全性进行了评估,得出如下结论:
FWA-5对皮肤无刺激性和腐蚀性;不具有致突变性;无遗传毒性和致畸性;不具有生殖毒性;无发育毒性;体外雌激素、雄激素受体结合试验为阴性;无致敏性;无皮肤渗透性,而且经皮吸收性低;1%溶液未发现对眼的刺激和腐蚀;也不具有光毒性和致癌性;对农作物也有很高的安全性。
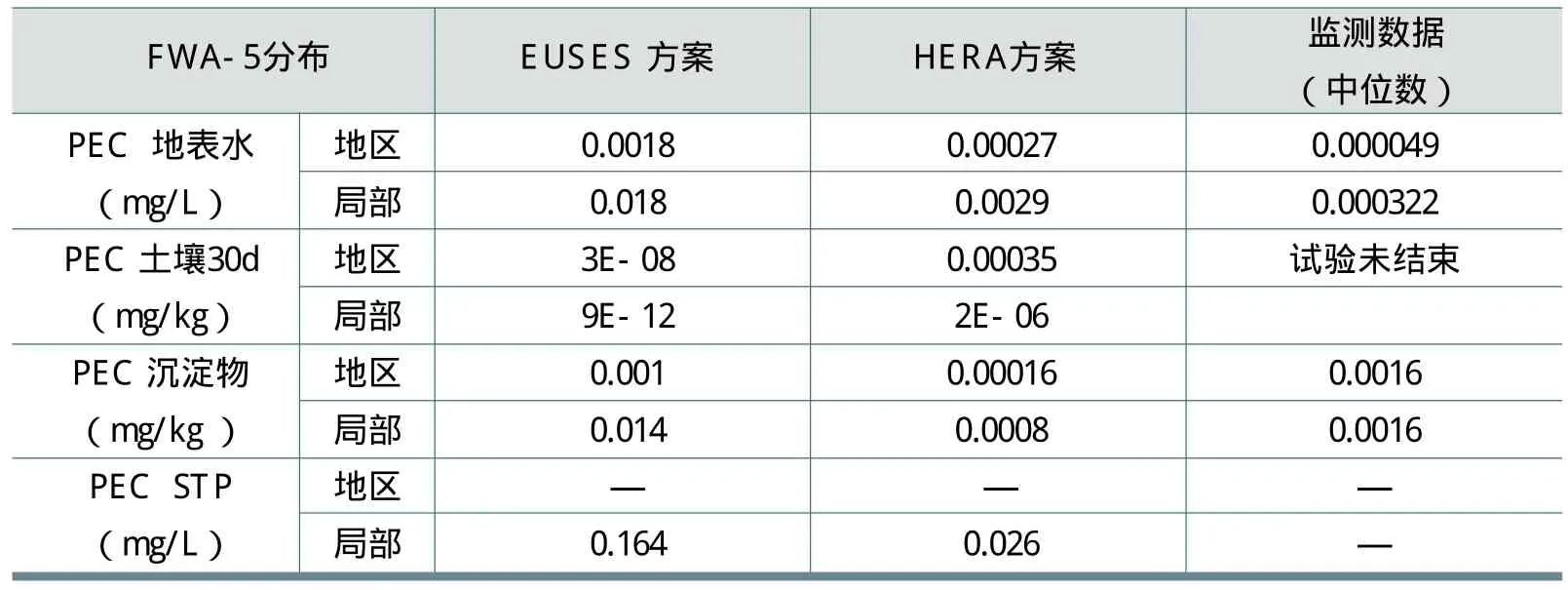
表22 两种方案局部和地区PEC值与监测数据的比较

表23 生物NOEC、评估系数和PNEC

表24 两种方案数据与监测数据的风险表征(RCR =PEC/ PNEC)
FWA-5几乎不蓄积在体内。另外,FWA-5拥有较强的水溶性和比较低的辛醇-水分配系数KOW。这也提示,FWA-5在生物体中蓄积性很小。
大鼠喂食大剂量FWA-5(50000ppm)后其胰腺发现了肿瘤,这是由于FWA-5的刺激终生施加在胰腺上造成的,与遗传毒性引起的肿瘤不同。这种肿瘤产生的阈值表明:在无毒性反应剂量以下的用量就不会产生肿瘤。
人体暴露于FWA-5的暴露限值(MOE)很大。这样大的MOE值足以覆盖所有不确定的毒理学(危险性)数据以及从动物实验向人类安全性外推的不确定性。因此,人类通过消费产品接触FWA-5是安全的。
环境中的FWA-5浓度很低,并且可以光解和生物降解。各环境模块预测的环境浓度与预测的无效应浓度的比值RCR远小于1。所以,FWA-5在洗涤剂中使用不会引起环境风险。荷兰国家环境保护署(Dutch RIVM)也证实了这一结论。
综上所述,目前全球洗涤剂行业公认最优秀、最具竞争力的荧光增白剂CBS不会对人类和环境造成危害,在产品中正常使用是安全的。
略。
