荣成俚岛和胶南斋堂岛斑头鱼渔业生物学特征的比较研究*
2012-01-10纪东平林龙山高天翔
纪东平,林龙山,高天翔**
(1.中国海洋大学海洋生物多样性与进化研究所,山东青岛266003;2.国家海洋局第三海洋研究所,福建厦门361005)
斑头鱼Hexagrammos agrammus隶属于鲉形目Scorpaeniformes、六线鱼科Hexagrammidae、六线鱼属Hexagrammos[1-7],分布于西北太平洋的朝鲜、日本以及中国东海、黄海和渤海,有明显聚集行为,是近海冷温性底栖鱼类[8-11]。斑头鱼常与大泷六线鱼混栖在岩礁周围或浅水海藻区域,以钓捕为主,为我国北方海域的经济鱼种之一[12]。
迄今,国外学者对其开展了较多研究,如斑头鱼的年龄与生长[11,13-14]、摄食生态[15]、早期个体发育[16]、近缘种间杂交[17-21]以及斑头鱼与大泷六线鱼的生态习性和摄食习性比较等[9-10,22-23]。但国内关于斑头鱼的研究很少,仅见斑头鱼的核型及性染色体研究[24-25]和基于线粒体DNA序列探讨斑头鱼分类地位的研究报道[5],有关其渔业资源生物学方面的研究资料缺乏。本研究对荣成俚岛和胶南斋堂岛斑头鱼繁殖群体进行了渔业生物学主要特征的比较研究,旨在阐明不同地理群体的生物学特征和差异,以期为其资源的合理利用与保护提供基础依据。
1 材料与方法
1.1 实验材料
于2010年10月通过地笼网和垂钓方式采集山东省荣成俚岛和胶南斋堂岛斑头鱼繁殖群体,并随机抽取可分辨雌雄的个体,2个群体均各为85尾样品。
1.2 样本处理与测定
斑头鱼样品带回实验室后,进行常规生物学测定。解剖后鉴别雌雄,肉眼观察性腺发育状况,性腺成熟度的划分方法参照鱼类Ⅵ期目测划分方法[26-27]。体长(L)精确到1.0 mm,体质量(去除内脏的质量,W)精确到0.1 g,性腺质量(GW)和肝脏质量(HW)精确到0.01 g。
斑头鱼的体长与体质量关系:

参数a、b分别为条件因子和异速生长因子。
性比(rsex)表示雌雄个体数的比值。性成熟系数(GSI)[28]、肥满度指数(K)[29]和肝脏指数(HSI)[30]公式如下:

选取性腺成熟度为Ⅳ~Ⅴ期的雌性个体(2个群体各20尾)进行繁殖力测定。将成熟卵粒全部挑出称重,测量1 g的卵数(e),然后计算其绝对繁殖力(F):

再计算个体相对体长繁殖力(F/L)和相对体质量繁殖力(F/W)[28]。
测定上述个体卵巢的卵径,每尾随机取50个成熟的卵粒,在JNOEC Microscope JSZ立式显微镜下用目测微尺测量,卵径精确到0.1 mm。
1.3 数据分析
采用SPSS17.0软件进行成对样本t检验、方差分析、Pearson相关分析和χ2检验等分析。
2 结果
2.1 体长和体质量组成
荣成俚岛群体平均体长为(130.6±26.7)mm,优势体长组为100~150 mm,占总样本数的82.4%;胶南斋堂岛群体平均体长为(130.3±17.0)mm,优势体长组为100~150 mm,占总样本数的89.4%。2个群体体长组成差异不显著(t=0.079,P>0.05)(见表1、图1)。

表1 荣成俚岛和胶南斋堂岛斑头鱼的样品信息Table 1 Sampling information of Hexagrammos agrammus in Lidao and Zhaitangdao

图1 荣成俚岛和胶南斋堂岛斑头鱼的体长分布和体质量分布Fig.1 Body length and body weight distribution of Hexagrammos agrammus in Lidao and Zhaitangdao
荣成俚岛群体平均体质量为(46.20±33.11)g,优势体质量组为20.0~50.0 g,占总样本数的69.4%;胶南斋堂岛群体平均体质量为(48.53±19.98)g,优势体质量组为30.0~70.0 g,占总样本数的85.9%。2个群体体质量组成差异不显著(t=-0.555,P>0.05)(见表1、图1)。

图2 荣成俚岛和胶南斋堂岛斑头鱼的体长-体质量关系Fig.2 Relationship between body length and body weight of Hexagrammos agrammus in Lidao and Zhaitangdao
2.2 体长与体质量关系
经幂函数拟合,得到2个群体的体长(L)-体质量(W)关系分别为(见图2):荣成俚岛群体:W=2.0×10-5L3.0257(R2=0.968 7);胶南斋堂岛群体:W=1.0×10-5L3.0805(R2=0.943 8)。
通过方差检验,2个斑头鱼群体的生长存在显著差异(P<0.05)。
2.3 性比(r sex)
χ2是度量实际样品雌雄性比与理论性比(1∶1)偏离程度的统计量,χ2越小,表明样品雌雄性比越接近1∶1;χ2越大,表示两者相差越大[31]。
荣成俚岛群体中,雌性个体67尾,雄性个体18尾,性比为3.72(χ2=28.247,P<0.01)(见表1);胶南斋堂岛群体中,雌性个体40尾,雄性个45尾,性比为0.89,雌雄个体比例接近1(χ2=0.294,P>0.05)。
2.4 个体繁殖力
2.4.1 绝对繁殖力(F)与体长和体质量的关系 荣成俚岛群体20尾样品(体长范围为110~164 mm,体质量范围为25.0~85.7 g)的绝对繁殖力为511~1 598粒,平均为(785±287)粒。绝对繁殖力与体长的关系式为lg F=2.216lg L-1.849(R2=0.609,P<0.05),与体质量的关系式为lg F=0.656lg W+1.791(R2=0.500,P<0.05),均呈正相关关系(见图3)。
胶南斋堂岛群体20尾样品(体长范围在117~170 mm,体质量范围在31.3~108.2 g)的绝对繁殖力为498~1408粒,平均为(912±263)粒。绝对繁殖力与体长的关系式为lg F=2.149lg L-1.690(R2=0.540,P<0.05),与体质量的关系式为lg F=0.763lg W+1.570(R2=0.637,P<0.05),均呈显著正相关关系(见图3)。
荣成俚岛和胶南斋堂岛群体的绝对繁殖力差异不显著(t=1.467,P>0.05)。

图3 荣成俚岛和胶南斋堂岛斑头鱼绝对繁殖力与体长、体质量的关系Fig.3 Relationship between absolute fecundity and body length/body weight of Hexagrammos agrammus in Lidao and Zhaitangdao
2.4.2 相对繁殖力与体长、体质量的关系 荣成俚岛群体的相对体长繁殖力(F/L)为4.0~9.7 eggs/mm,平均为(5.7±1.5)eggs/mm。与体长的关系式为lg(F/L)=1.216lg L-1.849(R2=0.319,P<0.05);与体质量的关系式为lg(F/L)=0.343lg W+1.760(R2=0.238,P<0.05),均呈正相关关系(见图4)。
胶南斋堂岛群体的相对体长繁殖力为3.7~9.1 eggs/mm,平均为(6.3±1.4)eggs/mm。与体长的关系式为lg(F/L)=1.149lg L-1.690(R2=0.251,P<0.05);与体质量的关系式为lg(F/L)=0.463lg W-0.046(R2=0.381,P<0.05),均呈正相关关系(见图4)。
2个群体的相对体长繁殖力差异也不显著(t=1.302,P>0.05)。

图4 荣成俚岛和胶南斋堂岛斑头鱼相对体长繁殖力(F/L)与体长、体质量的关系Fig.4 Relationship between F/L and body length/body weight of Hexagrammos agrammus in Lidao and Zhaitangdao
荣成俚岛群体的相对体质量繁殖力(F/W)为9.4~26.7 eggs/g,平均为(17.2±4.3)eggs/g,与体长和体质量均无显著的相关性,而基本稳定在一定的范围内(见图5)。
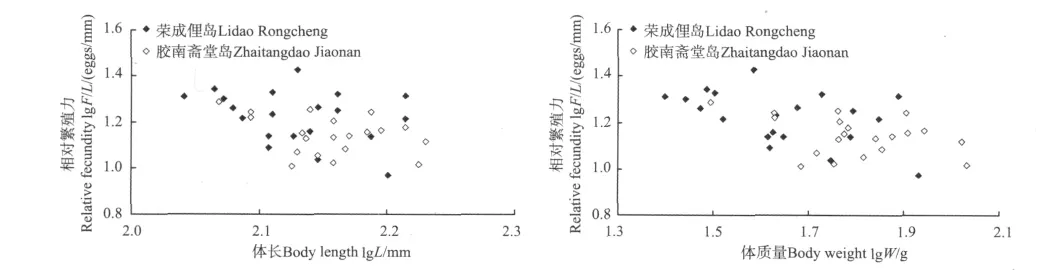
图5 荣成俚岛和胶南斋堂岛斑头鱼相对体质量繁殖力(F/W)与体长、体质量的关系Fig.5 Relationship between F/W and body length/body weight of Hexagrammos agrammus in Lidao and Zhaitangdao
胶南斋堂岛群体的相对体质量繁殖力(F/W)为10.3~19.4 eggs/g,平均为(14.2±2.7)eggs/g,与体长和体质量均无显著的相关性(见图5)。
2个群体的相对体质量繁殖力差异显著(t=-2.706,P<0.05)。
2.5 卵径
2个斑头鱼群体的Ⅳ~Ⅴ期卵巢卵径分析结果显示,荣成俚岛群体卵径范围为1.1~2.3 mm,平均值为(1.68±0.29)mm;胶南斋堂岛群体卵径范围为1.1~2.1 mm,平均值为(1.52±0.25)mm(见图6)。
2个群体的卵径差异极显著(t=4.304,P<0.01)。

图6 荣成俚岛和胶南斋堂岛斑头鱼的卵径分布Fig.6 Egg diameter distribution of Hexagrammos agrammus in Lidao and Zhaitangdao
2.6 性腺成熟度
荣成俚岛群体Ⅳ期成熟度的雌鱼占总数的43.3%,Ⅲ期占总数的22.4%,Ⅴ期占总数的17.9%,Ⅱ期占总数的16.4%,未发现Ⅰ期和Ⅵ期雌鱼。胶南斋堂岛群体雌鱼也以Ⅳ期为主,占总数的52.5%,Ⅲ期占总数的45.0%,Ⅴ期个体仅占总数的2.5%,未发现Ⅰ期、Ⅱ期和Ⅵ期雌鱼。
荣成俚岛群体Ⅳ期成熟度的雄鱼占总数的50.0%,Ⅱ、Ⅲ、Ⅴ期雄鱼各占总数的16.7%,未发现Ⅰ期和Ⅵ期雄鱼。胶南斋堂岛群体雄鱼以Ⅲ期为主,占总数的71.1%,Ⅳ期占总数的20.0%,Ⅱ、Ⅴ期雄鱼各占总数的4.4%,未发现Ⅰ期和Ⅵ期雄鱼。
2.7 性成熟系数(GSI)
2.7.1 性成熟系数与体长的关系 荣成俚岛群体雌鱼GSI分布范围为0.5~98.6,雄鱼GSI分布范围较雌鱼小,为0.5~24.2。性成熟系数与体长呈正相关关系(雌性:r=0.49,P<0.05;雄性:r=0.60,P<0.05)(见图7)。
胶南斋堂岛群体雌鱼GSI分布范围为6.9~99.3,雄鱼GSI分布范围较雌鱼小,为1.8~20.3。性成熟系数与体长呈正相关关系(雌性:r=0.50,P<0.05;雄性:r=0.05,P>0.05)(见图7)。
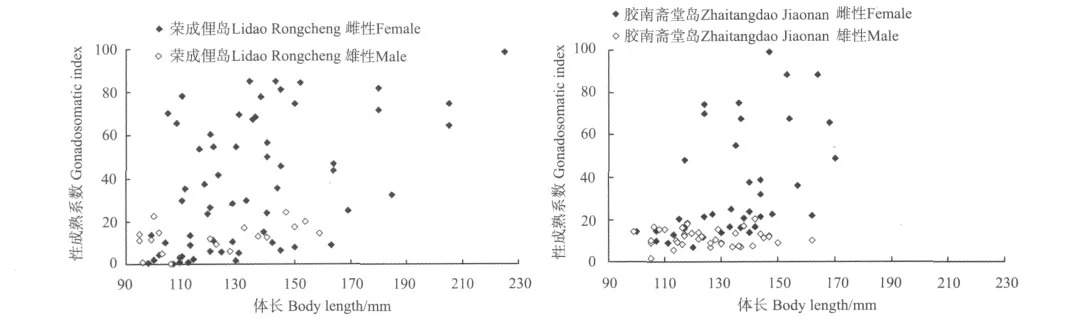
图7 荣成俚岛和胶南斋堂岛斑头鱼的性成熟系数与体长的关系Fig.7 Relationship between gonadosomatic index and body length of Hexagrammos agrammus in Lidao and Zhaitangdao
2.7.2 性成熟系数与性腺成熟度的关系 荣成俚岛群体Ⅱ~Ⅴ期雌性个体GSI的均值分别为3.0±2.6、13.9±9.0、54.8±26.3和87.8±23.8,雄性个体Ⅱ~Ⅴ期GSI的均值分别为6.2±9.3、6.9±2.2、14.0±3.4和20.6±3.4;胶南斋堂岛群体Ⅲ~Ⅴ期雌性个体GSI的均值分别为15.1±4.3、49.4±24.4和88.4±0,Ⅱ~Ⅴ期雄性个体GSI的均值分别为1.9±0.2、10.2±3.3、14.8±5.6和16.6±5.2。
2个群体雌、雄个体的性成熟系数均随性腺成熟度升高而增加(见图8)。

图8 荣成俚岛和胶南斋堂岛斑头鱼性成熟系数与性腺成熟度的关系Fig.8 Relationship between gonadosomatic index and maturity stages of gonad of Hexagrammos agrammus in Lidao and Zhaitangdao
2.8 肝脏指数(HSI)
单因素方差分析表明,不同性腺成熟度的雌鱼肝脏指数(HSI)存在显著差异(荣成俚岛群体:F=32.665,P<0.01;胶南斋堂岛群体:F=22.981,P<0.01)。
总体来看,雌鱼HSI高于雄鱼(荣成俚岛群体t=2.639,P>0.05;胶南斋堂岛群体t=1.277,P>0.05)。其中Ⅱ期个体的HSI最低,荣成俚岛群体雌、雄个体的HSI分别为0.62±0.14和0.50±0.04,胶南斋堂岛群体雄性个体的HSI为0.54±0.12;Ⅳ期个体HSI最高,荣成俚岛群体雌、雄个体的HSI分别为1.86±0.46和0.58±0.13,胶南斋堂岛群体雌、雄个体的HSI分别为1.89±0.56和0.74±0.16(见图9)。
2个群体雌、雄个体的HSI差异均不显著(雌性:t=-0.432,P>0.05;雄鱼:t=-1.724,P>0.05)。

图9 荣成俚岛和胶南斋堂岛斑头鱼的肝脏指数Fig.9 The hepatosomatic index of Hexagrammos agrammus in Lidao and Zhaitangdao
2.9 肥满度指数(K)
荣成俚岛群体的肥满度指数(K)为1.83±0.19,而胶南斋堂岛群体的K值为2.08±0.20。2个群体肥满度指数差异极显著(t=-8.285,P<0.01)。
3 讨论
(1)不同群体主要生物学特征的比较
荣成俚岛和胶南斋堂岛2个斑头鱼群体的体长组成和体质量组成差异不显著;对比胶南斋堂岛群体,荣成俚岛斑头鱼的生长速度慢、肥满度指数低,但个体繁殖力高、卵径大、性成熟较早。
Ricker[32]、詹秉义[33]认为,体长-体质量关系式中的幂指数b=3时,表明该鱼类为匀速生长,即个体3个线度长、宽、高方向的生长速度相等,具有体形不变和比重不变的特征;当b≠3时,表示异速生长,即3个线度方向的生长速度不等,其体形和比重要发生变化。本研究中2个斑头鱼群体的b值约等于3,说明2个斑头鱼群体为匀速生长。Kitagawa等[13]研究发现日本北海道南部海区斑头鱼在10月份体长-体质量关系式中的b值为3.127,与本研究得到的b值有较小差异。可能是由于样品采样地点、鱼类所处环境因子差异造成b值的不同,黄海与日本的斑头鱼群体间是否存在生长差异,还需要进一步的研究。
(2)繁殖和能量代谢分析
在种内,个体相对体质量繁殖力(F/W)与体质量和体长都没有显著的相关,而基本稳定在一定的范围内[34]。本研究中,2个斑头鱼群体的相对体质量繁殖力(F/W)与体长和体质量不相关。因此,相对体长繁殖力(F/L)适于推定两个斑头鱼群体的相对繁殖力。
繁殖期的斑头鱼雌雄个体间存在差异,当雄性个体生长到一定长度后,其生长速度减慢;而雌性个体为提高其繁殖力,继续保持较高的生长速率,体长远大于雄性个体。这种雌雄繁殖群体间的个体差异是鱼类重要的繁殖生物学特征之一[28],斑头鱼雌雄个体的性成熟系数差异也显示雌鱼在繁殖期间需要更多能量。
肝脏是鱼类营养物质储存、吸收及运输的器官,肝细胞可以合成卵黄前体物质卵黄蛋白原,为卵母细胞发育和成熟提供物质基础和能量来源[35]。产卵之前的Ⅳ期,雌性斑头鱼肝脏指数最高,能量最大;当卵巢发育到Ⅴ期并开始进行繁殖活动时,斑头鱼的摄食明显减少,其性腺发育的营养来源主要依靠肝脏的营养转化,肝脏指数开始下降。同样,雄性斑头鱼肝脏指数的变化趋势与雌鱼相似,表明精巢的发育也是由肝脏来提供能量的。在有些鱼类的研究中也有类似结论[30,36-38]。
肥满度指数是衡量鱼体丰满程度和水域饵料保障的季节变化指标,其周期性变化在一定程度上可反映该鱼的繁殖策略。目前已有学者利用该指数来确证鱼类的繁殖季节[39-40]。荣成俚岛群体较胶南斋堂岛群体性成熟较早,其肥满度指数已处于开始下降的趋势,明显低于胶南斋堂岛群体。因此,肥满度指数可以作为判定斑头鱼繁殖季节的重要依据。
(3)影响性成熟的因素
鱼类生长的好坏,与性成熟密切相关,影响鱼类性成熟的因素十分复杂,包括鱼类本身以及外界环境等多方面的因素[28,41]。根据对两地斑头鱼群体雌性个体Ⅳ期和Ⅴ期卵巢的出现时间、持续时间、以及性成熟系数的对比,并结合肥满度指数分析,推定荣成俚岛群体的繁殖期为9月底~12月,而胶南斋堂岛群体的繁殖期则从10月底开始。水温观测结果显示,10月荣成俚岛近海水温为15.8~19.6℃,胶南斋堂岛海域水温为18.0~21.2℃**2010.10.1~2010.10.31日平均水温,水文预报,青岛市海洋与渔业局:http://ocean.qingdao.gov.cn/n12479801/n12481748/index.html.。在鱼类繁殖过程中,温度对鱼类产卵至关重要,每种鱼在某一地区开始产卵的温度是一定的[27]。入秋后,黄海海域的水温由北向南依次开始下降,因此造成了荣成俚岛群体雌雄个体发育较快、性成熟较早。
对比国外学者的研究,日本北海道南部Moheji(41°50′N,140°40′E)群体的繁殖期为10~11月[13],Kotakehama(38°23′N,141°23′E)群体的繁殖盛期是10月底~11月初[22],Maizuru(35°30′N,135°22′E)群体的繁殖期在11~12月[42],Aburatsubo湾(35°10′N,139°30′E)斑头鱼是11月底~翌年1月(水温为13~17℃)进行繁殖[14]。由此可见,地理位置越北,斑头鱼产卵时间越早。由于六线鱼科鱼类的繁殖期较短,对繁殖期间水温变化又十分敏感,只有适宜的水温才开始进行繁殖[14,43]。因此,水温应该是造成不同地点的斑头鱼群体繁殖时间差异的重要因素。
致谢:感谢肖永双博士帮助采集胶南斋堂岛斑头鱼样品。
[1] Masuda H,Amaoka K,Araga C,et al.The Fishes of the Japanese Archipelago(Text)Second edition[M].Tokyo:Tokai University Press,1984:320.
[2] Shinohara G.Comparative morphology and the phylogeny of the suborder Hexagrammoidei and related taxa(Pisces:Scorpaeniformes)[J].Memoirs of the Faculty of Fisheries,1994,41(1):1-97.
[3] 中坊徹次.日本産魚類検索全種の同定,第二版[M].东京:東海大学出版社,2000:624-625.
[4] Mecklenburg C W,Eschmeyer W N.Family Hexagrammidae Gill 1889-greenlings.Annotated Checklists of Fishes[J].California Academy of Sciences,2003,3:1-11.
[5] 任桂静,刘奇,高天翔,等.基于线粒体DNA序列探讨斑头鱼分类地位[J].动物分类学报,2011,36(2):332-340.
[6] 孟庆闻,苏锦祥,缪学祖.鱼类分类学[M].北京:中国农业出版社,1995:583-584.
[7] 雷霁霖.海水鱼类养殖理论与技术[M].北京:中国农业出版社,2005:732-734.
[8] 成庆泰,郑葆珊.中国鱼类系统检索[M].北京:科学出版社,1987:463-487.
[9] Kanamoto Z.On the ecology of Hexagrammid fish III.Niches of Agrammus agrammus(Temminck et Schlegel)and Hexagrammos otakii Jordan et Starks and the mode of life of some reef fish[J].Japanese Journal of Ecology,1977,27:215-226.
[10] Kanamoto Z.On the ecology of Hexagrammid fish IV.Mode of the distribution of Agrammus agrammus(Temminck et Schlegel)and Hexagrammos otakii Jordan et Starks and composition,abundance and food items of reef fish around the several reefs[J].Japanese Journal of Ecology,1979,29:171-183.
[11] Kurita Y,Sano M,Shimizu M.Age and growth of the Hexagrammid fish Hexagrammos agrammus at Aburatsubo,Ja-pan[J].Nippon Suisan Gakkaishi,1991,57(7):1293-1299.
[12] 金鑫波.中国动物志硬骨鱼纲鲉形目[M].北京:科学出版社,2006:552-553.
[13] Kitagawa D,Ky^ushin K.Age and growth of spottybelly greenling,Hexagrammos agrammus(Temminck et Schlegel),in the shore reef at Moheji,Southern Hokkaido[J].Bulletin of the Faculty of Fisheries,1984,35(1):8-16.
[14] Kurita Y,Sano M,Shimizu M.Reproductive cycle and body size and age at maturity of the Hexagrammid fish Hexagrammos agrammus in central Japan[J].Fisheries Science,1995,61(1):1-6.
[15] Kwak S N,Baeck G W,Klumpp D W.Comparative feeding ecology of two sympatric greenling species,Hexagrammos otakii and Hexagrammos agrammus in eelgrass Zostera marina beds[J].Environmental Biology of Fishes,2005,74:129-140.
[16] Kohno H,Kurita Y,Seikai T.Ontogenetic intervals based on the development of swimming-and feeding-related characters in the Hexagrammid,Hexagrammos agrammus,larvae and juveniles[J].Mer,2000,38(2):77-86.
[17] Balanov A A,Antonenko D V.First finding of Hexagramos agrammus×H.octogrammus hybrids and new data about occurrence of H.agrammus(Hexagrammidae)in Peter the Great Bay(the Sea of Japan)[J].Journal of Ichthyology,1999,39(2):149-156.
[18] Munehara H,Kanamoto Z,Miura T.Spawning behavior and interspecific breeding in three Japanese greenlings(Hexagrammidae)[J].Ichthyological Research,2000,47(3):287-292.
[19] Brykov Vl A,Podlesnykh A V.Comparative study of mitochondrial DNA in two greenling species(Hexagrammidae:Pisces)and their hybrids from Peter the Great Bay(Sea of Japan)[J].Russian Journal of Genetics,2001,37(12):1400-1402.
[20] Kimura M R,Munehara H.The disruption of habitat isolation among three Hexagrammos species by artificial habitat alterations that create mosaic-habitat[J].Ecological Research,2010,25:41-50.
[21] Kimura M R,Munehara H.Spawning substrata are important for breeding habitat selection but do not determine premating reproductive isolation in three sympatric Hexagrammos species[J].Journal of Fish Biology,2011,78:112-126.
[22] Kanamoto Z.On the ecology of Hexagrammid fish I.Habitats and behaviors of Agrammus agrammus(Temminck et Schlegel)and Hexagrammos otakii(Jordan et starks)[J].Japanese Journal of Ecology,1976,26:1-12.
[23] Kanamoto Z.On the ecology of Hexagrammid fish V.Food items of Agrammus agrammus(Temminck et Schlegel)and Hexagrammos otakii Jordan et Starks sampled from different habitats around a small reef[J].Japanese Journal of Ecology,1979,29:265-271.
[24] 郑家声,王梅林,朱丽岩,等.斑头鱼Agrammus agrammus(Temminck et Schlegel)♂和铠平鲉Sebastes hubbsi(Matsubara)♀核型研究[J].青岛海洋大学学报,1997,27(3):333-337.
[25] 郑家声,王梅林,戴继勋.斑头鱼的核型及性染色体研究[J].遗传,1997,19(增刊):61-62.
[26] Pope K L,Kruse C G.Condition.Analysis and interpretation of freshwater fisheries data[M].∥Guy C S and Brown M L Eds.Maryland:American Fisheries Society,2007:423-471.
[27] 陈新军.渔业资源与渔场学[M].北京:海洋出版社,2004:60-371.
[28] 陈大刚.渔业资源生物学[M].北京:中国农业出版社,1997:57-73.
[29] Heincke F.Bericht ber die Untersuchungen der Biologischen Anstalt auf Helgoland zur Naturgeschichte der Nutzfische[M].Berlin:Die Beteiligung Deutschlands an der Internationalen Meeresforschung,1908:67-155.
[30] Htun-Han M.The reproductive biology of the dab Limanda limanda(L.)in the North Sea:gonosomatic index,hepatosomatic index and condition factor[J].Journal of Fish Biology,1978,13(3):369-378.
[31] 欧阳叙向.生物统计附试验设计[M].重庆:重庆大学出版社,2007:125-140.
[32] Ricker W E.Computation and interpretation of biological statistics of fish populations[J].Fisheries Research Board of Canada Bulletin,1975,191:290-293.
[33] 詹秉义.渔业资源评估[M].北京:中国农业出版社,1995:18-25.
[34] 徐恭昭.大亚湾环境与资源[M].合肥:安微科学技术出版社,1989:299.
[35] 张士璀,孙旭彤,李红岩.卵黄蛋白原研究及其进展[J].海洋科学,2002,26(7):32-35.
[36] Barbieri G,Hartz S M,Verani J R.The condition factor and hepatosomatic index as an indicators of the spawning of Astyanax fasciatus at Lobo Reservoir,S珘ao Paulo(Osteichthyes,Characidae)[J].Iheringia Serie Zoologia,1996,81:97-100.
[37] Tanda M,Nakamura Y,Okamoto S.Seasonal changes in gonadosomatic index,hepatosomatic index and condition factor of marbled sole Pleuronectes yokohamae in Harima-Nada to Osaka Bay,Seto Inland Sea,Japan[J].Aquaculture Science,2007,55(1):91-96.
[38] 张学健,程家骅,沈伟,等.黄鮟鱇繁殖生物学研究[J].中国水产科学,2011,18(2):290-298.
[39] Yeldan H,Avsar D.A preliminary study on the reproduction of the rabbitfish(Siganus rivulatus)in the Northeastern Mediterranean[J].Turkish Journal of Zoology,2000,24:173-182.
[40] Iqbal K M,Suzuki H.Length-weight relationships and condition factor of the Japanese silver-biddy,Gerres equulus,in the Yatsushiro Sea,western Kyushu,Japan[J].Journal of Applied Ichthyology,2009,25:219-222.
[41] 殷名称.鱼类生态学[M].北京:中国农业出版社,1993:110-121.
[42] Kitahara T,Irie T,Hayakawa K.On the catch efficiency of gillnet to Agrammus agrammus[J].Nippon Suisan Gakkaishi,1977,43(9):1035-1041.
[43] Munehara H,Shimazaki K.Annual maturation changes in the ovaries of masked greenling Hexagrammos octogrammus[J].Nippon Suisan Gakkaishi,1989,55(3):423-429.
