太湖水体多环芳烃生态风险的空间分布
2012-01-07郭广慧吴丰昌何宏平张瑞卿李会仙中国科学院广州地球化学研究所广东广州50640中国科学院研究生院北京00049中国环境科学研究院环境基准与风险评估国家重点实验室北京0002
郭广慧,吴丰昌,何宏平,张瑞卿,李会仙(.中国科学院广州地球化学研究所,广东 广州 50640;2.中国科学院研究生院,北京 00049;.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 0002)
多环芳烃(PAHs)是分子中含有2个或2个以上苯环的碳氢化合物及其衍生物,是环境中广泛存在的一类持久性有机污染物和半挥发性有机化合物.目前,PAHs对生物体的危害可发生在分子水平到整个生态系统水平[1-5].生态风险评价是定量研究污染物生态危害的有效手段[6].目前,物种敏感性分布(SSD)曲线已广泛应用于污染物的生态风险评价[7-11].由于城市化和工业化的迅速发展,太湖水体 PAHs的含量水平及其引起的生态危害逐渐得到广泛关注,但对太湖水体PAHs生态风险的空间分布尚未报道.因此,本研究基于太湖梅梁湾、贡湖湾和胥口湾水体PAHs的浓度水平,利用SSD曲线法对7种单体PAHs和∑PAH7的生态风险进行评价,并对PAHs生态风险的空间分布进行探讨,以期为太湖水体PAHs的生态风险控制和管理提供科学依据.
1 研究方法
1.1 研究区域
太湖是我国的第 3大淡水湖泊,位于长江三角洲南部(N30°55′40″~31°32′58″, E119°53′32″~120°36′10″),湖面面积约2338.1km2,平均深度2m,是典型的碟型浅水湖泊.全湖水系以太湖为中心,北部以无锡的直湖港为界,南部以原吴江市的吴娄港为界,向西河流以入湖为主,向东河流以出湖为主.太湖南岸为典型的圆弧形岸线,东北部曲折多湾,主要有北部的竺山湖、梅梁湾和贡湖及东部的胥口湖和东太湖[12].
1.2 数据获取
1.2.1 暴露浓度的获取 通过对研究区域的实地考察,2009年9月在太湖梅梁湾、贡湖湾和胥口湾共采集33个具有代表性的表层(0~20cm)水样,其中梅梁湾10个,贡湖11个,胥口12个(图1).使用有机玻璃采水器采集水样,每个样点采集 3个平行样,共采集2~3L水样,装入棕色玻璃瓶中,按 1mL:1L(甲醛:水)的比例加入 5‰的甲醛溶液抑制微生物活性,水样冷藏运输到实验室,并放入冰箱冷藏保存,分批处理.
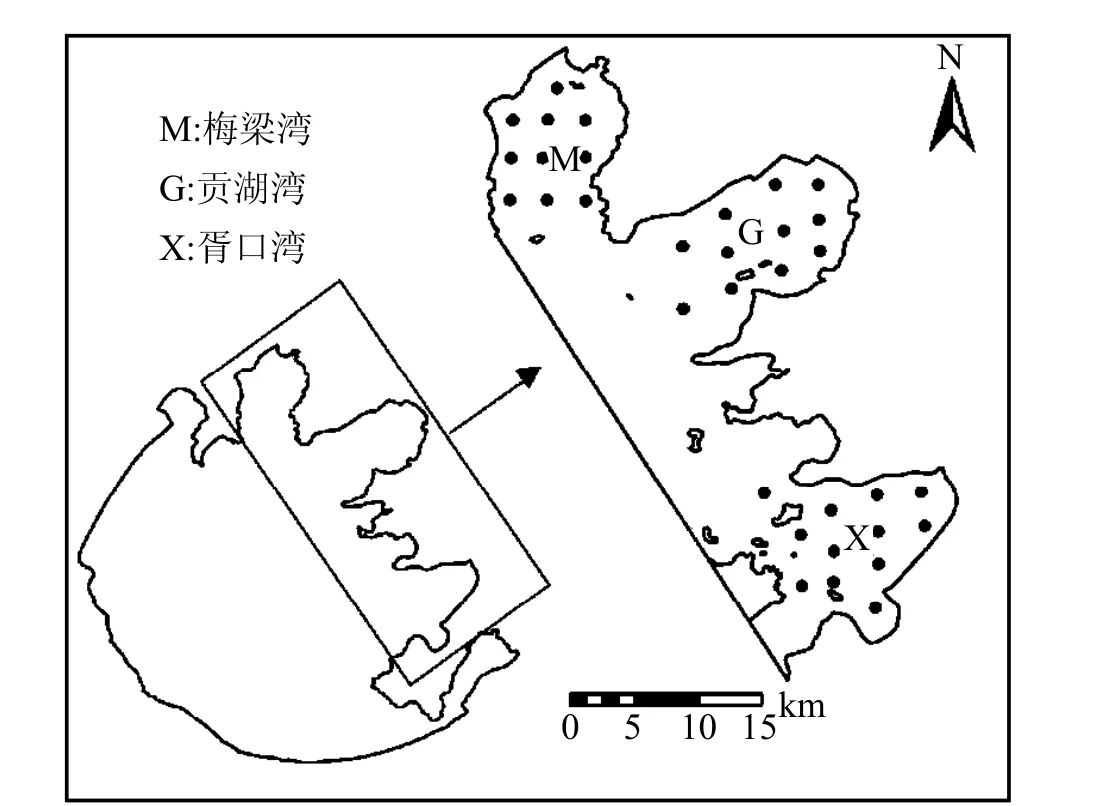
图1 太湖梅梁湾、贡湖湾和胥口湾采样点位示意Fig.1 Sampling sites in Meiliang Bay, Gonghu Bay, and Xukou Bay from Taihu Lake
将2L水样通过0.45μm滤膜后过固相萃取小柱,用二氯甲烷洗脱吸附在小柱上的 PAHs,最后用氮气浓缩到0.5mL.用2.0g硅胶和1.0g无水硫酸钠层析柱净化,以正己烷洗脱后,再以正己烷和二氯甲烷淋洗(体积比 1:1),收集洗脱液,进行高效液相色谱仪(HPLC)和荧光检测器分析.以甲醇/水作为流动相(流速1~1.5ml/min),采用梯度淋洗方法分离PAHs,甲醇体积百分含量从75%渐变到100%,控制温度为(20±2)℃.质量控制包括空白,基质空白、基质加标回收率.PAHs标准曲线决定系数在0.99以上,空白样无PAHs检出,回收率范围为60%~94%.根据毒性数据的可获取性选择 7种代表性化合物进行分析,其含量水平统计值见表1.
1.2.2 毒性数据的获取 为正确评价太湖梅梁湾、贡湖湾和胥口湾的生态风险,选择物种应该考虑以下原则:所选物种需要反映该区域生物区系特征;充分考虑物种的多样性,所选物种尽量包含太湖水生生态系统中各个营养级的代表性物种,这些物种能够代表生态系统生物群落特征.所选物种包括绿藻(Selenastrum capricornutum),小球藻(Chlorella fusca),大型蚤(Daphnia magna),鲤鱼(Cyprinus carpio),黑头呆鱼(Pimephales promelas),罗非鱼(Tialpia zillii)、斑马鱼(Danil rerio),钩虾(Gammarus minus),摇蚊(Chironomus riparius),埃及伊蚊(Aedes aegypti)等物种.PAHs对水生生物的毒性数据从美国环保署毒性数据库(http://www.epa.gov/ecotox/)获取,根据以下原则对获取的数据进行筛选:评价终点选择反映种群、群落或生态系统效应水平的存活率、生长、死亡率或繁殖率等终点的毒性数据;对于持久性有机化合物,一般选择慢性毒性数据(无观察效应浓度, NOEC),如果没有可用的慢性毒性数据,可选择急性毒性数据(半致死浓度LC50或半效应浓度EC50),除以急/慢性数据比率(ACR)得到7种单体PAHs对水生生物的NOEC(表2),采用ECA(European Chemicals Act)中使用的急/慢性比,即ACR=100[13-14];对于藻类,选择暴露时间为 4~7d的毒性数据;对于鱼类、甲壳类、软体动物和两栖类等水生生物,选择暴露时间 96h的 LC50或 EC50;如果一个物种具有不同生命阶段的毒性数据,选择最敏感生命阶段的毒性数据,基于以上筛选原则最终获得 Ace、Flu、Phe、Ant、Flua、Pyr和BaP的毒性数据(表2).SSD曲线的构建参照以下原则:对大于该化合物溶解度的毒性数据,计算其在效应分布中的秩,但不参与 SSD的拟合;如果一个物种有多个毒性数据,计算几何均值;至少需要 4个有效毒性数据来构建SSD曲线.
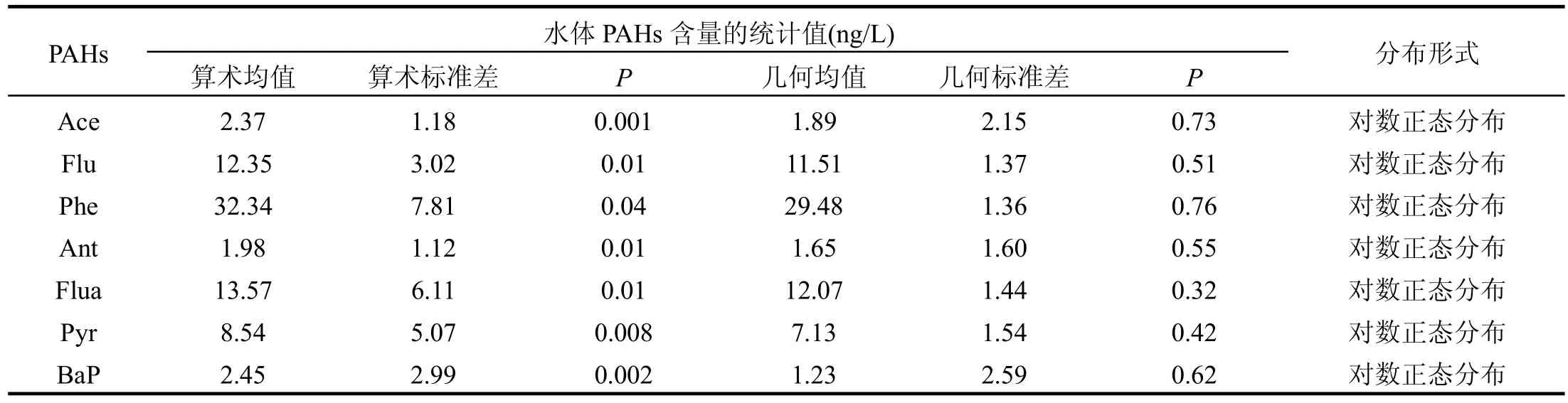
表1 太湖三湖湾水体7种PAHs含量的统计值Table 1 Statistics of seven individual PAHs in surface water of Taihu Lake

表2 7种多环芳烃对水生生物的无观察效应浓度统计量Table2 Statistics of no effect concentrations of seven individual PAHs to aquatic organisms
1.3 生态风险评价方法
通过构建SSD曲线计算太湖水体PAHs对水生生物的危害比例(PAF),表征 PAHs对水生生态系统的生态风险.SSD曲线拟合采用荷兰国立公共卫生与环境研究院开发的 ETX2.0软件,该软件中SSD曲线基于Log-normal分布[15].单体PAHs对水生生物的PAF为给定暴露浓度在SSD曲线上对应的累积概率(图2),计算公式为式(1):

式中:μ为每种化合物对数转化后毒性数据的平均值,μg/L;σi为每种化合物对数转后毒性数据的标准差,μg/L;x为水体单体 PAHs暴露浓度经对数转后的值,ng/L.
Σ7PAH对水生生物的PAF可基于浓度加和方式按照式(2)~式(4)[15]进行计算.
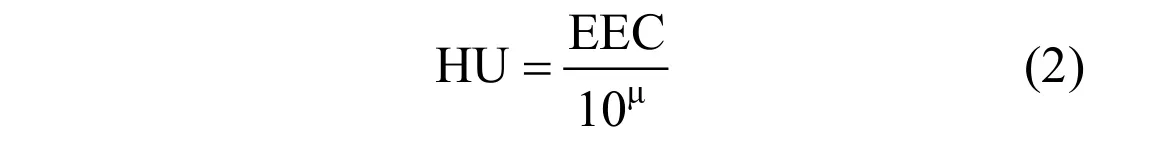
式中:HU为每种单体化合物的毒性单位,无量纲;EEC为每种化合物环境暴露浓度, ng/L.

式中:σ为不同化合物经对数转化后毒性数据标准差的均值,ng/L.
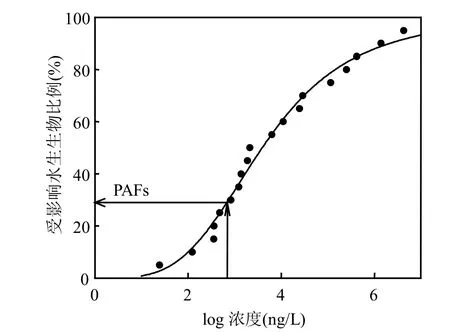
图2 应用SSD曲线法计算PAHs对水生生物PAFFig.2 PAF to aquatic organisms from PAHs calculated using SSD curve
2 结果与讨论
2.1 SSD曲线的构建
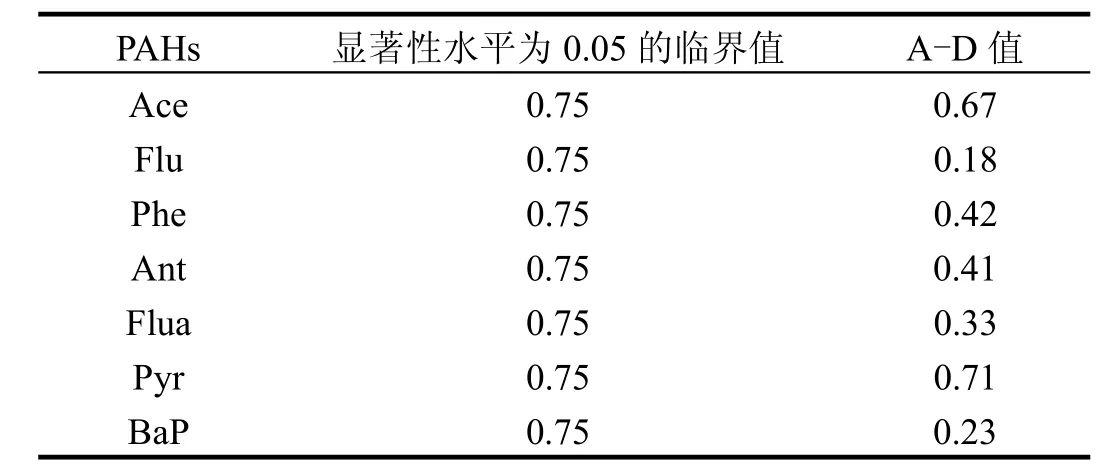
表3 7种单体PAHs物种敏感度曲线的拟合检验Table 3 Goodness-of-fit tests for species sensitivity distributions constructed for seven individual PAHs
7种PAHs的SSD曲线见图3,其拟合优度检验参数见表3.由表3可知,7种PAHs的SSD曲线Adderson-Darling统计值(A-D值)均小于显著性水平为 0.05对应的临界值,说明 Log-normal分配模型很好地拟合了7种PAHsSSD曲线.
2.2 单体PAHs的生态风险
7种PAHs单体对水生生物的PAFs的统计值及PAFs的分布形式见表4.对原始数据符合正态分布的数据组,采用算术平均值代表 PAHs对水生生物的 PAF,对于符合对数正态分布的数据组,采用几何平均值代表 PAHs对水生生物的PAF.从表4可知,Ace对水生生物的PAF最小,平均值为 0,因而未对其进行进一步方差分析和空间分布研究.其他6种PAHs单体在三湖湾中均呈对数正态分布,Flu的PAF变化范围为0.0001%~0.0030%,几何均值为 0.0005%,略高于 Ace的生态风险;Flua对三湖湾水生生物的生态风险最大,PAF变化范围为0.5309%~5.0367%,平均值为1.1641%;Phe和Pyr对水生生物的生态风险仅次于 Flua,PAF范围分别为 0.0920%~0.5886%和0.0262%~3.4145%,几何均值分别为 0.2206%和0.1633%,对水生生物的生态风险较大;BaP和Ant的 PAF范围分别为 0~1.1985%和 0~0.6154%,几何均值分别为 0.0175%和 0.0021%,对水生生物的生态风险较小.7种单体PAHs对太湖水生生物的生态 风险依 次是 Flua>Phe>Pyr>BaP>Ant>Flu>Ace.这与乔敏等[17]对梅梁湾沉积物中 PAHs生态风险的排序并不一致,这主要因为沉积物和水体中 PAHs组成成分和暴露浓度不同.由于污染来源和污染水平的不同,水体 PAHs生态风险也会有差异,如天津市地表水水体中 7种 PAHs的 生 态 风 险 依 次 为Ant>Pyr>Flu>Phe>Nap>Flua> BaP[18].另外,研究结果显示 Ant对水生生物毒性较大,但其生态风险较低;相反,Phe对水生生物的毒性较小,但其生态风险较高.因此,PAHs的生态风险由暴露浓度和毒性数据共同决定,可使用蒙特卡罗敏感性分析技术进一步分析二者对生态风险的贡献率[19].
除Ace外,其他6种PAHs对三湖湾水生生物的PAFs值有所差异,Ant和BaP对梅梁湾水生生物的PAF分别为0.0209%和0.1237%,贡湖湾的PAF分别为0.0023%和0.0085%,胥口湾的PAF分别为0.0002%和 0.0015%,方差检验表明这两种单体PAHs对梅梁湾水生生物的 PAF显著高于贡湖湾和胥口湾(P<0.05),而贡湖湾和胥口湾的PAF无显著性差异(P>0.05);Flu和Phe在梅梁湾的PAF分别为 0.0011%和 0.2999%,在贡湖湾的 PAF分别为0.0008%和0.2621%,在胥口湾的PAF为0.0003%和0.1495%,方差检验表明这2种单体PAHs在胥口湾的PAF显著低于梅梁湾和贡湖湾(P<0.05),而梅梁湾和贡湖湾的PAF无显著性差异(P>0.05);Flua和Pyr在梅梁湾的PAF分别为1.7156%和0.3268%,在贡湖湾的PAF分别为1.2192%和0.1697%,在胥口湾的PAF分别为0.8339%和0.0816%,方差检验表明Pyr和Flua在3个湖区的PAF具有显著性差异(P<0.05).除梅梁湾一个采样点Flua的PAF超过5%的阈值外(PAF=5.0367%),其他PAHs的PAF值均低于5%的阈值,说明单体PAHs在太湖水体中的生态风险较低.

图3 水生生物对7种PAHs的物种敏感性曲线Fig.3 Species sensitivity distribution curves for aquatic organisms to seven individual PAHs
空间内插使用反距离加权插值法完成,这种方法可以通过离散点上的数据特征得到连续的特征要素的空间数据集,可阐明单体PAHs在太湖梅梁湾、贡湖湾和胥口湾的风险分布特征(图4).从图4可看出,6种单体PAHs在三湖湾的分布特征相似,PAHs对梅梁湾水生生物的 PAF最大,其次是贡湖湾,胥口湾的生态风险最小.6种 PAHs对水生生物的 PAF最高值出现在梅梁湾西北部,主要是因为该高值区临近太湖湖边的码头,船舶燃油尾气的排放成为 PAHs的主要来源[20].贡湖北部单体PAHs对水生生物的 PAF较高,这可能与贡湖北部大、小溪港的入湖口有关,大、小溪港水域长期接纳来自新安和华庄的工业和生活污水,京杭运河的污染水体也时有倒灌进入大溪港,增加了贡湖北部水体 PAHs的暴露风险.胥口湾 PAHs对水生生物的潜在危害比例相对较小,这可能与东部沿湖地区工业污染源较少,多为出湖河道,湖区外源性污染小,同时水体自净能力强有关.
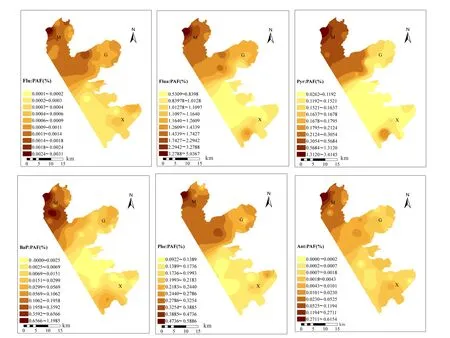
图4 太湖梅梁湾、贡湖湾和胥口湾中6种单体PAHs对水生生物PAF的空间分布Fig.4 Spatial distributions of potentially affected fractions of six individual PAHs in surface water of Meiliang Bay,Gonghu Bay, and Xukou Bay of Taihu Lake
2.3 ∑7PAH的联合生态风险

图5 太湖梅梁湾、贡湖湾和胥口湾中∑7PAH对水生生物PAF的空间分布Fig.5 Spatial distributions of potentially affected fractions of ∑7PAH in surface water of Meiliang Bay, Gonghu Bay,and Xukou Bay of Taihu Lake
尽管单体PAHs对太湖三湖湾水生生物的生态风险较低(表 5),但∑7PAH 对水体的联合生态风险均高于单体PAHs的生态风险(表5).从表5可知,三湖湾∑7PAH的PAF的范围为1.7552%~8.4155%,平均值为3.0954%,低于5%的阈值,说明∑7PAH对太湖水体的生态风险较低,其中Flua(PAF=1.2845%)对∑7PAH 的生态风险的贡献最大,其次是 Pyr(PAF=0.2858%)和 Phe(PAF=0.2387%).不同湖湾∑7PAH对水生生物的联合生态风险有所差异,∑7PAH对梅梁湾、贡湖湾和胥口湾的水生生物的 PAF范围分别为 2.9239%~8.4155% 、 2.5722%~ 3.7458% 和1.7552%~2.9637%,平均值分别为 4.1018%、3.0414%和2.3899%,其中9.909%的样点PAF超过5%的阈值,且均出现在梅梁湾.方差分析表明梅梁湾水体∑7PAH的 PAF显著高于贡湖湾和胥口湾PAF(P<0.05),贡湖湾和胥口湾水体∑7PAH 的PAF没有显著性差异(P>0.05).
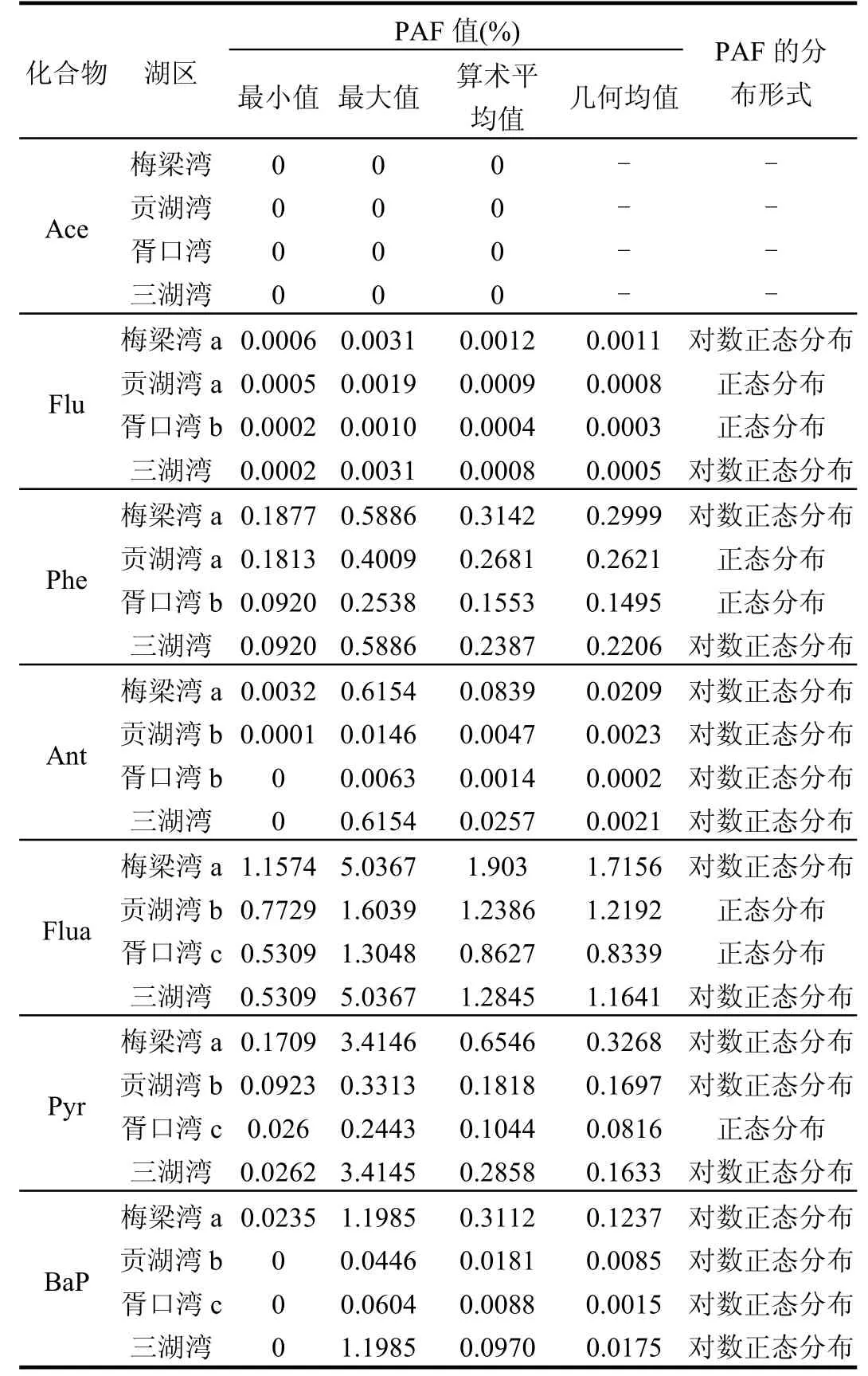
表4 太湖水体7种PAHs对水生生物的潜在危害比例Table 4 Potentially affected fractions of seven PAHs in surface water of Taihu Lake

表5 太湖水体∑7PAH对水生生物的潜在危害比例Table 5 Potentially affected fractions of ∑7PAH in surface water of Taihu Lake
从图5可看出,∑7PAH对水生生物的联合生态风险分布特征与单体PAHs的分布特征(图4)相似,梅梁湾西北部∑7PAH对水生生物的风险最高,其次是贡湖湾北部,胥口湾风险最低.
2.4 不确定性分析
生态风险评价的不确定性主要来源于暴露分析、效应分析和风险表征过程[21].尽管本研究中水体 PAHs来自具有代表性的样点,但仅以PAHs在水相中的全量为其暴露浓度,尚未考虑影响其生物有效性的因素,如水体溶解性有机质以及水体PAHs含量在时间上的变化,这些都会造成暴露浓度的不确定性.此外,水体PAHs的测量误差也会造成暴露分析的不确定性.为保护水生生物免受PAHs长期不利影响,本研究的效应浓度采用急慢性比率将急性毒性数据转化为慢性毒性数据,同时由实验室产生的毒性数据外推到实际生态系统,都将在一定程度上造成生态风险评价的不确定性.不过本研究使用概率风险评价在很大程度上降低了风险评价的不确定性.此外,生态风险评价自身的缺陷也给评价结果带来一定的不确定性,如不同生物区系的生物组成和结构不同[22-23],并且物种在生态系统中的重要性有所差别.因此,本研究只反映现有数据条件下的结果,更加符合实际环境的暴露浓度和毒性数据需要进一步考虑生物在生态系统中的结构和功能,如生态冗余、生态恢复力和生态抗性等[24].
3 结论
3.1 太湖 3湖湾水体 Flua,Phe,Pyr,BaP,Ant,Flu和Ace对水生生物的危害比例分别为1.1641%,0.2206%,0.1633%,0.0175%,0.0021%,0.0005%和0.0000%.∑7PAH对三湖湾水生生物的联合生态风险为3.0954%,高于单体PAHs的生态风险.
3.2 除Ace外,其他单体PAHs和∑7PAH在太湖3个湖湾生态风险的空间分布特征类似,梅梁湾西北部 PAHs的生态风险最大,其次是贡湖湾北部,胥口湾的生态风险最小.
[1]Reynaud S, Deschaux P. The effects of polycyclic aromatic hydrocarbons on the immune system of fish: A review [J].Aquatic Toxicology, 2006,77(2):229-238.
[2]Neff J M. Polycyclic aromatic hydrocarbons in the aquatic environment: sources, fate and biological effects [M]. England:Applied science publishers Ltd, Essex, 1979:156-158.
[3]Neff J M. Polycyclic aromatic hydrocarbons in the aquatic environment and cancer risk to aquatic organisms and man. in Richard N L. and Jackson B L Symposium: Carcinogenic polynuclear Aromatic Hydrocarbons in the Marine Environment[M]. Pensacola Beach, Florida, U S. Environmental Protection Agency, Gulf Breeze, Florida, 1982:385-409.
[4]Kukkonen J and Landrum P F. Toxicokinetics and toxicity of sediment-associated pyrene to Lumbriculus variegatus (Oligochaeta)[J]. Environment Toxicology and Chemistry, 1994,13(9):1457-1468.
[5]Landrum P F, Dupuis W S, Kukkonen J. Toxicokinetics and toxicity of sediment-associated pyrene and phenanthrene in Diporeia spp: Examination of equilibrium-partitioning theory and residue-bases effects for assessing hazard [J]. Environmental Toxicology and Chemistry, 1994,13(11):1796-1780.
[6]Suter G W, Efroymson R A, Sample B E, et al. Ecological Risk Assessment for Contaminated Sites [M]. England: Lewis Publishers. 2000:26-29.
[7]刘 良,颜小品,王 印,等.应用物种敏感性分布评估多环芳烃对淡水生物的生态风险 [J]. 生态毒理学报, 2009,4(5):647-654.
[8]孔祥臻,何 伟,秦 宁,等.重金属对淡水生物生态风险的物种敏感性分布评估 [J]. 中国环境科学, 2011,31(9):1555-1562.
[9]Schuler L J, Rand G M. Aquatic risk assessment of Herbicides in freshwater ecosystems of South Florida [J]. Archives of Environmental Contamination and Toxicology, 2008,54(4):571-583.
[10]Rand G M, Carriger J F, Gardinali P R, et al. Endosulfan and its metabolite, endosulfan sulfate, in freshwater ecosystem of south Florida: a probabilistic aquatic ecological risk assessment [J].Ecotoxicology, 2010,19(5):879-900.
[11]邢立群,郑新梅,刘红玲,等.中国主要河流中硝基苯生态风险研究 [J]. 中国环境科学, 2011,31(2):301-306.
[12]金相灿.中国湖泊环境(第二册) [M]. 北京:海洋出版社, 1995:86-88.
[13]Länge R, Hutchinson T H, Scholz N, et al. Analysis of the ecetoc aquatic toxicity database II-comparison of acute to chronic ratios for various acute to chronic ratios for various aquatic organisms and chemical substances [J]. Chemosphere, 1998,36(1):115-127.
[14]Heger W, Jung S J, Martin S, et al. Acute and prolonged toxicity to aquatic organisms of new and existing chemicals and pesticides[J]. Chemosphere, 1995,31(1):2702-2726.
[15]van Vlaardingen P L A, Traas T P, Wintersen A M, et al. A program to calculate hazardous concentrations and fraction affected, based on normally distributed toxicity data [R]. RIVM report 601501028/2004, 2004.
[16]Traas T P, van de Meet D, Posthuma L, et al. The potentially affected fraction as measure of ecological risk[M]// Posthuma L,Traas T P, Suter II G W, et al. Species Sensitivity Distributions in Ecotoxicology. Boca Raton FL UAS, 2002:322-326.
[17]乔 敏,黄圣彪,朱永官,等.太湖梅梁湾沉积物中多环芳烃的生态和健康风险 [J]. 生态毒理学, 2007,2(4):456-463.
[18]Yang Y, Shi X, Wong P K, et al. An approach to assess ecological risk for polycyclic aromatic hydrocarbons in surface water from Tianjin [J]. Journal of Environmental Science and Health Part A:Toxic Hazardous Substances Environmental Engineering, 2006,41(8):1463-1482.
[19]USEPA 1996. Summary Report for the workshop on Monte Carlo analysis. Risk assessment forum EPA-630-R-96-010 [R].USEPA Washington DC.
[20]Qiao M, Wang C X, Huang S B, et al. Composition, sources, and potential toxicological significance of PAHs in the surface sediments of the Meiliang Bay, Taihu Lake, China [J].Environment International, 2006,32(1):28-33.
[21]Poletika N N, Woodburn K B, Henry K S. An ecological risk assessment for chlorpyrifos in an agriculturally dominated tributary of the San Joaquin River [J]. Risk Analysis, 2002,22(2):291-308.
[22]吴丰昌,孟 伟,宋永会,等.中国湖泊水环境基准的研究进展[J]. 环境科学学报, 2008,28(12):2385-2393.
[23]苏海磊,吴丰昌,李会仙,等.太湖生物区系研究及与北美五大湖的比较 [J]. 环境科学研究, 2011,24(12):1345-1354.
[24]Solomon K P, Baker D B, Richards R P, et al. Ecological risk assessment of Atrazine in north American surface waters [J].Environmental Toxicology and Chemistry, 1996,15(1):31-76.
