联合偶合概率与似然比率在炭化骨骼个人识别中的计算及分析*
2012-01-06徐国昌刘海东
徐国昌,齐 静,任 甫,刘海东
(1.南阳理工学院生物人类学研究所,河南南阳 473004;2.辽宁医学院人类学研究所,辽宁锦州 121000;3.山东省潍坊市公安局 261041)
在火灾、焚尸、交通、空难、爆炸等案件和事故中常需要对炭化骨骼进行个人识别[1-2]。人体软组织被烧焦或者缺失时,留下的骨骼残骸就显得尤为重要[2-3]。国内外研究者近年来对骨骼法医学价值进行探讨并取得了一定成绩,但如何利用分子生物学技术对残存位点进行计算与分析,仍是困扰该类研究的首要问题[4-8]。为了探讨联合偶合概率(random match probability,RMP)与似然比率(likelihood ratio,LR)在炭化骨骼个人识别中的计算及分析,本研究采用改进的酚-氯仿法提取DNA,应用荧光标记复合扩增系统扩增15个STR和1个性别基因位点并经遗传分析仪进行电泳检测,获得基因位点的基本资料,了解基因位点焚烧后的存留情况,利用存留基因位点图谱比对,进行个人识别力(discrimination power,DP)和累积识别力(total discrimination power,TDP)、RMP、LR的计算,为炭化骨骼个人识别提供有效的检测方法和判定依据。
1 材料与方法
1.1样本采集与处理 新鲜成人尸体,男、女各1具,分别取出一侧股骨,清除骨骼表面组织,紫外光照射2 h,锯取股骨干3块,随机取1块做对照,余2块分别置于马弗炉中,常大气压下以300 ℃焚烧1 h,标记备用。
1.2主要试剂(盒)、仪器设备和软件 主要试剂(盒):相对分子质量内标、二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)、三羟甲基氨基甲烷(Tris)、饱和酚、正丁醇、异戊醇、液氮;AmpFlSTR ID Kit、PCR reagents、QIAquick®PCR Purification Kit、DNA tapy TM15 Kit、Amp FLSTR Identifiler Kit。主要仪器设备:SX型马弗炉、生物冷冻研磨器、GeneAmp PCR System9700、3100xl Genetic Analyzer、高速冷冻离心机。主要软件:Data Colletion(Version 2.0)软件、Gene Mapper(Version 3.2)软件、SPSS13.0统计分析软件。
1.3样本基因组DNA提取与检测
1.3.1提取 每一样本机械粉碎后,液氮下磁性振荡研磨20 min。分析天平称取每份样本2.00 g置于EP管,EDTA脱钙。加入裂解液,50 ℃水浴16~24 h。冷冻离心后取上液加入饱和酚、三氯甲烷、异戊醇混液,离心,取上层液。加入正丁醇,混匀离心,弃上清液,加入乙醚,混匀离心,弃上清液。
1.3.2纯化 有机法联合QIAquick®PCR Purification Kit。Buffer PB 5 mL,RNA 1 μL,离心后取上层液,硅膜滤过,离心。Buffer PB复洗,PE洗液混匀离心,重复2~3次。加入溴化乙啶(EB)30 μL,52 ℃ 5 min,冷冻离心。
1.3.3PCR复合扩增 按照Amp FlSTR IdentifilerTM试剂盒的说明书,在GeneAmp PCR System 9700进行16个基因位点的复合扩增。反应体系10 μL,反应参数:95 ℃ 11 min,94 ℃ 1 min,59 ℃ 1 min,72 ℃ 1 min,60 ℃ 60 min。共30个循环。
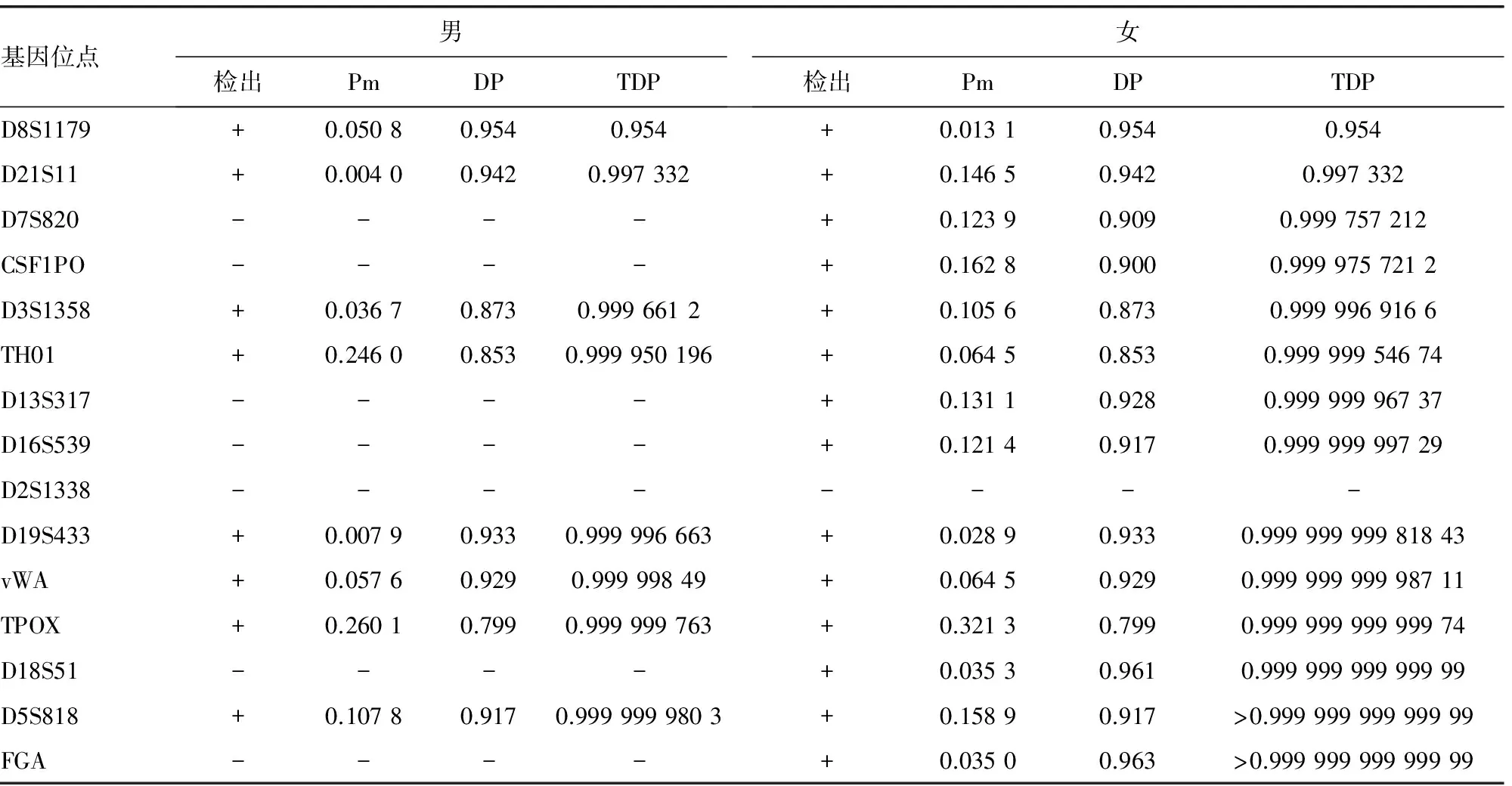
表1 300 ℃焚烧成人股骨存留基因位点的个Pm、DP及TDP
Pm:偶合概率;+:检出;-:未检出。
1.3.4检测 PCR产物 用ABI-3100xl型基因分析仪电泳,电泳信息由软件Data Colletion V 3.0收集,电泳条件为时间2 h,温度60 ℃,电压15 kV,电流140 μA。Gene Mapper Idv 3.2软件把收集的电泳图谱信息经计算机处理成数据信息,与等位基因分子内标比对。

图1 样本(男)基因位点检测结果


图2 样本(女)基因位点检测结果
2 结 果
2.1基因位点检测结果 两例样本均成功提取出DNA,男尸样本DNA图谱有9个位点读出,D8S1179、D21S11、D3S1358、TH01、D19S433、vWA、TPOX、D5S818、FGA,见图1;女尸样本DNA图谱有15个位点读出,D8S1179、D21S11、D7S820、CSF1PO、D3S1358、TH01、D13S317、D16S539、D19S433、vWA、TPOX、D18S51、D5S818、FGA,见图2。与相应未烧骨组织的基因位点相比,位点D2S1338没有检出,相对荧光单位(relative fluorescence units,RFU)值在1 000以下。计算基因位点检出率,男、女例分别为56.25%、93.75%。
2.2个人识别统计分析 按照所述公式计算所检各样本Pi、Pm,以法医DNA分析表作为参照[9],计算出不同温度焚烧后DP、TDP,见表1。由表1可见,300℃,TDP(男):0.999 999 980 3,TDP(女):>0.999 999 999 999 99。计算RPM和LR值,RPM(男):2.322 5×10-12,RPM(女):4.931 3×10-24;LR(男):4.305 7×1011;LR(女):2.027 9×1023。
3 讨 论
3.1RMP与LR概率及意义[9]偶合概率是指从同一群体中随机抽取两名个体的遗传基因型不相同的概率即遗传标记识别无关个体的能力,也是遗传标记对于个人识别效能的定量评估。TDP反映多个遗传标记的识别能力。所用遗传标记数目越多,识别概率越高,鉴别能力越强。偶合概率或叫匹配概率,指人群中随机抽取二无关个体在特定基因座二者的基因型纯粹由于机会一致的概率。LR是假设比对样品个体就是物证DNA的供体的概率与假设人群中随机个体是物证DNA供体的概率比。利用DNA技术,对现场检材与比对样本的基因型比对,计算被检出基因座在人群中的TDP、RMP和LR,可使识别率达到1×1011以上,尽可能地利用基因位点来判定已成为个人识别的主流发展方向。
3.2温度对炭化骨骼DNA完整性的影响 骨骼属于硬组织,相对于人体的其他组织抗焚烧能力强且保存时间长[10],对各种因素有较高的抵抗性,能够保护内部DNA结构,减缓DNA降解和污染,因而成为与焚烧有关的案件和事故中物证缺乏情况下的首选检材。温度升高,加速了遗传物质水解反应,DNA解链、断裂;当升至一定温度,致使模板量严重不足,无法提取出DNA而导致检材无法判定。炭化骨骼微量的DNA的提取,国内外学者一直就没有停止探索,本研究中采用改良的酚-氯仿法对其进行提取,效果令人满意[5,10-15]。炭化骨骼DNA位点的检出率及检测效果明显受焚烧程度的影响,焚烧程度越重DNA检出成功率越低,DNA检验图谱就存在不同程度的位点缺失[4]。本研究表明在300℃大部分位点能够检出,表明存留基因位点对温度升高的耐受力表现相对稳定。在法医实践中,因受热顺序和时间差异,不同温度焚烧所遗骨骼表面颜色不同,就目前技术水平,实践应用中,据此大致推断焚烧时的温度,估计DNA的存留情况,再取舍样本,可提高检测的准确性。
3.3个人识别的分析 法医DNA分析最大的一个领域是对生物物证进行个体识别。在保证受检样本结果正确的前提下,如果比对图谱的分型结果不同,可以排除两个DNA来自同一个体;如果分型相同则有两种可能,一是来自同一个体,二是来自不同个体,只是所检的标记分型一致,此时需要增加DNA标记,当检验的RMP在1×10-11以下时,可以认定来自同一个体。进行个人识别和同一认定,最重要的是需对现场检材与比对样本的基因型,计算被检出基因座的TDP、RMP。在没有近亲关系存在、严格遵守质量控制、无突变、分型正确的前提下,保守地估算,偶合概率达到地球人口的百倍时,可以作出个体同一的认定。在本研究中,选取的男例样本RMP为2.322 5×10-12,女例样本为4.931 3×10-24,均小于1×10-11,和他(她)本人的LR分别达到了4.305 7×1011和2.027 9×1023,完全可以认定为同一个体。由此,提示炭化骨骼作为物证,不要轻易弃之,内部极有可能存留有完全可以作出个人识别的DNA。
综上所述,采用基因分析仪检测存留位点,计算TDP、RMP、LR值可以对炭化骨骼进行个人识别,有较高的法医学实践应用价值。
[1]徐国昌,任甫,候续伟,等.烧骨组织形态变化及DNA技术在个体识别中的应用[J].法医学杂志,2007,23(5):370-372,379.
[2]刘海东,任甫,邢瑞仙,等.烧骨个体识别的研究进展[J].法医学杂志,2009,25(1):61-62.
[3]Schuliar Y,Knudsen PJ.Role of forensic pathologists in mass disasters[J].Forensic Sci Med Pathol,2012,8(2):164-173.
[4]徐国昌,侯续伟,任甫,等.不同温度焚烧对成人股骨16个基因位点的影响[J].解剖学杂志,2008,31(3):406-408.
[5]刘海东,李革,任甫,等.烧骨基因位点保存状况及检测方法比较[J].解剖学杂志,2009,32(4):527-529.
[6]Jules A,Kieser,Joy T,et al.Morphoscopic analysis of experimentally produced bony wounds from low-velocity ballistic impact[J].Forensic Sci Med Pat,2011,7(4):322-332.
[7]Konstantinos M,Chara S.Identification and differential diagnosis of perimortem blunt force trauma in tubular long bones[J].Forensic Sci Med Pat,2006,2(4):221-229.
[8]Cartiser N,Bévalot F,Fanton L,et al.State-of-the-art of bone marrow analysis in forensic toxicology:a review[J].Int J Legal Med,2011,125(2):181-198.
[9]郑秀芬.法医DNA分析[M].北京:中国人民公安大学出版社,2002:45-408.
[10]叶健,季安全,赵兴春,等.烧骨DNA检验技术的研究[J].法医学杂志,2004,20(3):155-159.
[11]徐国昌,侯续伟,任甫,等.烧骨DNA提取与检测技术的实验研究[J].中国临床解剖学杂志,2012,30(1):91-95.
[12]Thompson TJ.Heat-induced dimensional changes in bone and their consequences for forensic anthropology[J].J Forensic Sci,2005,50(5):1008-1015.
[13]Steadman DW,Diantonio LL,Wilson JJ,et al.The effects of chemical and heat maceration techniques on the recovery of nuclear and mitochondrial DNA from bone[J].J Forensic Sci,2006,51(1):11-17.
[14]Hartman D,Drummer O,Eckhoff C,et al.The contribution of DNA to the disaster victim identification(DVI) effort[J].Forensic Sci Int,2011,205(1-3):52-58.
[15]Ubelaker DH.The forensic evaluation of burned skeletal remains:a synthesis[J].Forensic Sci Int,2009,183(1-3):1-5.
