HBe(385-420)-ecdCD40L真核表达载体的构建及其融合蛋白生物活性预测
2012-01-05张欢吴金明陈娟方红龙
张欢,吴金明,陈娟,方红龙
(温州医学院附属第一医院 消化内科,浙江 温州 325000)
乙肝病毒性肝炎是世界范围内广泛传播的传染病,控制乙型肝炎病毒(HBV)的复制、缓解肝组织活动性病变是医学界需要长期攻克的堡垒。近几年来研究表明HBV感染的控制和清除有赖于机体的免疫系统,其感染慢性化与机体针对HBV的特异性免疫,尤其是细胞免疫的缺陷与低下有关。但现在的抗病毒药物均不能纠正这种免疫缺陷,基于上述情况,探索新的治疗性疫苗具有现实意义。治疗疫苗与预防疫苗不同,是基于病毒慢性感染时,机体的免疫系统处于不合适的免疫状态,不能有效清除病毒感染的理论基础而提出的新的治疗策略[1]。乙肝治疗性疫苗着眼于增强或恢复机体针对HBV的特异性免疫,尤其是特异性T细胞免疫,以控制和清除病毒而不损伤肝细胞,最终达到消除HBV感染的目的。
1 材料和方法
1.1 材料 NheI和BamHI限制性内切酶、T4 DNA连接酶购自Fermentas,质粒提取试剂盒及pEGFPN1质粒购自上海捷瑞生物工程有限公司,逆转录试剂盒购自TaKaRa公司,琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒购自TIANGEN公司,PCR引物序列合成及DNA序列测定由上海捷瑞生物有限公司完成。ayr亚型HBV e基因序列由上海捷瑞生物有限公司合成(GeneBank编号NC_003977),人CD40L胞外段基因序列(GeneBank编号NM_000074),连接链(Linker)氨基酸序列为GGGG。
1.2 pEGFP-N1-HBe(385-420)-ecdCD40L真核表达载体的构建
1.2.1 根据HBe(385-420)基因序列以及人CD40L胞外段基因序列合成并纯化4条引物,序列如下:上游引物A:5’-GCTAGCGATGCCTCCCG-3’,中间引物B:5’-TTCTATGAAGGCCGCC-3’,中间引物C:5’-CGGCGGCG GCCTTCATAGA-3’,下游引物D:5’-GGATCCCGGAGTTTGA GTAAGC-3’。A为HBe(385-420)基因的上游引物,引入NheI酶切位点;B和C是部分互补的,分别含HBe(385-420)C端碱基和ecdCD40L N端碱基;D为CD40L的下游引物,引入BamHI酶切位点。
1.2.2 HBe(385-420)-ecdCD40L融合基因的构建PCR过程:第一次PCR:以HBe(385-420)为模板,用引物A和B扩增e129-140基因片段。用细胞总RNA快速提取试剂盒提取健康人外周血单个核细胞的总RNA,再通过RT-PCR法扩增CD40L胞外段。RT反应条件:65 ℃ 1 min,30 ℃ 5 min,20 min匀速升温至65 ℃,65 ℃ 20 min,98 ℃ 5 min。将RT产物(cDNA)置于-20 ℃保存。PCR反应条件:94 ℃预变性5 min,接着94 ℃变性30 s、56.4 ℃复性30 s、72 ℃延长50 s,共28个循环。循环结束后72 ℃延伸7 min后终止反应。然后按照胶回收试剂盒操作说明回收纯化产物。第二次PCR,两个基因的PCR产物回收后,各取1μL加至同一体系进行PCR反应,不加入引物。反应条件:94 ℃预变性2 min,接着94 ℃变性30 s,50 ℃复性1 min,72℃延长1 min,5个循环,最后72 ℃延伸10 min。第三次PCR,以第二次PCR产物为模板,用引物A和D扩增,获得基因片段HBe(385-420)-LecdCD40L。PCR反应条件:94 ℃预变性5 min,接着94 ℃变性30 s、56.4 ℃复性30 s、72 ℃延长50 s,共30个循环。循环结束后72 ℃延伸7 min后终止反应。回收第三次PCR产物。
1.2.3 pEGFP-N1-HBe(385-420)-ecdCD40L真核表达载体的构建:HBe(385-420)-ecdCD40L基因与pEGFP-N1通过双酶切(NheI和BamHI)且在T4 ligase作用下连接成pEGFP-N1-HBe(385-420)-ecdCD40L真核表达载体。
1.3 pEGFP-N1-HBe(385-420)-ecdCD40L真核表达载体软件分析 参考林贤凡等[2]的软件分析方法,融合蛋白的理化性质使用ProtParam tool方案以及DNAStar软件中的Protean程序进行分析;用www.expasy.org网站提供的Protscale方案和Protean程序进行融合蛋白的柔性分析;应用Protean程序分析其抗原性以及表位;应用www.expasy.org网站提供的HNN方案分析融合蛋白的二级结构。
2 结果
2.1 HBe(385-420)-ecdCD40L 融合基因共714 bp,其PCR结果见图1。
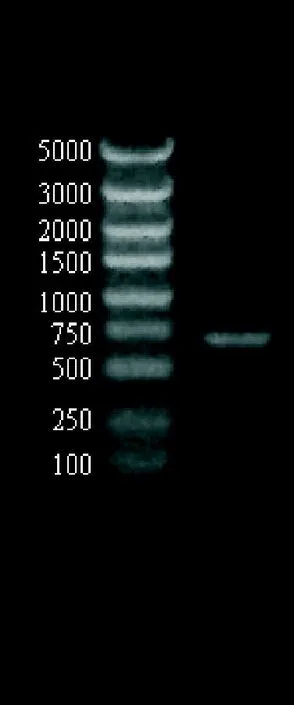
图1 PCR扩增出的目的片段,大小为714bp

图2 质粒pEGFP-N1-HBe(385-420)-ecdCD40L经HindIII/BamHI双酶切后琼脂糖凝胶电泳鉴定
2.2 重组质粒酶切鉴定 所构建质粒 pEGFP-N1-HBe(385-420)-ecdCD40L经HindIII/BamHI双酶切后片段大小分别为241 bp和5131 bp,经琼脂糖凝胶电泳鉴定,片段大小符合(见图2)。
2.3 测序鉴定 测序结果证明pEGFP-N1-HBe(385-420)-ecdCD40L成功构建,融合基因插入方向正确。经DNAman软件比对,结果显示,重组质粒中pEGFPN1-HBe(385-420)-ecdCD40L融合基因序列与原设计相符(见图3)。

图3 pEGFP-N1-HBe(385-420)-ecdCD40L测序

图4 HBe129-140-ecdCD40L、HBe129-140、ecdCD40L亲水性、柔性、抗原性及表位
2.4 融合蛋白HBe(129-140)-ecdCD40L的理化性质分析结果 分子量为25904.4 Da,等电点为8.55,负电荷残基总数(Asp+Glu)为23,正电荷残基总数(Arg+Lys)为26,分子式为C1142H1805N321O347S10,不稳定系数为46.84,该蛋白为不稳定蛋白。通过Protean软件分析可知HBe(385-420)、ecdCD40L两个基因连接之后的亲水性和疏水性未受影响(见图4)。
2.5 柔性分析结果 经分析,14到17位氨基酸(linker所在部位)存在高柔性区,连接链两侧的柔性区未发生改变(见图4-5)。

图5 HBe129-140-ecdCD40L柔性分析
2.6 抗原性分析 结果显示Linker部位抗原性低,并且两侧HBe(129-140)及ecdCD40L氨基酸序列的抗原性未发生改变(见图4)。

图6 HBe129-140-ecdCD40L二级结构
2.7 表位分析结果 通过软件分析显示HBe(129-140)-ecdCD40L没有新的表位出现,14~17位氨基酸表位值低(见图4)。
2.8 HBe(129-140)-ecdCD40L融合蛋白的二级结构预测结果 提示二级结构由Alpha helix(Hh)为34.33%,Extended strand(Ee)为19.74%,Random coil(Cc)为45.92%构成,linker所在部位基本为无规卷曲,不影响两侧HBe(129-140)和ecdCD40L结构(见图6)。
3 讨论
HBeAg血清转换是目前抗HBV病毒的治疗目标,也是HBV慢性感染进入低或非复制期的标志,可见HBeAg特异性免疫反应一旦获得,机体内HBV的复制将能得到有效的控制[3],并且体外HBeAg具有较强的免疫原性,以HBeAg作为免疫原研究乙肝治疗性疫苗涉及到如何增强疫苗免疫原性,增强其诱发的HBeAg特异性免疫反应的问题。
HBeAg的优势T细胞识别表位分别为HBe(120-131)(VSFGVWIRTPPA)和 HBe(129-140)(PPAYRPPNAPIL);通过Milich等[4]研究证明:相对于HBe(129-140),HBe(120-131)容易诱导免疫耐受,HBe(129-140)作为HBeAg的优势表位,重要的特点是能够逃避免疫耐受诱导的同时能够引起体内自身免疫性反应。
树突状细胞(DC)是体内功能最强的专职抗原递呈细胞,能摄取、加工并递呈抗原,刺激初始T细胞的增殖、活化从而启动机体的特异性免疫应答,CD40L信号有助于DC的分化与成熟,反之DC的CD40信号也能促进CD4+T淋巴细胞甚至直接促进CD8+T淋巴细胞的活化与效应功能的产生。经CD40L刺激后的DCs具有如下特性:①DCs抗原递呈能力增强。②DCs具有较强的T淋巴细胞趋化能力。③DCs体外刺激T淋巴细胞增殖反应能力增强。④DCs表面的共刺激分子(CD80、CD86等)明显上调,能够产生较高水平的IL-12、IFN-γ、TNF-α等细胞因子,并使Th0向Th1分化,增强细胞免疫应答[5]。
Li等[6]研究曾发现,将肿瘤相关抗原E7与ecdCD40L基因融合构建腺病毒表达载体,表达的融合蛋白对DC具有明显刺激作用,且ecdCD40L可增强E7的免疫原性,提示将ecdCD40L与抗原基因融合是切实可行的,且具有明显的免疫增强效果。结合CD40L可靶向作用于DC,促进DC成熟,诱导T细胞免疫,具有免疫增强作用。鉴于此,本研究将HBe(385-420)基因与CD40L胞外段(ecd)基因融合,构建真核表达载体,ecdCD40L可增强HBe(385-420)免疫原性,诱导更强的特异性T细胞免疫,为乙肝治疗性疫苗的研究作准备。
为了确保重组融合蛋白各个部分不会相互干扰而形成非天然构象,本研究引人了linker序列,构建了HBe(385-420)、CD40L胞外段重组表达载体pEGFP-N1-HBe(385-420)-ecdCD40L,通过酶切和测序鉴定载体构建成功,并运用生物信息学软件对其空间结构和性质进行了预测。通过对重组表达载体的全面分析,促进我们对融合蛋白HBe(385-420)-ecdCD40L更深的认识,并且证实重组体设计的合理性,表达的蛋白生物活性在融合过程中未受影响,这为我们以后基因体内外实验研究奠定了基础。
[1] Autran B,Carcelain G,Combadiere B, et al.Therapeutic vaccines for chronic infections[J].Science,2004,305(5681):205-208.
[2] 林贤凡,吴金明,陈瑾,等.乙肝表面抗原-CD40L胞外段融合蛋白的设计和生物活性预测[J].温州医学院学报,2009,39(3):205-208.
[3] 闫涛,李梵,王慧芬,等.探讨慢性乙型肝炎患者的HbeAg血清转换[J].军医进修学院学报,2011,32(1):21-22,31.
[4] Milich DR, McLachlan A K, Raney AK, et al. Autoantibody production in hepatitis B e antigen transgenic mice elicited with a self T-cell peptide and inhibited with nonself peptides[J]. Proc Natl Acad Sci USA,1991,88(10):4348-4352.
[5] Liu Y,Zhang X,Zhang W, et al. Adenovirus-mediated CD40 ligand gene-engineered dendritic cells elicit enhanced CD8(+) cytotoxic T-cell activation and antitumor immunity[J].Cancer Gene Ther,2002,9(2):202-208.
[6] Zhang L,Tang Y,Akbulut H,et a1.An adenoviral vector cancer vaccine that delivers a tumor-associated antigen/CD40-ligand fusion protein to dendritic cells[J].Proc Natl Acad Sci USA,2003,100(25):15101-15106.
