樟树对土壤中PAHs的修复及其影响因子
2012-01-05梁小翠闫文德田大伦王光军
梁小翠 ,闫文德 ,田大伦,朱 凡 ,王光军,郑 威
(1.中南林业科技大学,湖南 长沙410004;2. 南方林业生态应用技术国家工程实验室,湖南 长沙 410004;3.城市森林生态湖南省重点实验室,湖南 长沙 410004; 4. 国家野外科学观测研究站,湖南 会同418307)
樟树对土壤中PAHs的修复及其影响因子
梁小翠1,3,闫文德1,2,3,田大伦1,2,朱 凡1,2,王光军1,3,郑 威1,4
(1.中南林业科技大学,湖南 长沙410004;2. 南方林业生态应用技术国家工程实验室,湖南 长沙 410004;3.城市森林生态湖南省重点实验室,湖南 长沙 410004; 4. 国家野外科学观测研究站,湖南 会同418307)
采用室内盆栽实验,利用柴油设置2 g·kg-1(L1),10 g·kg-1(L2)和50 g·kg-1(L3)模拟PAHs浓度梯度,对盆栽的1年生樟树幼苗对PAHs的修复机制及影响因子进行研究。结果表明:(1)不同浓度PAHs污染(L1、L2、L3)水平下,樟树幼苗土壤中PAHs的去除率分别为85.86%、91.95%、80.80%,均高于无植物处理。(2)PAHs在樟树不同器官中的积累浓度不同。中、低浓度污染处理水平(L2、L1)下,樟树各器官对PAHs的积累作用均表现为:叶>根>干;高浓度污染处理水平(L3)下则表现为根>叶>干。不同污染处理(L1、L2、L3)水平下,樟树吸收累积作用修复PAHs污染土壤的贡献率分别为64.26%、22.81%、11.39%。(3)随着PAHs污染浓度的增大,樟树不同部位生物浓缩系数逐渐减小。叶和根是樟树富集PAHs的主要部位。(4)5 cm 土壤温度和多酚氧化酶是影响樟树修复PAHs污染土壤的关键因子,真菌、放线菌数量和磷酸酶活性可以作为土壤PAHs污染评价的生物指标。研究结果可为南方城市PAHs污染修复优良绿化树种的筛选提供理论依据。
樟树;植物修复;多环芳烃;柴油;微生物数量;酶活性;土壤温度
多环芳烃(Polycyclic aromatic hydrocarbons,简称PAHs)是由包含碳和氢的化合物不完全燃烧形成的两个或两个以上苯环稠和而成的具有生物可积累性的持久性有机污染物[1]。PAHs最主要的来源是人为源,包括煤、石油、天然气的燃烧、交通运输、废物燃烧、工业生产、家庭取暖等[2]。近年来随着人口的增长,城市及工业化进程的加快,PAHs污染严重威胁着人类健康以及生态系统的平衡。因此环境中PAHs污染的修复引起了人们的广泛关注。
目前国内外PAHs污染修复技术主要有物理、化学和生物修复[3]。利用物理、化学方法修复有机污染环境,费用昂贵,而且还可能使当地的生态资源难以再利用,对于大面积污染土壤也难以实施[4]。生物修复具有二次污染少、安全、无毒、价廉等优点,是环境中PAHs最彻底的处理方法[5],其中植物修复(phytoremediation)是利用植物吸收、降解以及根际圈降解的作用方式将污染物从环境中彻底去除,具有处理费用相对低廉、对环境扰动少和使资源可持续利用的特点[4],而且操作比较简单,尤其是多年生木本植物可一次投入多年受益,兼具修复、保护和美化环境的功能[6]。
樟树Cinnamomum camphora为常绿乔木,吸毒、抗毒性能较强,成为南方许多城市和地区园林绿化的首选良木,深受园林绿化行业的青睐。本文采用室内盆栽实验,利用柴油设置2 g·kg-1(L1),10 g·kg-1(L2) 和 50 g·kg-1(L3) 模拟PAHs浓度梯度,研究了1年生樟树幼苗对污染土壤中PAHs的修复机制及影响因子,不仅可丰富生物修复理论,而且为南方城市优良绿化树种的筛选提供理论依据。
1 材料与方法
1.1 试验材料
供试苗木来源于黄兴镇苗木基地,为一年生樟树实生苗。土壤为中南林业科技大学长沙校区与湖南省株洲市夕阳红苗圃园土壤以1∶1比例混合的土壤,自然风干后过1 mm筛备用。土壤理化性质为:全氮 1.33 g·kg-1,总有机碳 17.21 g·kg-1,pH 值4.84,含水量22.0%。污染物用市售0号柴油模拟PAHs污染,因为柴油的芳烃和PAHs含量在陆地上使用的中程燃油中最高[7]。
1.2 试验设计
利用柴油设置 2 g·kg-1(L1)、10 g·kg-1(L2)和50 g·kg-1(L3)模拟PAHs低、中、高污染浓度梯度,土壤和柴油拌匀放置48 h充分平衡后,分装到直径35 cm、高30 cm的圆形塑料盆中,移栽生长发育良好且大小较一致的樟树幼苗。同时设置无植物处理作为对照。每一种处理有3个重复,放置在湖南省长沙市中南林业科技大学城市生态站温室中,实验历时1年。平时用自来水保持所有供试苗木盆内土壤湿度,室内温度因开窗对流与环境温度基本保持一致。
1.3 测定方法
土壤和植物中PAHs为美国环保总署确定的16种优先监测污染物(EPA-PAHs),分别是萘、苊、芴、菲、蒽、芘、苊烯、荧蒽、苯并(a)蒽、苯并(b)荧蒽、苯并(a)芘、苯并(k)荧蒽、二苯并(a,h)蒽、茚并(1,2,3-cd)芘、苯并(g,h,i)苝,用Agilent 6890GC/5973MS气质联用仪测定PAHs总含量[8]。
土壤全氮采用凯氏定氮法,土壤有机碳采用重铬酸钾氧化法,土壤pH用PXS-270型离子计测定,土壤含水量采用烘干法[9]。土壤中5 cm的温度用Li-6400-09的土壤温度探针测定。
土壤微生物(细菌、真菌、放线菌)数量:稀释平板菌落计数法[10-11]。磷酸酶活性:磷酸苯二钠比色法测定,结果以2 h后100 g土壤中P2O5的毫克数表示(mg P2O5·100 g-1)[12];多酚氧化酶活性:邻苯三酚比色法测定,结果以3 h后100 g土壤中紫色没食子素的毫克数表示(mg紫色没食子素·100 g-1,3 h)[13]。
1.4 数据处理
数据用Excel和SPSS 13.0软件统计分析。PAHs的去除率(R)计算公式为:R=(C0-Ct)×100%/C0,式中C0为土壤中PAHs初始浓度,Ct为取样时土壤中PAHs残留浓度。
2 结果与分析
2.1 樟树对土壤中PAHs的去除作用
1年后樟树对土壤中PAHs的去除作用见表1。不同浓度PAHs污染(L1、L2、L3)水平下,无植物处理土壤中PAHs的去除率分别为66.68%、91.63%、34.78%,有植物处理土壤中PAHs的去除率分别为85.86%、91.95%、80.80%,均高于无植物处理。可见植物的存在促进了土壤中PAHs的修复。无植物和有植物处理土壤中PAHs的去除率均是 L2>L1>L3。
2.2 樟树对土壤中PAHs的累积作用
表2为1年后樟树不同器官对土壤中PAHs的累积作用。可以看出,PAHs在樟树不同器官中的积累浓度不同。中、低浓度污染处理水平(L2、L1)下,樟树各器官对PAHs的积累作用均表现为:叶>根>干;高浓度污染处理水平(L3)下则表现为根>叶>干。方差分析表明,L1水平下,根、干、叶积累浓度差异显著(p<0.05);L2水平下,干与根、叶积累浓度差异显著(p<0.05),根和叶差异则不显著(p>0.05);L3水平下,各器官对PAHs的积累作用没有显著性差异(p>0.05)。PAHs在植物不同器官富集程度的差异可能与植物自身脂肪含量的不均匀性有关[14]。表2还显示,不同污染处理水平下,樟树吸收累积作用修复PAHs污染土壤的贡献率不同,L1、L2、L3水平下贡献率分别为64.26%、22.81%和11.39%。可见,PAHs污染越严重,植物吸收积累作用对修复PAHs污染的贡献率越小,这可能是因为PAHs浓度增大到一定程度时,会产生胁迫作用,影响植物的正常生长和新陈代谢等生理活动[15]。

表2 樟树不同器官对土壤中PAHs的累积作用†Table 2 PAHs accumulation in different organs of Cinnamomum camphora
2.3 樟树对土壤中PAHs的生物浓缩系数
生物浓缩系数(Bioconcentration factors,缩写BCFs)是指生物体内污染物累积浓度与其生长环境介质中污染物残留浓度的比值,常用于评价或衡量生物体对某一污染物的修复或富集能力[16]。生物浓缩系数越大,表明该生物体的修复或富集能力越高。通过对比分析樟树的根、干、叶部的BCFs与土壤中PAHs污染浓度的对应关系(图1)发现,随着PAHs污染浓度的增大,樟树不同部位生物浓缩系数均呈现逐渐减小的趋势,这与潘声旺等研究发现沿阶草对 PAHs的BCFs随土壤中 PAHs可提取态残留浓度的增大而降低结果一致[17]。在同一浓度PAHs污染处理下,低浓度(L1)和中浓度(L2)处理生物浓缩系数均表现为叶>根>干, 高浓度PAHs污染(L3)处理则表现为根>叶>干。可见叶和根是樟树富集PAHs的主要部位。
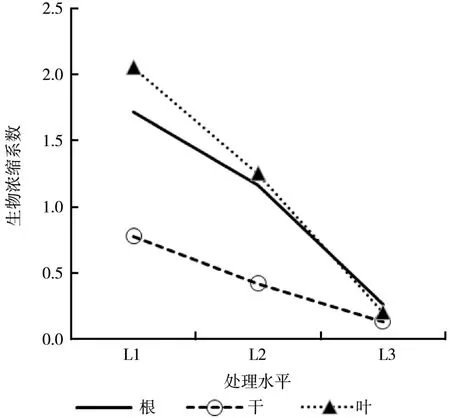
图1 樟树各器官中PAHs的生物浓缩系数Fig. 1 Bioconcentration factors for PAHs in different organs of Cinnamomum camphora
2.4 樟树修复土壤中PAHs的影响因子
(1)土壤微生物数量
土壤微生物区系(包括微生物数量、组成)的演变是反映土壤环境质量变化的重要生物学指标,其中细菌、放线菌、真菌是土壤微生物区系的主要组成成分。本试验中,樟树幼苗土壤中真菌数量与PAHs残留浓度呈显著负相关(r=-0.316,p<0.05),与PAHs初始浓度呈极显著负相关(r=-0.405,p<0.01),但与PAHs去除率则没有显著相关性(p>0.05);放线菌数量与PAHs去除率存在极显著负相关关系(r=-0.403,p<0.01);细菌数量和微生物总数与PAHs却没有显著相关性(p>0.05)(表3)。可见微生物数量并不是影响樟树修复PAHs污染土壤的关键因子,但真菌和放线菌数量却可以作为土壤PAHs污染评价的生物指标。
(2)土壤酶活性
酶是土壤中生物化学反应的直接参与者,是土壤的重要组成部分,其活性高低可反映土壤营养物质转化、能量代谢、污染物降解等能力的强弱[18]。由表3可得,樟树幼苗土壤磷酸酶活性与PAHs残留浓度相关系数为0.451,达到极显著正相关(p<0.01),与PAHs初始浓度相关系数为0.385,显著正相关(p<0.05),表明樟树幼苗土壤PAHs的添加对磷酸酶活性有激活作用,这与宫璇等[19]研究结果相同;但磷酸酶活性与PAHs去除率却没有显著相关性(p>0.05),表明磷酸酶对PAHs的去除贡献不大,这可能与磷酸酶主要是促进土壤中有机磷化合物或无机磷酸盐转化成无机态磷,而本试验中研究的PAHs为非含磷化合物有关;但是PAHs能够促进磷酸酶活性的增加,因此可以作为土壤PAHs污染评价的生物指标。樟树幼苗土壤多酚氧化酶活性与PAHs去除率呈显著正相关(r=0.360,p<0.05),表明多酚氧化酶能够促进PAHs的降解,这可能与多酚氧化酶能够参与芳香族化合物的分解转化过程,是土壤中重要的氧化还原酶有关[20]。这与丁克强等的研究结果是一致的[21-22]。表明多酚氧化酶在樟树修复PAHs污染土壤的过程中起着关键性的作用。
(3)土壤温度
由表3可得,5 cm土壤温度与PAHs残留浓度呈现出极显著负相关关系(r=-0.466,p<0.01),与PAHs去除率呈极显著正相关关系(r=0.614,p<0.01),可见土壤温度升高有利于PAHs的去除,一方面土壤温度升高有利于低分子量PAHs从土壤介质中挥发出去,另一方面可能是温度的升高能够促进部分酶活性的增强,如本试验中,5 cm土壤温度与多酚氧化酶活性极显著正相关(r=0.459,p<0.01),多酚氧化酶活性增强将加快PAHs的降解。
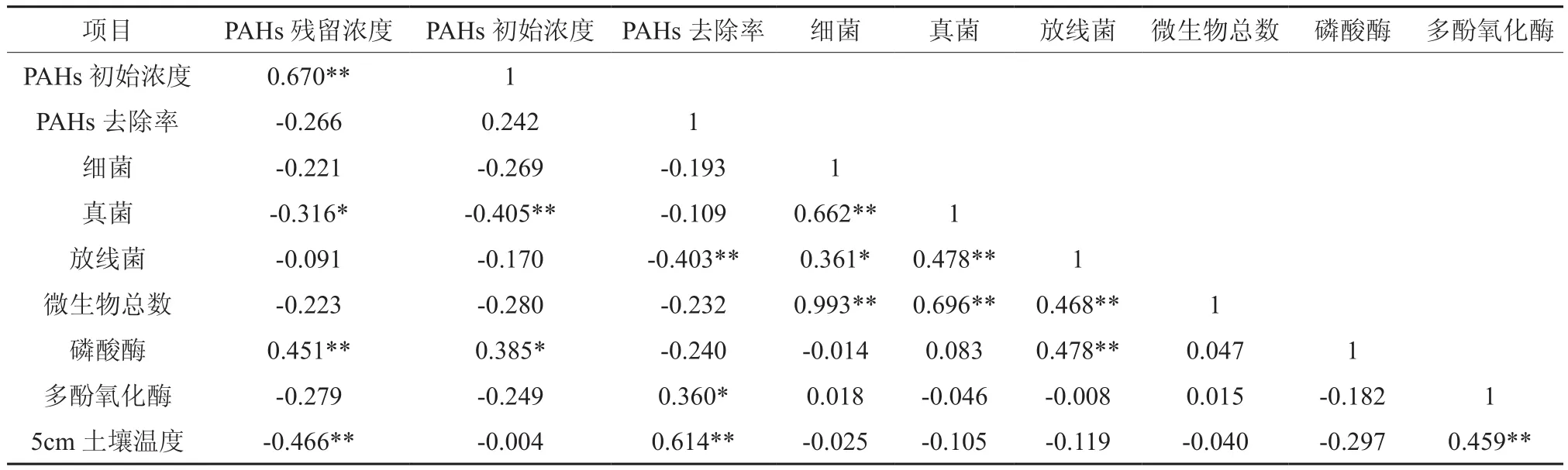
表3 樟树修复土壤中PAHs的影响因子†Table 3 Impact factor of PAHs remediation of Cinnamomum camphora
3 结 论
(1)不同浓度PAHs污染(L1、L2、L3)水平下,有植物处理土壤中PAHs的去除率均高于无植物处理。可见樟树促进了土壤中PAHs的修复作用。
(2)不同污染处理水平下,PAHs在樟树不同器官中的积累浓度不同。中、低浓度污染处理水平(L2、L1)下,樟树各器官对PAHs的积累作用均表现为:叶>根>干;高浓度污染处理水平(L3)下则表现为根>叶>干。樟树吸收累积作用修复PAHs污染土壤的贡献率随PAHs污染程度的加强而变小。
(3)随着PAHs污染浓度的增大,樟树不同部位生物浓缩系数均呈现逐渐减小的趋势。叶和根是樟树富集PAHs的主要部位。
(4)真菌、放线菌数量和磷酸酶活性可以作为土壤PAHs污染评价的生物指标。多酚氧化酶活性的增强和5 cm土壤温度的升高有利于PAHs的去除,是影响樟树修复PAHs污染土壤的关键因子。
[1] Gaga E O, Tuncel S G. Occurence and distribution of polycyclic aromatic hydrocarbons in Ankara precipitation[J].Water, Air,and Soil Pollution, 2003, (3): 127-134.
[2] Chiara De Rossi, Reinhard Bierl, Jens Riefstahl. Organic pollutants in Precipitation: monitoring of pesticides and polycyclic aromatic hydrocarbons in the region of Tier(Germany)[J]. Physics and Chemistry of the Earth,2003,28: 307-314.
[3] 张利红,李培军,巩宗强,等.不同介质中多环芳烃光降解及与生物耦合降解研究现状[J].生态学杂志,2006,25(4):461-466.
[4] 魏树和,周启星.有机污染环境植物修复技术[J].生态学杂志,2006,25(6):716-721.
[5] 吉云秀,邵秘华.多环芳烃的污染及其生物修复[J].交通环保,2003,24(5):33-36.
[6] 夏会龙,吴良欢,陶勤南.有机污染环境的植物修复研究进展[J]. 应用生态学报,2003,14(3):457-460. In: Kirschner E M.Botanical plants prove useful in cleaning up industrial sites[J].Chem Eng News,1995,73: 22-24
[7] 宋雪英, 宋玉芳, 孙铁珩, 等. 柴油污染土壤对小麦种子萌发及幼苗生长的生态毒性效应[J]. 农业环境科学学报, 2006,25(3): 554-559.
[8] 梁小翠, 朱 凡, 闫文德, 等. 马褂木盆栽土壤酶活性对PAHs胁迫的响应[J].中南林业科技大学学报,2011,31(5):92-95.
[9] 田大伦. 杉木林生态系统定位研究方法[M]. 北京: 科学出版社, 2004.
[10] 中科院南京土壤研究所微生物室.土壤微生物研究法[M]. 北京: 科学出版社, 1985.
[11] 俞毓馨, 吴国庆, 孟宪庭. 环境工程微生物检验手册[M]. 北京: 中国环境科学出版社, 1990.
[12] 关松荫.土壤酶及其研究方法[M].北京:中国农业出版社,1986.
[13] 严昶升.土壤肥力研究方法[M].北京:农业出版社,1988.
[14] 潘声旺, 魏世强, 袁 馨, 等. 金发草对土壤中菲、芘的修复机制[J]. 环境科学, 2009, 30(5):1273-1279.
[15] Merianne Alkio, Tomoko M, Tabuchi, et al. Stress responses to polycyclic aromatic hydrocarbons in Arabidopsis include growth inhibition and hypersensitive response-like symptoms[J]. Journal of Experimental Botany,2005,56(421): 2983-2994.
[16] Jon A, A rnot, Frank A P C. A review of bioconcentration factor(BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms. Environmental Reviews, 2006,14 (4): 257- 297.
[17] 潘声旺, 魏世强, 袁 馨, 等. 沿阶草(Ophiopogon japanicus)对土壤中菲芘的修复作用[J].生态学报, 2008, 28(8): 3654-3661.
[18] 范淑秀,李培军,巩宗强,等.苜蓿对多环芳烃菲污染土壤的修复作用研究[J].环境科学,2007,28(9):2080-2084.
[19] 宫 璇,李培军,张海荣,等.菲对土壤酶活性的影响[J].农业环境科学学报,2004,23(5):981-984.
[20] 周 乐.多环芳烃降解菌的筛选、降解条件及其与玉米联合修复菲、芘污染土壤的研究[D].南京:南京农业大学学位论文,2006.
[2] 丁克强,骆永明,刘世亮,等. 黑麦草对菲污染土壤修复的初步研究[J]. 土壤,2002,4:233-236.
[22] 丁克强,骆永明,刘世亮,等. 黑麦草对土壤中苯并[a]芘动态变化的影响[J]. 土壤学报,2004,41(3): 348-353.
Phytoremediation of polycyclic aromatic hydrocarbons in soils by Cinnamomum camphora and impact factors
LIANG Xiao-cui1,3, YAN Wen-de1,2,3, TIAN Da-lun1,2, ZHU Fan1,2, WANG Guang-jun1,3, ZHENG Wei1,4
(1. Central South University of Forestry & Technology, Changsha, 410004, Hunan, China; 2. National Engineering Laboratory for Applied Technology of Forestry & Ecology in South China, Changsha 410004, Hunan, China; 3. Key Laboratory of Urban Forest Ecology of Hunan Province, Changsha 410004, Hunan, China; 4. National Field Station for Scientif i c Observation and Experiment,Huitong 418307, Hunan, China)
By pot experiments in greenhouse, phytoremediation and its impact factor were investigated for one-year-old Cinnamomum camphora treated with unplanted soils (control) and at three diesel concentrations (2 g·kg-1(L1),10 g·kg-1(L2) and 50g·kg-1(L3)) to stimulate different levels of PAHs pollution. The results show that the removal rates of PAHs by C. camphora were 85.86%, 91.95% and 80.80% at L1, L2 and L3 levels, and all were higher than unplanted treatment; PAHs accumulations in the organs of C. camphora were different, at L2 and L1 levels, the accumulation of PAHs by C. camphora was in an order: leaf>root>stem, while it was root>leaf>stem at L3 levels; and the contribution rates for PAHs phytoremediation by absorption and accumulation of C. camphora were 64.26%, 22.81% and 11.39% at L1, L2 and L3 levels; the bio-concentration factors became smaller with the increase of PAHs pollution, and leaf and root were the important organs for C. camphora to enrich PAHs; the temperature at 5 cm soil and polyphenol oxidase were the key factors for PAHs phytoremediation by C. camphora; the fungi, actinomycetes population and phosphatase activity were suggested as the biological indicators of soil PAHs pollution. The fi ndings could provide a theoretic evidence for screening good trees which have great effect on remediation of PAHs pollution.
Cinnamomum camphora; phytoremediation; polycyclic aromatic hydrocarbons; diesel oil; microbial population; enzyme activities; soil temperature
2012-10-10
国家自然科学基金项目(31070410、30571487、30771700、30870455);教育部新世纪优秀人才支持计划(NCET-10-0151);长沙市科技局项目(K1003009-61);中南林业科技大学青年科学研究基金重点项目(QJ2010008A)资助
梁小翠(1981-),女,河北保定人,博士研究生,讲师,主要从事城市生态学研究
闫文德(1969-),男,甘肃武威人,博士,教授,主要从事森林生态和城市生态学研究;E-mail:csfuywd@hotmail.com
S792.23
A
1673-923X(2012)12-0176-05
[本文编校:吴 彬]
