水洗和酸洗蛭石体系中Mn2+吸附的差异分析
2012-01-05刘毅霖姚咏歌
刘毅霖,李 芸,彭 婧,姚咏歌,陈 星
(中南林业科技大学 环境科学与工程研究所,湖南 长沙 410004)
水洗和酸洗蛭石体系中Mn2+吸附的差异分析
刘毅霖,李 芸,彭 婧,姚咏歌,陈 星
(中南林业科技大学 环境科学与工程研究所,湖南 长沙 410004)
以水洗和酸洗蛭石为吸附剂,研究了固/液吸附体系中Mn2+的吸附特性。结果表明,水洗和酸洗蛭石体系Mn2+离子的吸附都存在明显的离子和吸附剂浓度效应,水洗蛭石体系Mn2+离子的去除率显著高于酸洗蛭石体系。在酸洗过程中,蛭石表面部分吸附位被H+离子占据,降低了阳离子的交换能力。酸洗蛭石的吸附容量低,在吸附过程中H+离子的解吸会降低出水溶液的pH值,不宜作为湿地基质填料。
离子吸附,蛭石,水洗,酸洗,Mn2+
湖南锰矿的保有储量约占全国20%,居全国第2位。湖南锰矿的开采给经济带来了巨大效益的同时,也由于缺乏有效保护措施,在矿区及周边地区造成了严重的重金属污染。水体中锰含量过高会影响生活和工业用水水质[1],锰通过食物链污染途径进入人体后,过量累积会对大脑和呼吸系统带来损害,引起幻觉、健忘、神经紊乱、锰肺炎等病症[2-4]。因此,必须采取有效措施控制锰矿区的污染。
研究表明人工湿地技术可用于锰矿污染区的治理[5-8]。人工湿地中基质对重金属离子的吸附作用会直接影响系统去除重金属的效率,因此,廉价、吸附容量大的天然粘土矿物被广泛地用来作为人工湿地的填料[9]。国内外已有很多学者进行了粘土矿物重金属吸附方面的研究,如蛭石[10-17]、沸石[18-19]、海泡石[20]、硅藻土[21]、膨润土[22]、高岭石[23]等。其中,蛭石作为一类典型的粘土[24],具有储量丰富、价格低廉、吸附容量大,对环境无毒无害,且容易再生等优点[25-26]。国内外关于蛭石吸附锰元素方面的报道甚少,因此,本研究以水洗和酸洗蛭石为吸附剂,测试分析了固/液吸附体系中Mn2+的吸附特性,目的是为构建锰矿污染区人工湿地拦截净化系统的填料选择提供基础试验数据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 材料
实验选用河北灵寿县地矿二厂生产的天然蛭石作为吸附剂,蛭石主成分为
Mgx(H2O){Mg3-x[AlSiO3O10](OH)2},将天然蛭石通过水洗和酸洗制成水洗蛭石和酸洗蛭石。实验所用Mn2+标准溶液由分析纯MnSO4·H2O试剂配制。
1.1.2 仪器
试验所用主要仪器有101-1AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司),SHA-C型水浴恒温振荡器(荣华公司),YN.ZD.Z型不锈钢断水自控电热蒸馏水器(上海博迅实业有限公司医疗设备厂),AUW220D型分析天平(岛津制作所),AA-7002型原子吸收分光光度计(北京东西分析仪器有限公司)。
1.2 试验方法
1.2.1 蛭石处理
水洗蛭石:取20 kg蛭石,过筛,取20~40目颗粒。再用5倍的蒸馏水浸泡吸附剂2 h,期间每30 min均匀搅拌2 min,2 h后再均匀搅拌2 min,静置10 min,将蒸馏水倒掉。然后再加5-10倍的蒸馏水浸泡吸附剂2 h,如此循环6次以上。水洗后,将吸附剂置于烘箱中(温度100 ℃~105℃)烘干,存放在干燥器里备用。
酸洗蛭石:按上述步骤将蒸馏水换成0.05 mol·L-1硫酸溶液制备酸洗吸附剂样本。
1.2.2 吸附实验
在250 mL具塞锥形瓶中分别加入定量称取的水洗/酸洗蛭石样品和100.00 mL不同浓度的Mn2+离子的标准溶液,塞紧置于水浴恒温振荡器中恒温(25℃)振荡24 h,转速为200 r/min。振荡后静置8 h,然后用中速定量滤纸过滤。过滤后清液中Mn2+浓度用原子吸收分光光度计测定。试验起始 Mn2+浓度点为0.5、1.0、1.5、2.0、3.0、4.0、4.5、6.0 mmol/L,蛭石浓度点为 20、50、100 g/L。
试验(包括空白与对照)设置两个平行样本,样本系列进行两次重复试验。标准差(SD)和相对误差(RD)分析表明平行试验的精确度高和重复试验的重现性好。数据分析和作图采用了Microsoft Excel程序。
1.3 计算公式
平衡吸附量和去除率分别用式(1)、(2)计算:
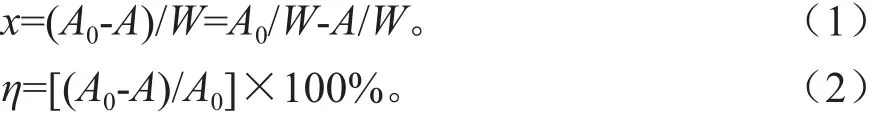
式中,x为吸附密度(mg·g-1);A0为起始离子浓度(mg·L-1);A 为平衡时液相离子浓度 (mg·L-1);W 为吸附剂浓度(g·L-1);η为去除率(%)。
2 结果与讨论
2.1 离子浓度效应
图1所示的实验结果表明给定吸附剂浓度时,水洗蛭石和酸洗蛭石的吸附密度均随起始离子浓度的增大而增大,曲线斜率在高离子浓度点上逐渐趋于平缓。在相同的吸附剂和起始离子浓度点上,酸洗蛭石的吸附密度均小于水洗蛭石的吸附密度,说明酸洗蛭石的吸附能力低于水洗蛭石。在起始离子浓度较低的点上,水洗和酸洗蛭石之间吸附密度的差异较小,随起始离子浓度增大,两者差异增大,达到显著性水平(p<0.001)。起始离子浓度较低时,体系中Mn2+总量少,吸附剂表面吸附点位相对多,对吸附密度的影响不明显,随起始离子浓度增大,吸附点位差异的影响则越来越显著,酸洗蛭石的吸附容量小,易于趋向吸附饱和,因此其与水洗蛭石吸附密度差异的绝对值逐渐增大。
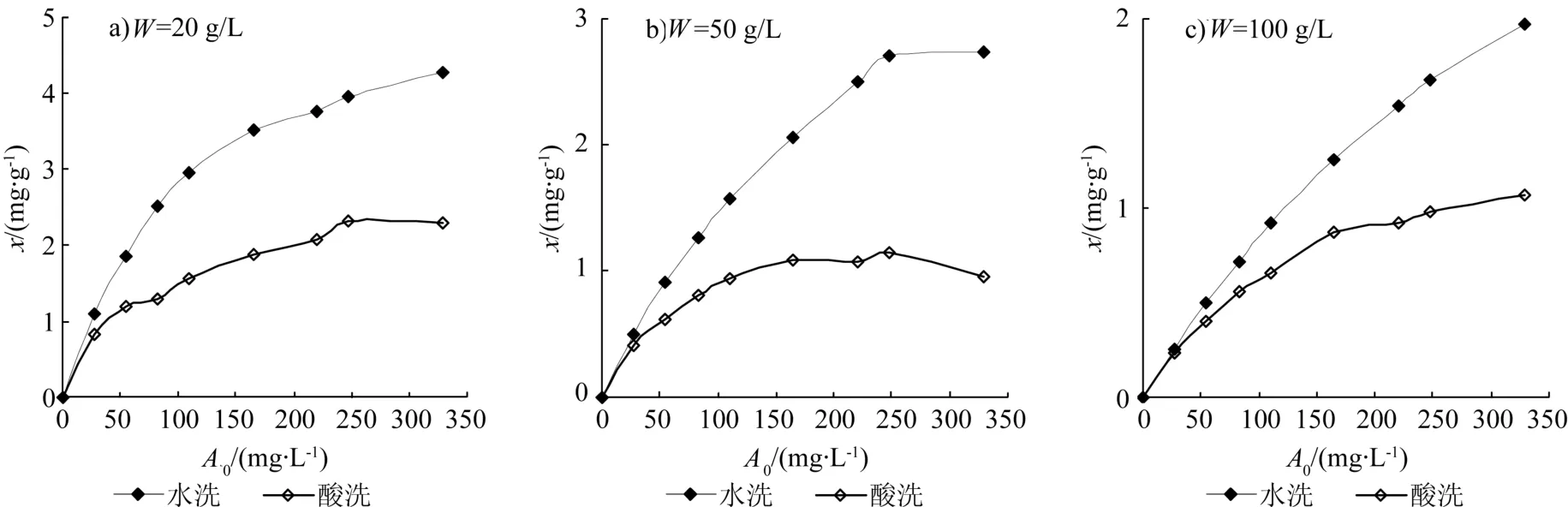
图1 不同起始Mn2+浓度(A0)和吸附剂浓度(W)点上的测定的离子吸附密度(x)Fig. 1 Measured adsorption density (x) at different initial Mn2+ ion concentration (A0) and adsorbent concentration (W) levels
2.2 吸附剂浓度效应
吸附剂浓度效应是指经典等温吸附曲线(x-A曲线)呈现随吸附剂浓度增大而降低的趋势[27-28]。图2分别给出了Mn2+在3个不同水洗和酸洗蛭石浓度水平上的等温吸附曲线。如图2所示,在给定吸附剂浓度(W)时,水洗和酸洗蛭石的吸附密度(x)与平衡时液相离子浓度(A)具有较好的相关性,但是当W发生变化时,不同W水平上的离子吸附等温线之间存在显著的差异,基本趋势是x随W增大而降低,呈现明显的吸附剂浓度效应,说明在试验条件下,x与A不存在一一对应关系,即x是A和W两个变量的函数。对比图2中水洗和酸洗蛭石的曲线,可看出水洗样本的吸附剂浓度效应比酸洗样本更显著,其原因可归结于两者吸附能力的差异。
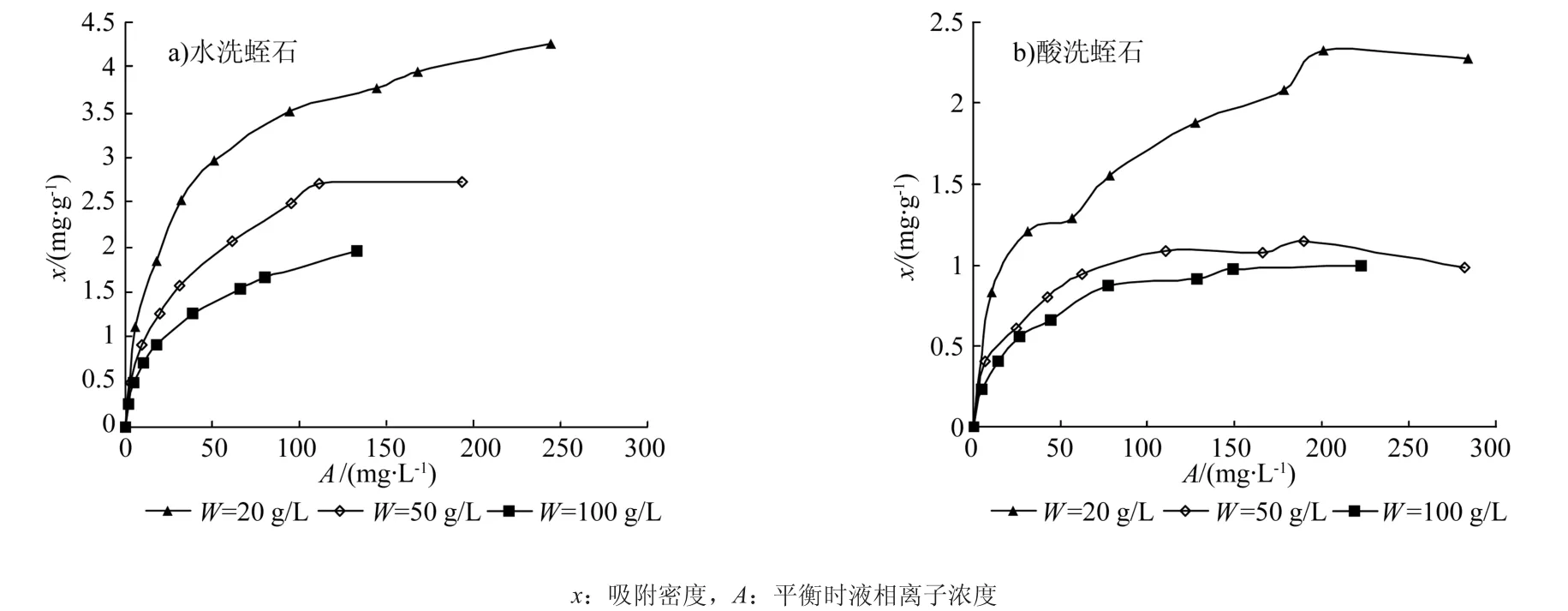
图2 不同吸附剂浓度(W)下Mn2+吸附等温线Fig. 2 Mn2+ adsorption isotherms of adsorption isotherm with different adsorbent concentration (W) levels
2.3 吸附体系pH的变化
表1的结果显示,在水洗和酸洗蛭石体系中,所有W点上起始溶液pH值随A0增大而显著降低,其原因是,配制Mn2+离子溶液使用的试剂是MnSO4·H2O,MnSO4为强酸弱碱盐,Mn2+离子在溶液中发生水解反应产生H+离子,Mn2+离子浓度增大将促进水解反应,使得溶液pH值降低。
在水洗蛭石体系中,平衡溶液的pH值呈现随吸附剂浓度增大而升高的趋势,在W等于20 g/L时,平衡溶液的pH值约低于起始溶液的值,在W等于50 g/L点上,平衡溶液与起始点的pH值差异很小,当W提高到100 g/L时,所有离子浓度点上平衡溶液的pH值均高于起始pH值,说明随吸附剂浓度增大,水洗蛭石体系吸附阳离子的能力增强,其在吸附Mn2+离子的同时,也吸附了水溶液中部分H+离子,导致平衡溶液的pH值增大。
在酸洗蛭石体系中,所有A0和W点上的平衡pH值均显著低于起始pH值,说明在吸附Mn2+离子的同时,固相中一定量的H+离子由于代换和解吸作用转移到液相,从而降低了液相pH值。在所有A0和W点上,酸洗蛭石平衡溶液的pH值显著低于水洗蛭石体系的值,说明酸洗蛭石带入吸附体系中的H+离子量远远多于水洗蛭石。与水洗蛭石体系平衡溶液pH的变化不同,酸洗蛭石平衡溶液pH的随吸附剂浓度增大变化的趋势不明显,说明在酸洗备样的过程中,蛭石表面大量的吸附位被H+离子占据[29],以至在低吸附剂浓度点上,酸洗样本对溶液pH的影响也很大。当溶液pH降低到一定程度时,液相与固相的H+离子所形成的平衡将抑制固相H+离子的进一步解吸,从而使溶液pH趋于稳定,抑制固相H+离子的解吸意味着降低吸附剂的阳离子吸附容量,因此也相应降低了液相Mn2+离子的吸附量。
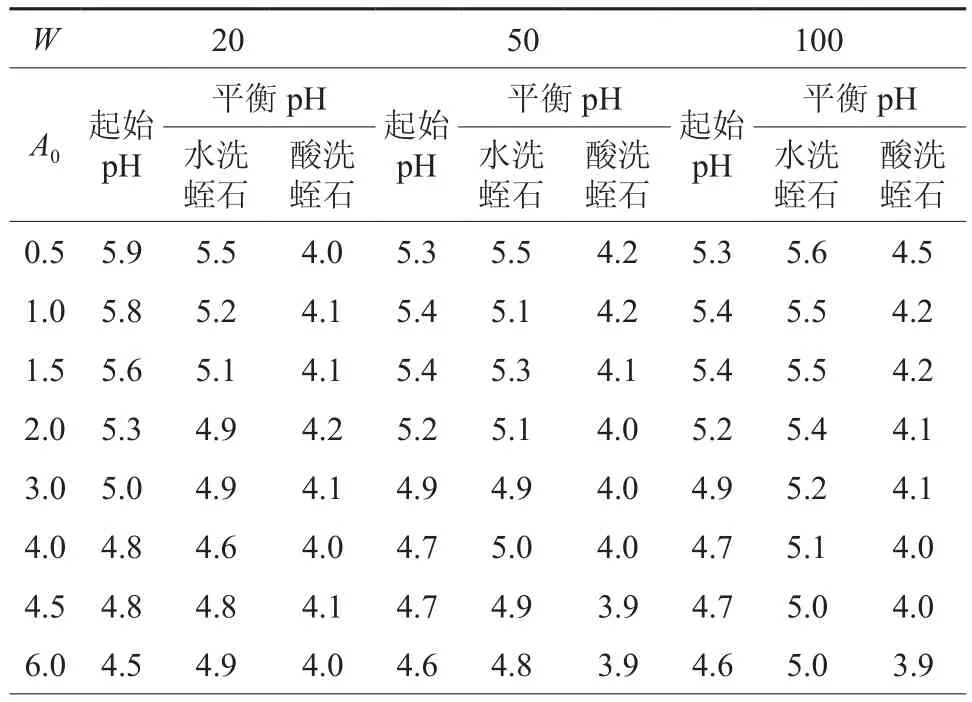
表1 吸附体系的pH变化(W:吸附剂浓度, g·L-1,A0:起始离子浓度, mmol·L-1 )Table 1 Change of pH in tested adsorption systems(adsorbent concentration W: g·L-1; initial Mn2+ ion concentration A0: mmol·L-1)
2.4 离子吸附去除率
表2给出不同初始离子和吸附剂浓度点上Mn2+的去除率值。试验结果表明,虽然在给定初始离子浓度点上,溶液中Mn2+的去除率呈现随吸附剂浓度增大而增大的趋势,但水洗蛭石样本的去除率显著高于酸洗蛭石样本。在实际应用时,除了基于水质要求选择合适的吸附剂浓度外,还应综合考虑处理成本。水洗蛭石的吸附性能好,备样的成本也低,可适用作为人工湿地基质填料。
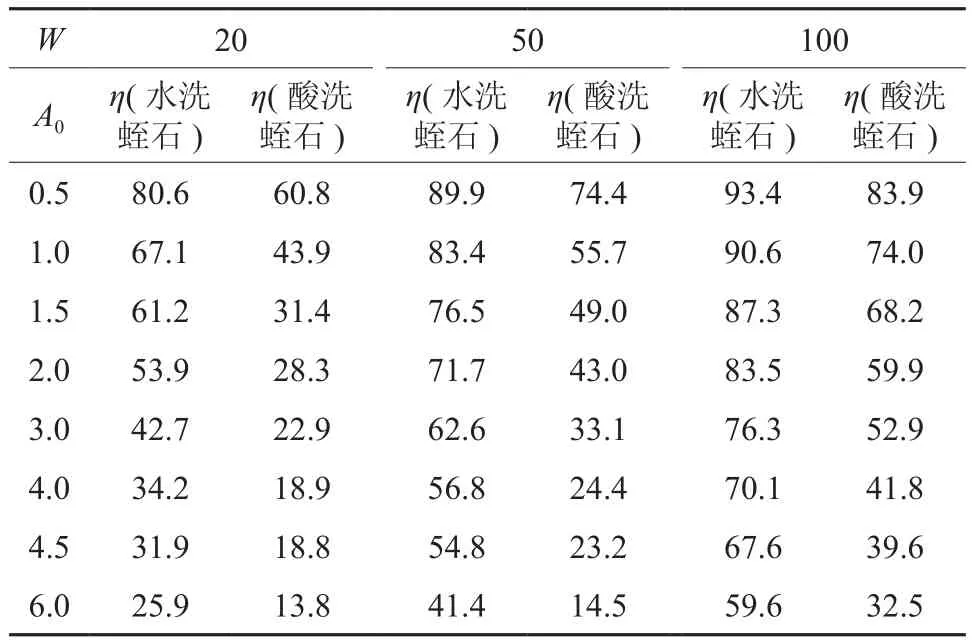
表2 吸附体系Mn2+去除率(η:去除率/%)Table 2 Removal rate of Mn2+ in adsorption systems (ion removal rate η: %)
3 结 论
(1)水洗和酸洗蛭石的Mn2+离子吸附体系存在明显的离子和吸附剂浓度效应,两体系中Mn2+离子的吸附密度随起始离子浓度增大而增大,随吸附剂浓度增大而降低。水洗蛭石样本的吸附量显著高于酸洗蛭石的值。
(2)酸洗过程导致蛭石表面大量的吸附位被H+离子占据,其不仅降低样本的阳离子吸附能力,并且在吸附过程中会解吸出H+离子,降低溶液pH值。因此,酸洗蛭石不宜作为湿地基质。
[1] 马纯照,林少华.凹凸棒石对水中Mn2+的吸附特性研究[J].广东化工,2010,37(12):99-100.
[2] Lee S M, Tiwari D, Choi K M,et al.Removal of Mn(II) from Aqueous Solutions Using Manganese-Coated Sand Samples[J].Journal of Chemical and Engineering Data, 2009, 54(6):1823-1828.
[3] Sharma Y C, Uma, Singh S N,et al.Fly ash for the removal of Mn(II) from aqueous solutions and wastewaters[J].Chemical Engineering Journal,2007,132(1-3):319-323.
[4] Tiwari D, Yu M R, Kim M N,et al. Potential application of manganesecoated sand in the removal of Mn(II) from aqueous solutions[J].Water Science and Technology, 2007,56(7):153-160.
[5] Kamal M, Ghaly A E, Mahmoud N,et al.Phytoaecumulation of heavy metals by aquatic plants[J].Environment International,2004,29(8):1029-1039.
[6] Cheng S P, Grosse W, Karrenbrock F,et al.Efficiency of constructed wetlands in decontamination of water polluted by heavy metals[J].Ecological Engineering,2002,18(3):317-325.
[7] Zayed A, Growthaman S, Terry N. Phytoaccumulation of trace elements by wetland plants: I. Duckweed[J].Journal of Environmental Quality,1998,27(3):715-721.
[8] Ye Z H, Whiting S N, Lin Z Q,et al.Removal and distribution of iron, manganese, cobalt, and nikel within Pennsylvania constructed wetland treating coal combustion by-product leachate[J]. Journal of Environmental Quality, 2001,30(4):1464-1473.
[9] 黄淦泉,杨昌凤,靳立军,等.人工湿地处理重金属Pb、Cd污水的机理探讨[J].应用生态学学报,1993,4(4):456-459.
[10] Xiaofu Wu.An Ion Adsorption Model Related to the Change in the Standard Chemical Potential of Adsorption Reactions[J].Adsorption Science & Technology, 2011,29(8):747-768.
[11] Wu Xiaofu, Zhao Fang, Chen Mingli,et al.A Simple Way of Calculating the Change in the Gibbs' Free Energy of Ion Adsorption Reactions[J].Adsorption Science & Technology,2009,27(1):1-17.
[12] Xiaofu Wu, Hailan Zhou, Fang Zhao,et al.Adsorption of Zn2+and Cd2+Ions on Vermiculite in Buffered and Unbuffered Aqueous Solutions[J].Adsorption Science & Technology,2009,27(10):907-919.
[13] 马 群,吴晓芙,赵 芳,等.4种矿物填料吸附锌、镉离子能力比较研究[J].中南林业科技大学学报,2009,29(2):6-11.
[14] Wu Xiaofu, Zhao Fang, Chen Mingli,et al.Factors Affecting the Adsorption of Zn2+and Cd2+Ions from Aqueous Solution onto Vermiculite[J].Adsorpiton Science & Technology, 2008,26(3):145-155.
[15] 赵 芳.蛭石-水溶液体系中锌、镉离子吸附特性与离子吸附理论[D].长沙:中南林业科技大学,2007.
[16] 李 晖,谭光群,李 瑞.蛭石对汞的吸附性能研究[J].重庆环境科学,2001,23(2):65-67.
[17] 谭光群,李 晖,彭同江.蛭石对重金属离子吸附作用的研究[J].四川大学学报(工程科学版),2001,33(3):58-61.
[18] 单宝田,张爱滨,胡立阁,等.沸石对重金属废水中Cu(NH3)2+的吸附性能研究[J].水处理技术,2002,28(4):207-209.
[19] 罗道成,易平贵,陈安国.改性沸石对电镀废水中Pb2+、Zn2+、Ni2+的吸附[J].材料保护,2002,35(7):41-43.
[20] 胡忠于,罗道成,易平贵,等.改性海泡石对电镀废水中Pb2+、Cu2+、Cd2+的吸附[J].材料保护,2002,35(5):45-53.
[21] 叶力佳,杜玉成.硅藻土对重金属离子Cu2+的吸附性能研究[J].矿冶,2005,14(3):69-74.
[22] 王玉洁,田莉玉,王丽荣,等.膨润土对重金属离子吸附的研究[J].非金属矿,2003,26(4):46-48.
[23] 吴宏海,刘佩红,张秋运,等.高岭石对重金属离子的吸附机理及其溶液的pH条件[J].高校地质学报,2005,11(1):85-91.
[24] M Fleischer, J A Mandarino.Glossary of Mineral Species 1991[M].Tuscon, AZ:The Mineralogical Record Inc.,1991.
[25] 周 平,刘 东.利用天然蛭石处理造纸黑液[J].环境科学研究,2001,14(3):37-39.
[26] G Xueyi, I Katsutoshi. Elution of copper from vermiculite with environmentally benign reagents[J]. Hydrometallurgy, 2003, 70:9-21.
[27] 赵 芳,吴晓芙,张艳丽,等.固液相离子吸附体系中吸附剂浓度效应与Langmuir方程的适用性[J].环境化学,2007,26(3):335-338.
[28] Voice T C,Weber W J.Sorbent Concentration Effects in Liquid/Solid Partitioning[J].J. Environ. Sci. Technol., 1985,19:789-796.
[29] Frini-Srasra N, Srasra E. Acid treatment of south Tunisian palygorskite:Removal of Cd(II) from aqueous and phosphoric acid solutions[J].Desalination, 2010,250(1):26-34.
Comparison of Mn2+ion adsorption between water and acid rinsed vermiculite samples
LIU Yi-lin, LI Yun, PENG Jin, YAO Yong-ge, CHEN Xing
(Institute of Environmental Science and Engineering, Central South University of Forestry & Technology, Changsha 410004, Hunan, China)
The experiments were conducted to analyze the characteristics of Mn2+ion adsorption in liquid /solid systems by using water and acid rinsed vermiculite samples as the sorbents. Signif i cant adsorbate and adsorbent effects were observed in the tested systems for both water and acid rinsed samples. The vermiculite samples rinsed by distilled water had much more higher Mn2+ion removal rate than the samples rinsed by diluted sulfuric acid. The adsorption capacity of vermiculite was lowered in the acid rinsing process due to occupation of large amounts of surface adsorption sites by H+ion. Acid rinsing not only caused an apparent reduction in Mn2+ion adsorption but also led to signif i cant decreases in solution pH. The results obtained from the present tests indicate that the acid rinsing was not a suitable measure for preparation of vermiculite samples to be used as fi llers in constructed wetlands.
ion adsorption; vermiculite; water rinsing; acid rinsing; Mn2+
S714.7
A
1673-923X(2012)12-0088-04
2012-06-13
国家环保部项目[200909066];国家科技部项目[2012BAC09B03-4];国家林业局项目[2010-43];湖南省教育厅重点学科与重点实验室项目
刘毅霖(1988-),男,湖南株洲人,硕士研究生,主要从事环境化学方面的研究;E-mail:autumnleaf@vip.qq.com
李 芸(1966-),女,湖南省长沙人,副教授,主要从事环境科学的教学与科研工作;E-mail:hnly5659@163.com
[本文编校:罗 列]
