紫花苜蓿转录因子MsDREB1基因表达产物的亚细胞定位
2012-01-04李嘉玮刘晓颖王振英
李嘉玮,刘晓颖,王振英
(a.天津师范大学 生命科学学院,天津300387;b.天津市细胞遗传与分子调控重点实验室,天津 300387)
紫花苜蓿转录因子MsDREB1基因表达产物的亚细胞定位
李嘉玮,刘晓颖,王振英
(a.天津师范大学 生命科学学院,天津300387;b.天津市细胞遗传与分子调控重点实验室,天津 300387)
利用生物信息学方法对紫花苜蓿MsDREB1进行了生物信息学分析.结果表明,该序列含有AP2典型结构域,在N端存在核定位信号.为进一步验证该基因功能,构建MsDREB1与绿色荧光蛋白(Green Fluorescent Protein,GFP)基因融合的植物表达载体pCAMBIA1302-MsDREB1,再利用基因枪将其转入洋葱表皮细胞,在共聚焦扫描显微镜下观察MsDREB1基因表达产物在洋葱表皮细胞中的亚细胞定位.结果表明,MsDREB1基因表达产物定位于细胞核中,符合DREB家族转录因子特性.
紫花苜蓿;MsDREB1基因;GFP表达载体;亚细胞定位
植物中存在许多转录因子,而脱水应答元件结合因子(Dehydration responsive element binding,DREB)在抵抗低温、高盐和干旱胁迫中发挥重要作用.典型的转录因子功能结构域包括以下4个部分:DNA结合域、转录调控域、寡聚化位点和核定位信号.其中核定位信号(Nuclear localization signal,NLS)是一段富含精氨酸残基的核定位区域,是保证转录因子顺利进入细胞核发挥调控作用的重要区段[1-3].目前已经在拟南芥、棉花、大豆、油菜等多种植物中证实DREB基因中核定位信号的存在.牛一丁等[4]在紫花苜蓿中克隆了MsDREB1,刘晓颖等[5]对低温处理后紫花苜蓿MsDREB1表达情况进行了研究分析,但对MsDREB1的核定位信息以及产物的亚细胞定位尚缺乏详细研究.该研究利用生物信息学方法,对MsDREB1的NLS进行分析,并且构建该基因与绿色荧光蛋白基因融合的植物表达载体,利用基因枪转化法将其转入洋葱表皮细胞,观察在活细胞状态下MsDREB1-GFP融合蛋白在细胞中的分布和定位,对MsDREB1的核定位信号进行研究,为进一步的基因功能研究奠定基础.
1 材料与方法
1.1 材料培养和主要试剂
将紫花苜蓿种子消毒,点种于培养土(草碳土的体积分数为50%,蛭石的体积分数为25%,珍珠岩的体积分数为25%)中,置于培养室,生长温度23℃ ,光照/黑暗=16h/8h,培养20d后,4℃低温处理2h备用.
质粒pCAMBIA1302、大肠杆菌DH5α为本实验室保存.抗生素购自上海生工公司,引物的合成及DNA序列测定均由华大基因公司完成.各种限制性内切酶、DNA连接酶、反转录试剂盒以及RNAiso Plus试剂盒均为宝生物(大连)工程有限公司产品.凝胶回收试剂盒购自Axygen公司.
1.2 第一链cDNA的合成
按RNAiso Plus试剂盒说明书的步骤提取紫花苜蓿叶片的总RNA,经(质量分数,下同)1.0%琼脂糖凝胶电泳和A260/A280比值鉴定RNA的质量,-80℃保存备用.利用AMV逆转录酶进行反转录,体系为:总 RNA 2μg,Oligod(T)18(10 μmol/L)5μL,2.5mmol/L dNTP 2μL,5×AMV Buffer 4μL,RNase inhibitor 0.5μL,AMV 2μL,补充DEPC水至20μL.将上述溶液混匀后,26℃ 保持10min,42℃ 保持60min,冰浴2 min.
1.3 MsDREB1基因的克隆及序列分析
根据紫花苜蓿转录因子MsDREB1(GenBank No.EU233782)的cDNA 序列,以及 pCAMBIA1302载体上的酶切位点设计一对特异引物:MsDREB1-F:5’-CATGCCATGGTAATGATTAATACCA-3(斜体下划线部分为NcoⅠ酶切位点);MsDREB1-R:5’-GGACTAGTAAAGTTCCATAGTGATA-3’(斜体下划线部分为SpeⅠ酶切位点).PCR扩增体系以cDNA为模板,F、R引物各100ng,200μmol/L dNTPs,2.5UTaq酶,总体系50μL.PCR扩增程序为:94℃预变性2min;94℃1min,55℃30s,72℃1min,35个循环;72℃延伸5min.经1.0%的琼脂糖凝胶电泳检测后,将目的片段回收、克隆、测序.
测序结果在NCBI/GenBank/Blast进行比对分析,同时在http://cubic.bioc.columbia.edu/predictNLS对核定位区域进行预测.
1.4 重组表达载体的构建
利用NcoⅠ/SpeⅠ分别双酶切pGEM-T-Ms-DREB1和质粒载体pCAMBIA1302质粒,将目的片段与表达载体分别回收,用T4连接酶连接,获融合表达载体pCAMBIA1302-MsDREB1.将重组质粒转化大肠杆菌DH5α,以卡那霉素筛选阳性克隆,然后对其进行PCR(引物为MsDREB1-F及MsDREB1-R)和双酶切(NcoⅠ/SpeⅠ)鉴定,选取阳性克隆子,用于重组质粒的扩增,提取重组质粒,-80℃储存备用.
1.5 重组质粒pCAMBIA1302-MsDREB1转化洋葱内表皮细胞
切取约2cm×2cm的洋葱表皮组织置于固体1/2MS平板培养基上,28℃弱光下预培养12h.将构建好的表达载体pCAMBIA1302-MsDREB1包裹金粉,在无菌条件下,利用基因枪(Bio-rad,PDS1000)转化洋葱内表皮细胞,具体方法参照仪器使用说明.转化后材料置28℃弱光下培养12h,同时转化pCAMBIA1302空载体作为阴性对照.
1.6 MsDREB1基因表达产物的亚细胞定位观察
将培养后的洋葱表皮制片,利用共聚焦扫描显微镜(NIKON ECLIPSE 90i)在488nm波长激发下,观察MsDREB1-GFP融合蛋白在细胞中的分布和定位,同时拍摄明场图像作为对照.
2 结果与分析
2.1 MsDREB1基因的克隆及序列分析
以含有MsDREB1的全长序列的cDNA为模板进行PCR扩增,获得与预期目标基因大小一致的片段,见图1.
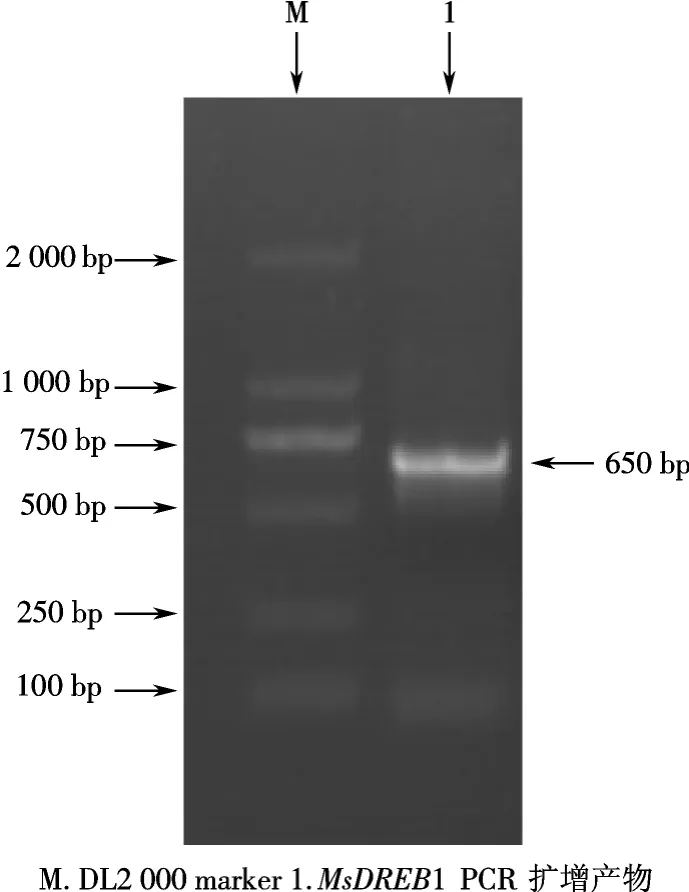
图1 MsDREB1PCR扩增结果Fig.1 PCR amplification of MsDREB1
用Axygen凝胶回收试剂盒回收目的片段,并连接到pGEM-T easy vector上,构建重组质粒pGEM-T-MsDREB1,转化大肠杆菌 DH5α,阳性克隆测序后,目的片段全长为651bp.在NCBI/GenBank/Blast比对发现,该序列与牛一丁等[4]报道的MsDREB1序列一致.将得到的核苷酸序列转化成氨基酸序列,在http://cubic.bioc.columbia.edu/predictNLS上进行核定位信号分析后发现,在第37~52氨基酸位置存在可能的核定位信号PKKRAGRKIFKETRHP.
2.2 紫花苜蓿MsDREB1基因表达载体的构建
将质粒 pGEM-T-MsDREB1经NcoⅠ/SpeⅠ双酶切后,获得目的基因,将目的基因插入同样经NcoⅠ/SpeⅠ双酶切的pCAMBIA1302载体中,并对获得的重组质粒pCAMBIA1302-MsDREB1进行PCR和双酶切鉴定(图2),PCR产物以及双酶切产物经过1%琼脂糖凝胶检测,均有一约650bp的片段,与插入的目的基因大小一致,证明载体构建成功.
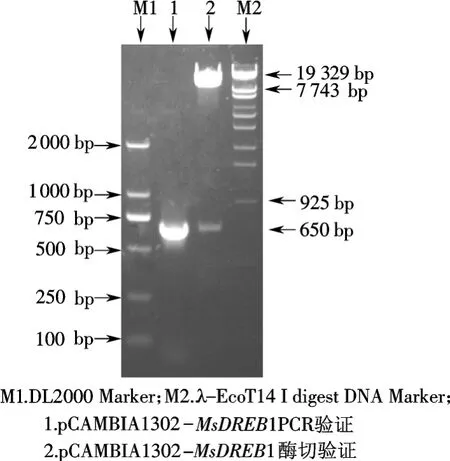
图2 质粒经NcoI和SpeI双酶切及PCR验证电泳结果Fig.2 Results of plasmids digestion and PCR
2.3 MsDREB1基因表达产物的亚细胞定位
利用基因枪轰击洋葱内表皮细胞后,使用共聚焦显微镜在488nm波长下观察GFP在洋葱表皮细胞中的表达情况.结果发现,阴性对照载体在洋葱表皮细胞内没有具体的定位,绿色荧光分布于整个细胞;而转化重组质粒的洋葱内表皮细胞核内,绿色荧光强度明显高于阴性对照组,表明MsDREB1编码的蛋白已定位在细胞核中,说明MsDREB1具有DREB转录因子家族共有的核定位特性(图3).
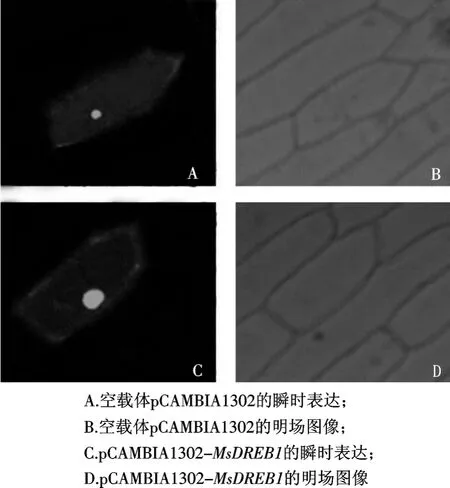
图3 MsDREB1-GFP融合蛋白在洋葱表皮细胞中的核定位Fig.3 Nuclear localization of the MsDREB1-GFP fusion protein in onion skin cells
3 讨论
DREB类转录因子作为干旱、低温和高盐等非生物逆境胁迫的主要应答因子,在植物抗逆性综合改良方面起着重要作用.DREB隶属于AP2/EREBP家族,它含有一个AP2结构域,通过与DRE/CRT顺式作用元件结合,调控大量非生物胁迫相关基因表达,例如rd29A、cor15A、Kin1等[6-7].这些产物的综合作用可以提高植物对干旱、低温、高盐的抗逆性[1].DREB作为一种转录因子,可以结合下游目的基因的DRE(dehydration responsive element)顺式作用元件,该过程发生在细胞核内,在下游基因的转录过程中发生,因此DREB蛋白必定有一个核定位区域,将该蛋白定位至细胞核内用来发挥转录因子的作用.
通过对MsDREB1基因cDNA序列进行比对分析,在http://cubic.bioc.columbia.edu/predictNLS上可以预测编码蛋白的核定位信号NLS在其AP2结构域上游,具有一定的保守性.该研究根据载体设计合适的酶切位点,将目的基因插入到pCAMBIA1302的35S启动子和报告基因GFP之间,同时保证GFP的编码区不发生移位,以此构建出能够在植物体内表达MsDREB1-GFP融合蛋白的重组载体.利用基因枪将重组质粒导入洋葱表皮细胞,对MsDREB1-GFP融合蛋白进行亚细胞定位,成功地将该蛋白质定位于细胞核中,由图3C、D可以看出该蛋白质在细胞核中大量存在,这一结果与Agarwal等[2]所报道的DREB转录因子特性一致.由此可以推断MsDREB1基因编码的蛋白在胞质内转录翻译后转运到细胞核内,与DRE顺式作用元件结合,启动一系列功能基因的表达.该研究中成功构建的植物表达载体pCAMBIA1302-Ms-DREB1,可通过转化农杆菌,侵染拟南芥等,将MsDREB1-GFP融合蛋白转入植物细胞内,为该基因在农业生产上抗逆作物转基因研究打下基础.
[1] LIU Q,ZHAO N M,YAMAGUCH-SHINOZAKI K,et al.Regulatory role of DREB transcription factors in plant drought,salt and cold tolerance[J].Chinese Science Bulletin,2000,6:970-975.
[2] AGARWAL P K,AGARWAL P,REDDY M K,et al.Role of DREB transcription factors in abiotic and biotic stress toler-ance in plants[J].Plant Cell Rep,2006,25:1263-1274.
[3] IMAGAWA M,SAKAUE R,TANABE A,et al.Two nuclear localization signals are required for nuclear transcription of nuclear factor 1-A[J].FEBS Lett,2000,484(2):118-124.
[4] 牛一丁,哈斯阿古拉,张丽,等.紫花苜蓿逆境胁迫诱导相关转录因子MsDREB1基因克隆与分析[J].植物生理学通讯,2008,6:454-458.
[5] 刘晓颖,潘丽娜,李嘉玮,等.荧光实时定量PCR检测紫花苜蓿DREB基因的方法[J].天津师范大学学报:自然科学版,2010,30(4):68-70.
[6] LIU Q,KASUGA M,SAKUMA Y,et al.Two transcription factors,DREB1and DREB2,with an EREBP/AP2DNA-binding domain separate two cellular signal transduction pathways in drought and low-temperature-responsive gene expression in Arabidopsis[J].Plant Cell,1998,10:1391-1406.
[7] SAKUMA Y,MARUYAMA K,OSAKABE Y,et al.Functional analysis of an Arabidopsis transcription factor,DREB2 A,involved in drought-responsive gene expression[J].Plant Cell,2006,18:1292-1309.
Subcellular localization ofMsDREB1gene in alfalfa
LIJia-wei,LIUXiao-ying,WANGZhen-ying
(a.College of Life Science,Tianjin Normal University,Tianjin 300387,China;
b.Tianjin Key Laboratory of Cyto-Genetical and Molecular Regulation,Tianjin 300387,China)
Bioinformatics analysis shows thatMsDREB1gene in alfalfa contains AP2/EREBP DNA domain,and has nuclear localization signal in the N-terminal.In order to further verify the function of this gene,aplant expression vector pCAMBIA1302--MsDREB1with a green fluorescent protein (GFP)gene has been constructed and then transformed into onion skin cells by gene gun method.The result of transient expression which was showed in the confocal scanning microscope indicated that theMsDREB1gene products was located in the nucleus which is in line with the characteristics of DREB transcription factor family.
alfalfa(MedicagosativaL.);MsDREB1gene;GFP plant expression vector;subcellular localization
Q78
A
1671-1114(2012)01-0085-03
2011-05-30
天津市科委重点资助项目(11ZCKFNC00700);天津师范大学市级重点实验室开放研究基金资助项目,天津师范大学实验室改革研究基金资助项目(B200912)
李嘉玮(1986—),女,硕士研究生.
王振英(1966—),女,教授,博士,主要从事植物抗性分子生物学方面的研究.
(责任编校 纪翠荣)
