象山港海洋病毒时空分布特征及其环境影响因素
2011-12-20王海丽杨季芳屠霄霞陈吉刚冯辉强浙江万里学院生物与环境学院宁波市微生物与环境工程重点实验室浙江宁波3500宁波市象山港海洋环境监测站浙江宁波354
王海丽,杨季芳*屠霄霞,陈吉刚,冯辉强 (.浙江万里学院生物与环境学院,宁波市微生物与环境工程重点实验室,浙江 宁波 3500;.宁波市象山港海洋环境监测站,浙江 宁波 354)
象山港海洋病毒时空分布特征及其环境影响因素
王海丽1,杨季芳1*屠霄霞1,陈吉刚1,冯辉强2(1.浙江万里学院生物与环境学院,宁波市微生物与环境工程重点实验室,浙江 宁波 315100;2.宁波市象山港海洋环境监测站,浙江 宁波 315141)
分别于2007年的7月(夏季)、11月(秋季)与2008年的1月(冬季)、4月(春季)采集样品,研究了象山港海域的水样(表层海水和上覆水)中的浮游病毒及沉积物中的底层病毒丰度的时空分布特征,并采用主成分分析及多元逐步回归分析方法研究了影响浮游病毒丰度时空分布的主要因素,结果表明,调查期间象山港海域表层海水、上覆水及沉积物样品中浮游(底层)病毒丰度实测值的变化范围为6.48×104~1.01×108cells/mL,均值分别为1.55×107,1.03×108,1.13×108cells/mL.季节分布特征为秋季 > 夏季 > 春季 > 冬季.病毒丰度垂直分布表现为上覆水均大于表层海水;平面分布均为从港底到港口递减、养殖区高于非养殖区、电厂附近海域出现较高值的趋势.近岸人类活动的陆源污染及水产养殖污染是造成此空间分布特征的主要原因.溶解氧、水温及叶绿素a是制约表层海水浮游病毒丰度的主要影响因素;营养盐含量及浮游细菌丰度是制约上覆水中浮游病毒丰度的主要影响因素,沉积物中的病毒丰度与细菌丰度具有显著正相关性(P < 0.01).
象山港;海洋病毒;丰度;时空分布;环境因素
海洋病毒是水体中最丰富的生物(数量达1010个/L),能够引起大量的浮游细菌和浮游植物的死亡[1-10].由于病毒的作用,改变了海洋微食物环的物质循环和能量流动,影响到生物地球化学循环[1-5,11-13].此外,病毒还具有重要的生态学作用,可在遗传水平上影响宿主及整个生态系统的物种多样性[6-7].单位水体积中病毒的数量称为病毒丰度.季节、温度、营养水平、水流、海拔、盐度、浮游植物和浮游细菌等都对浮游病毒的分布产生影响[11].浮游病毒的丰度会随着水华的暴发而显著增加,由此推测浮游病毒既是浮游藻类的重要致死因子,也是水华生物量的控制因子[14].因此开展重点海域浮游(底层)病毒丰度、分布及多样性等方面的生态调查,对于大时空系统的海洋生物量的预测、赤潮的防治、以及深层次了解该海域的生物地球化学过程等均具有重要意义
[15].本课题组对象山港海域的海洋病毒丰度的时空分布特征进行调查,并选取同期测定的该调查海区的理化环境因子与生物环境因子进行主成分分析和多元线性逐步回归分析,确定影响该海域浮游(底层)病毒丰度时空分布的主要因素,为象山港海洋环境保护和修复提供基础数据资料.
1 材料与方法
1.1 研究区简介及站位设置
象山港位于浙江省宁波市东部,沿西南方向楔入内陆,是一个半封闭式狭长型港湾,海域总面积 563km2,其中海域面积 392km2,滩涂面积171km2,岸线总长 270km(其中深水岸线 28km),有 500m2以上岛屿 59个.港内水深一般为10~20m,中部的湖头渡至大对山段水深达50米.港湾内发育有西沪港、黄墩港、铁港三大支港,总面积达146km2.象山港是浙江省乃至全国重要的海水增养殖基地和多种经济鱼类洄游、索饵与繁育场所以及菲律宾蛤仔等经济性贝类苗种自然产区.随着经济的迅猛发展,对象山港的开发力度也不断加大,由此造成的环境问题也逐渐引起了人们的重视,但是相关研究主要针对于象山港理化因子以及浮游植物、浮游(底栖)动物等方面
[16-18],而作为海洋微食物环重要成员之一的病毒尚未开展系统研究.在象山港布设13个大面站点,其分布兼顾港口、港中、港底部,兼顾主水道和3个支港,见图1.站位定点采用Garmin公司生产的GPS12型全球卫星定位系统.
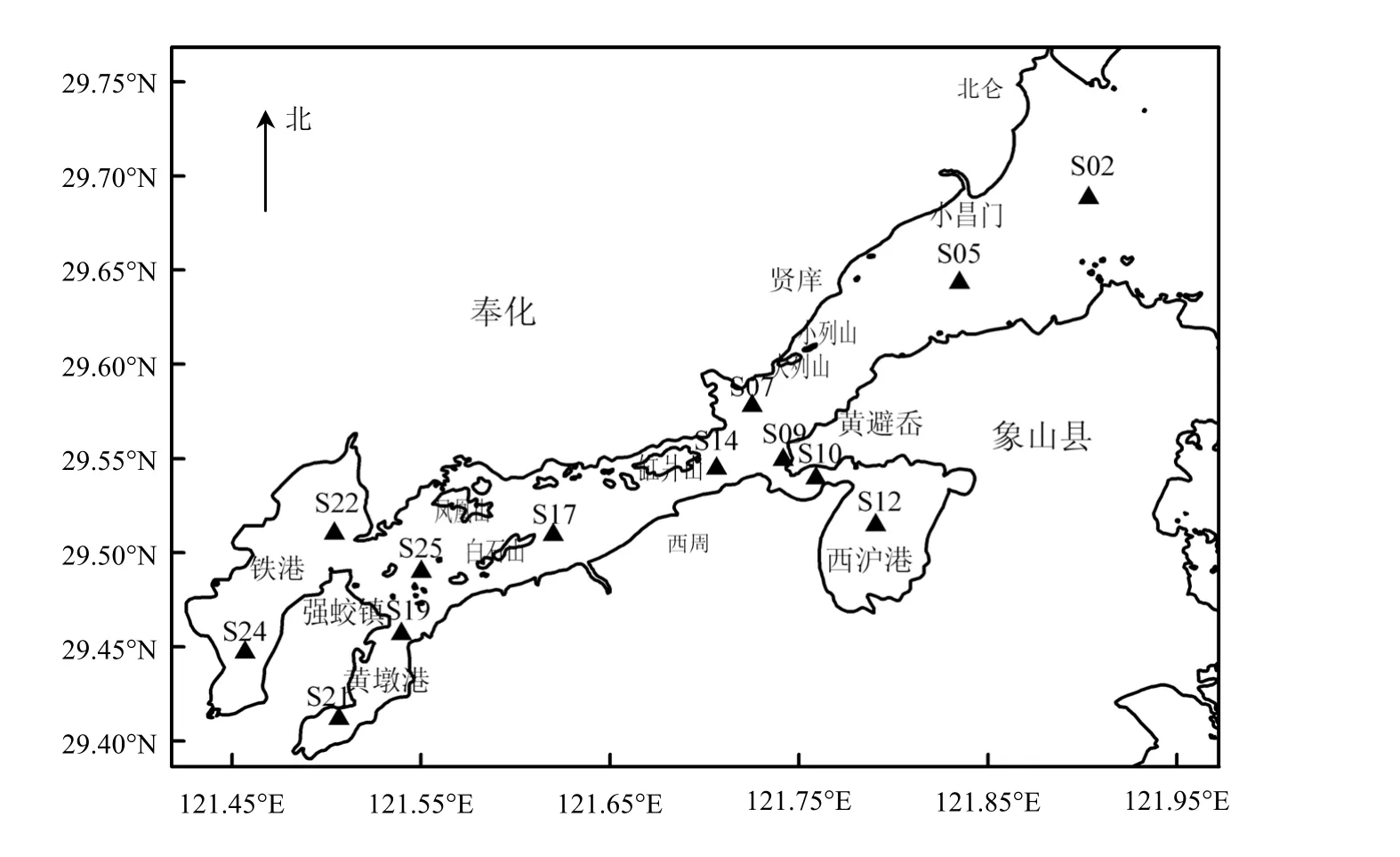
图1 监测站位示意Fig.1 Map of station
1.2 样品的采集及分析方法
调查时间为2007年的7月 (夏季)、11月(秋季)以及2008年的1月(冬季)、4月(春季).每次调查均位于小潮涨平潮.采用重力无扰动柱状采样器采集沉积物,无菌收集沉积物界面上方 5cm深的上覆水及表层1cm深的泥样作为供试样本.采用有机玻璃采水器采集表层海水(离水面0.5m左右的)样品.样品采集后立即加入浓度为 5%的甲醛,混匀固定15min后,放入液氮中快速冷冻保存.带回实验室后,转移至-80℃超低温保存,1周内进行病毒计数.预试验发现该水域大部分站点的水体及沉积物中病毒颗粒浓度较高(>108cells/mL),考虑到价格及操作的简便性,病毒计数采用文献[19]的方法并稍做修改,具体操作如下:稀释水样用 0.45um的滤膜过滤后,取10mL加入 millipore抽滤装置的滤杯中,用孔径为0.02μm的氧化铝膜(Whatman)滤干后,再向滤器内加入1mL 5μg/mL 的DAPI染液,挡光染色8min后抽滤,再次滤干后,取出滤膜制片,在1000倍荧光显微镜(Olympus BX51)下观察并拍照计数(拍照面积为定值).按照以下公式进行病毒计数:每 mL水样浮游病毒总数=拍照面积浮游病毒总数×滤膜有效滤过面积/(拍照面积×加样体积).沉积物样品处理参照 Helton等[20]方法:取2mL表面泥样加入装有 8mL的 10mmol/L H2Na2O7P2(含5mmol/L EDTA)缓冲液(用0.02µm滤膜过滤)的灭菌离心管中,涡旋混匀 20min 后,于2000×g、离心25min,去除较大的颗粒,剩余沉积物悬液用于病毒计数. 计数方法同水样. 通过测定沉积物悬液中病毒丰度换算成每 mL湿泥悬液样品底层病毒丰度.
采用Tomohiro方法同时计数样品中的浮游(底层)细菌数量[19],参照海洋调查规范进行可培养异养细菌数量的测定.
表层海水的水温(ST)、盐度(SS)、pH值、溶解氧(DO)、叶绿素a含量(Chla)、硝酸态氮浓度(NO3
--N)、亚硝态氮浓度(NO2--N)、氨氮(NH4+-N)、无机氮(DIN)、无机磷(DIP)、化学需氧量(COD)等 11个环境指标以及沉积物中的有机碳、总磷(TP)、硫化物、石油类、粪大肠菌群等5个环境指标由项目参加单位——宁波市象山港海洋环境监测站同期测定提供.上覆水的氨氮(NH4+-N)、总氮(TN)、总磷(TP)、活性磷酸盐(PO-P)等4个环境指标由作者单位完成,标准溶液购自国家海洋局第二海洋研究所.
样品的采集及分析均按照海洋监测规范GB1273.6-1991[21]有关要求进行.
1.3 数据处理
病毒所有数据均为实测数据.等值线的绘制采用 sufur8.0软件.对以上可能影响病毒丰度的表层海水的11个环境因子及表层海水的浮游细菌总数(TPB)、异养细菌总数(THB)2个生物因子,采用SPSS for Windows 11.5(USA, SPSS Inc.) 软件进行主成分分析因子分析(PCA),同时采用多元逐步回归分析方法,以主成分得分为解释变量,研究环境因子对浮游病毒丰度的影响.以筛选出影响该海区浮游(底层)病毒丰度的重要环境因子.同时采用sufur软件对上覆水中的底层病毒数量与上覆水的 5个理化环境因子以及浮游细菌总数(TPB)、异养细菌总数(THB)2个生物因子进行相关性分析,对沉积物中的的底层病毒数量与7个环境因子(上述沉积物的 5环境因子,另加沉积物的细菌总数、异养细菌总数2个生物因子)进行相关性分析.
2 结果与分析
2.1 象山港海域水体及沉积物中的病毒丰度总体分布
由调查结果可知,2007~2008年度表层海水样品浮游病毒丰度实测值变化范围为 3.21× 105~6.05×107cells/mL,均值为 1.55×107cells/mL;上覆水样品中浮游病毒丰度实测值的变化范围为 3.80×105~5.05×108cells/mL,均值为 1.03× 108cells/mL;沉积物样品中底层病毒丰度实测值的变化范围为 1.39×106~1.21×109cells/mL,均值为1.13×108cells/mL.上覆水及沉积物中病毒丰度极显著高于表层海水(P < 0.01).
2.2 时空分布
2.2.1 季节分布 以同季节所有站点的同类型的样品海洋病毒调查结果作为一个处理,经数据处理软件分析可知:调查海区海洋病毒丰度的季节变化差异极为显著(P<0.000),如表1所示.表层海水、上覆水及沉积物中病毒丰度的季节分布特征类似,秋季极显著高于夏季、春季(P<0.000),冬季最低(P<0.000),夏季、春季差异不显著(P> 0.05).2007年7、8月份象山港海域发生的大面积赤潮,秋季赤潮消退后的水华是造成秋季病毒丰度极显著高于其他季节的主要原因.
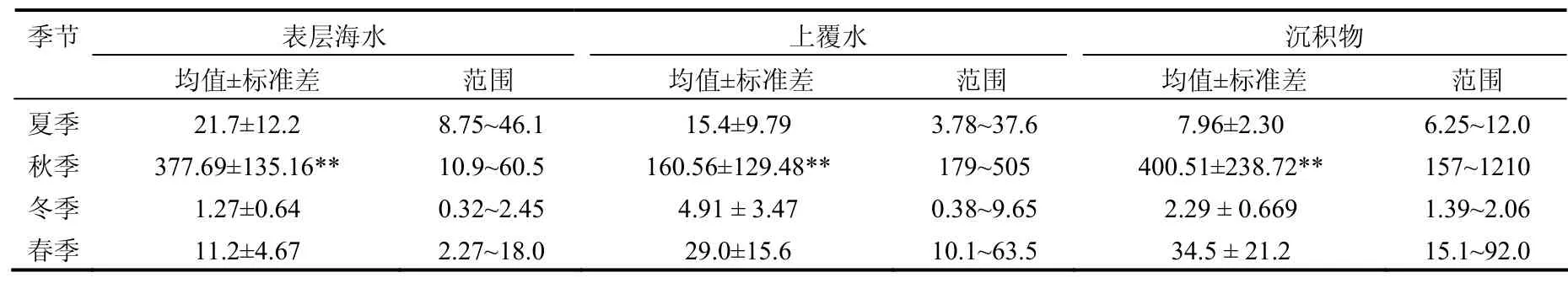
表1 象山港海域水体及沉积物中的病毒丰度(×106cells/mL)Table 1 Virus counts in water and sediment from Xiangshan Bay during investigation (×106cells/mL)
2.2.2 空间分布 不同类型样品中病毒丰度的平面分布情况如图2、3、4所示.表层海水(图2):夏季(图2a)表层海水中浮游病毒丰度在铁港、黄墩港底等值线较密集,浮游病毒丰度较高,越靠近港底浮游病毒丰度越高,次之为大小列山及黄避岙附近的象山港中部海域高值区,以高值区为中心向周边浮游病毒逐渐降低,港口区等值线稀疏,浮游病毒丰度较低;秋季(图 2b)仅在大小列山、及黄避岙附近的象山港中部海域明显高值区,以此为中心浮游病毒丰度向周边逐渐降低,次之为西沪港内表层海水浮游病毒丰度,港口处的浮游病毒丰度也较高,西沪港较高的病毒丰度与2007年夏季赤潮发生后的水华有关;冬季(图2c)铁港、黄墩港与与主港交汇处(国华电厂附近)各有一低值区,越靠近港底表层海水中浮游病毒丰度越高,同样在大小列山、及黄避岙附近的象山港中部海域明显高值区,以此为中心浮游病毒丰度向周边逐渐降低;春季(图 2d)表层海水浮游病毒表现特征与冬季类似.
上覆水(图3):夏季(图3a)上覆水中浮游病毒丰度在铁港、黄墩港底等值线较密集,浮游病毒丰度较高,越靠近港底浮游病毒丰度越高,次之为大小列山、及黄避岙附近的象山港中部海域高值区,以高值区为中心向周边浮游病毒逐渐降低,港口区等值线稀疏,浮游病毒丰度较低;秋季(图3b)上覆水中浮游病毒丰度在铁港、黄墩港与主港交汇处等值线密集,越靠近港底上覆水浮游病毒丰度越高,西沪港内以及整个象山港中部海域浮游病毒丰度均较高,在大嵩江及小昌门附近上覆水中浮游病毒丰度有一个低值区,以此为中心向周边逐渐增加.冬季(图3c)上覆水中浮游病毒丰度同样在铁港及黄墩港港底形成高值区,越靠近港底,浮游病毒丰度越高,另外从白石山附近的象山港中部一直到港口海区,上覆水中浮游病毒丰度呈现由西北岸线向东南岸线方向降低的趋势;春季(图 3d)上覆水浮游病毒丰度在铁港与主港交汇处的宁海强蛟国华电厂附近的海区形成密集的等值线高值区,以此为中心向周边逐渐降低,由港底到港口等值线由密到疏.
沉积物(图4):夏季(图4a)象山港表层沉积物中底层病毒丰度在3个支港——铁港、黄墩港及西沪港密集等值线,底层病毒丰度越靠近3个支港的港底越高,象山港中部及港口海区等值线稀疏,病毒丰度相对较低;秋季(图 4b)象山港表层沉积物中底层病毒丰度黄避岙海岸线附近形成明显高值区,以此为中心向周边逐渐降低;冬季(图 4c)表层沉积物中底层病毒丰度在西沪港港底以及西沪港汇入主港位置奉化小狮子口港口附近的海区等值线密集,出现明显高值区,以此为中心向周边逐渐降低;春季(图 4d)在靠近大列山的南部海域出现非常明显的高值区,以此为中心向周边逐渐降低,且在铁港港底也有一次高值区.
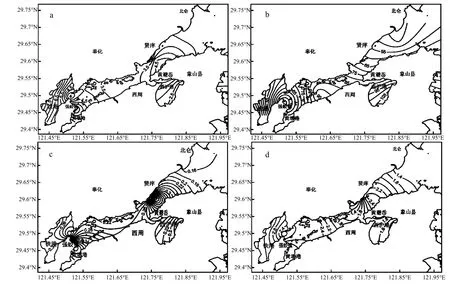
图2 表层海水中浮游病毒丰度的平面分布Fig.2 Distribution of virioplankton in surface seawater in the horizontal direction
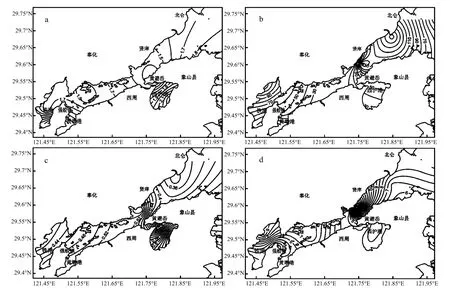
图3 上覆水中浮游病毒丰度的平面分布Fig.3 Distribution of virioplankton in the overlying water
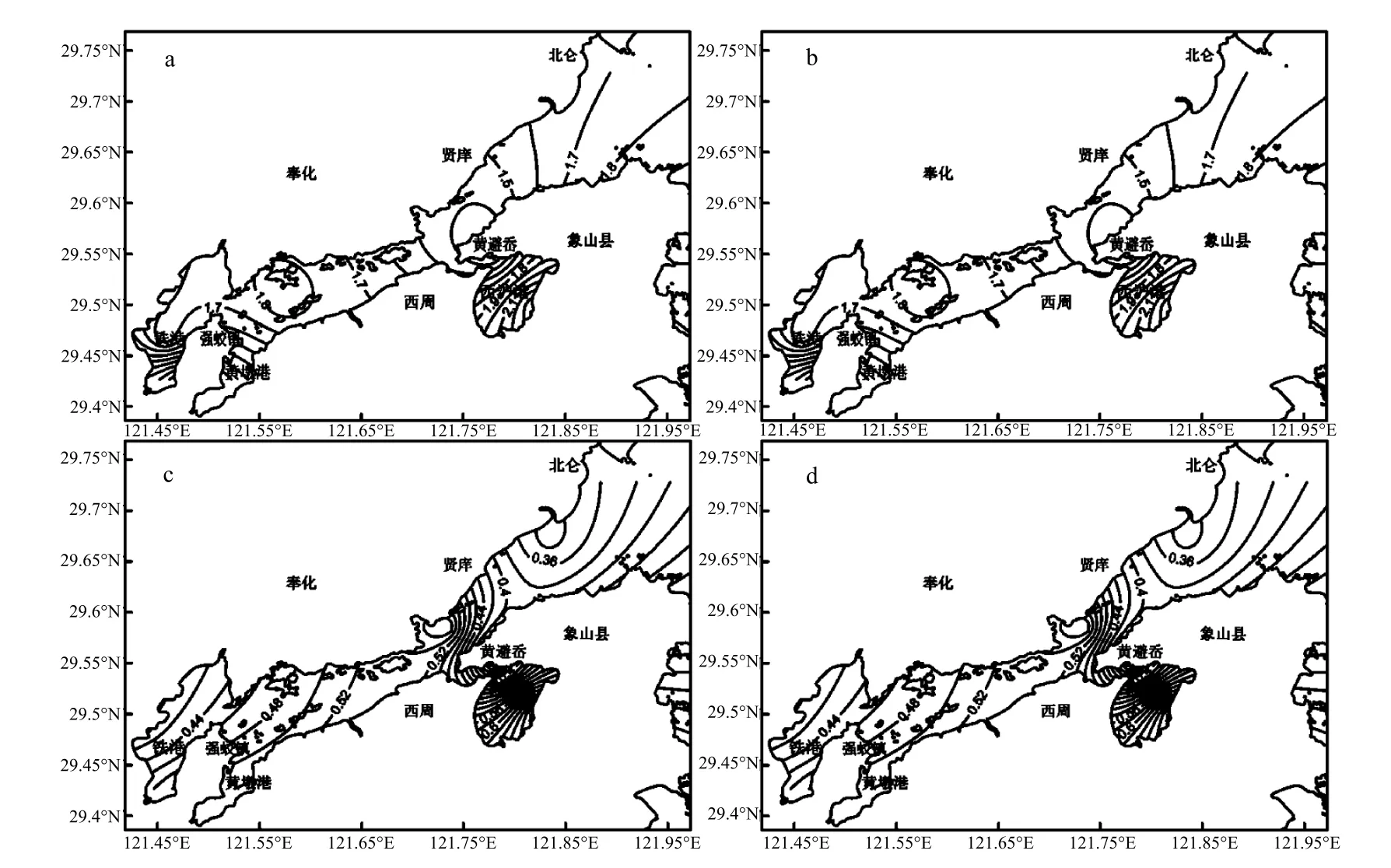
图4 沉积物中病毒丰度的平面分布Fig.4 Distribution of viriobenthos in the sediment
综合以上,调查期间象山港海域表层海水、上覆水及沉积物中病毒丰度的平面分布特征在不同季节表现不同,除夏季、冬季的沉积物样品外,其余季节的所有样品中病毒丰度均表现为港口低于港底的特征;秋季水华对浮游病毒丰度的影响在表层海水中表现尤为明显,发生水华的区域 (如西沪港及大、小列山至白石山连线的象山港中部) 浮游病毒丰度出现高值;此外,表层海水中浮游病毒丰度在铁港、铁港与主港交汇处 (强蛟国华电厂附近)及大、小列山附近海域相对较高;而上覆水及沉积物中病毒丰度在秋、春季类似,主要在及大、小列山附近海域出现高值区,而夏季、冬季的病毒丰度主要在西沪港及象山港中部出现高值区.
2.3 病毒丰度与环境因子的相关性
调查期间象山港海域表层海水及上覆水中的理化因子监测结果如表2所示.
表3为方差极大旋转(varimax rotation)后提取出的表层海水7个主成分的因子载荷量及各因子与主成分的相关性.表层海水的 13个环境因子中提取出 7个主成分(PCA),对方差的累积贡献率可达到 94.45%,能比较全面的反映原来13个环境因子的所有信息.其中,第1、2、3、4个主成分(PCA1、PCA2、PCA3、PCA4)的方差贡献率较高,在 14.735%-19.798%.从各因子的载荷矩阵可以看出,NO3--N、DIN、SS在第 1主成分(PCA1)上有较高载荷,其相关系数均高于 0.6,其中 NO3--N 的相关系数最高 0.947, NO3
--N、DIN均超过了0.9;NO2--N、COD、Chla在第2主成分(PCA2)上有较高载荷,其相关系数均高于0.75;DO、ST、Chla在第3主成分(PCA3)上有较高载荷(0.905、0.786、0.535),DO高达0.905; NH4+-N、pH值在第4主成分(PCA4)上有较高载荷(0.891、0.861);THB(异养细菌总数)在第5主成分(PCA5)上有较高载荷(0.938);DIP在第 6主成分(PCA6)上有较高载荷(0.836); TPB(浮游细菌总数)在第 7主成分(PCA7)上有较高载荷(0.872).
象山港表层海水浮游病毒丰度(log10)与主成分 PCAs得分进行多元逐步回归分析,结果见表4.经逐步回归筛选后有1个主成分PCA3进入回归模型,且两者线性关系极显著(P < 0.000).回归方程为TVA(表层海水浮游病毒丰度) = 6.224 + 0.445PCA3 (P<0.000),回归方程中浮游病毒丰度的实际结果需做10的 对数转换进行复原,该模型决定系数 0.625.通过以上回归方程以及PCA3的环境因子载荷量(DO,-0.905; ST, 0.786; Chla, 0.535)分析表明:调查期间象山港海域表层海水中TVA与PCA3呈极显著正相关,DO、ST、Chla是影响象山港海域表层海水中浮游病毒(TVA)的主要因素,TVA与DO极显著负相关,与水温及叶绿素a极显著正相关.
采用SPSS软件对上覆水浮游病毒丰度与环境因子进行相关性分析可知,上覆水中浮游病毒丰度与上覆水的活性磷酸盐浓度呈显著正相关(P<0.05, R = 0.425);与亚硝态氮浓度呈极显著正相关(P<0.001, R =0.634);与上覆水的浮游细菌数量呈极显著正相关(P < 0.001, R = 0.491).
沉积物中的病毒丰度与沉积物的总磷含量呈显著正相关(P<0.05, R = 0.321),与沉积物中的底层细菌数量呈极显著正相关(P<0.001, R = 0.503).
综合以上,调查期间表层海水的DO、水温及叶绿素a是影响象山港海域表层海水浮游病毒丰度的主要影响因素;上覆水的营养盐含量(NO2--N、PO43--P)及浮游细菌丰度是影响上覆水中浮游病毒丰度的主要因素;沉积物中的底层细菌丰度是沉积物中病毒丰度的重要影响因素之一.
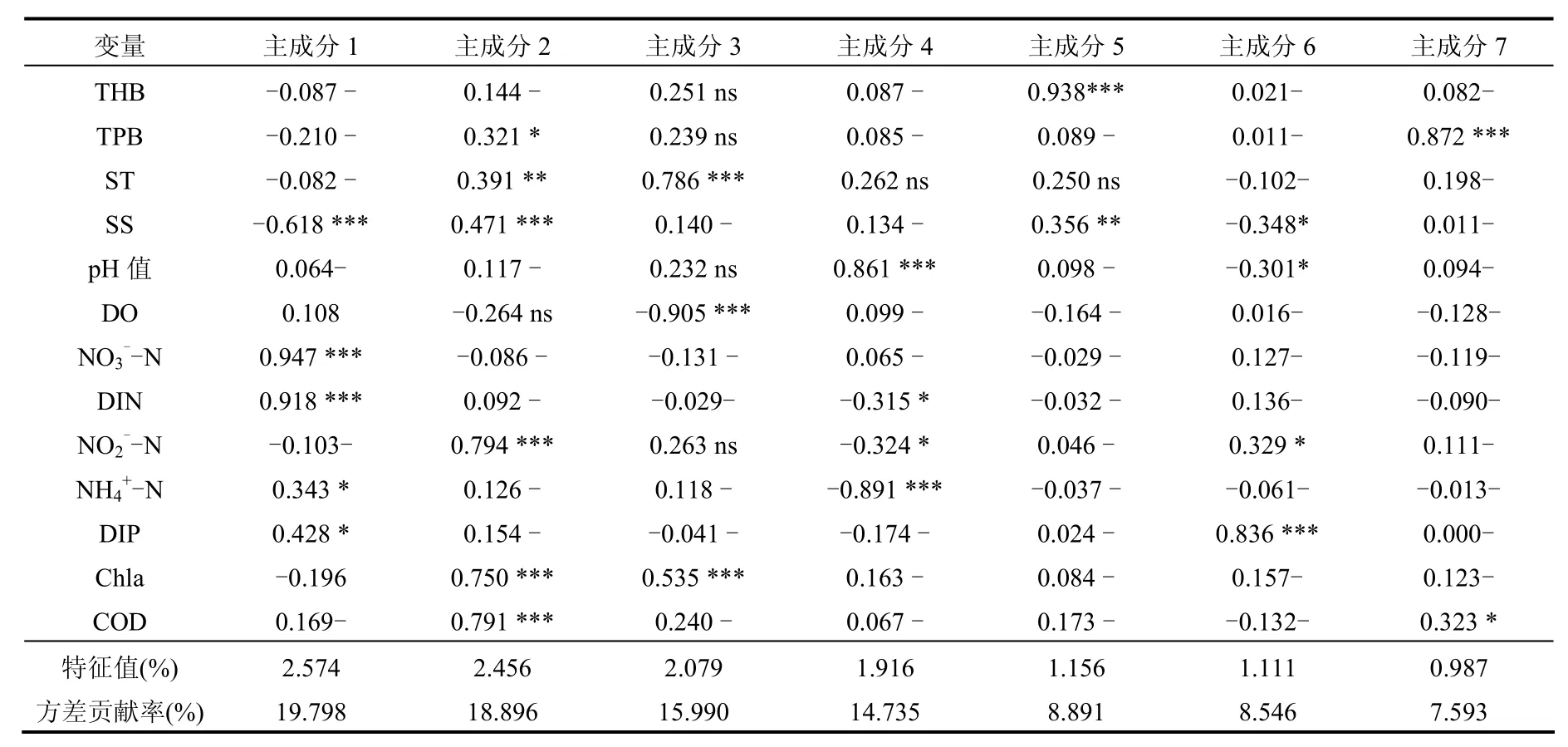
表3 表层海水主成分分析结果——因子载荷和解释方差Table 3 Results of principal component analysis of environmental factors-Various factors loading and explained variance (surface water)
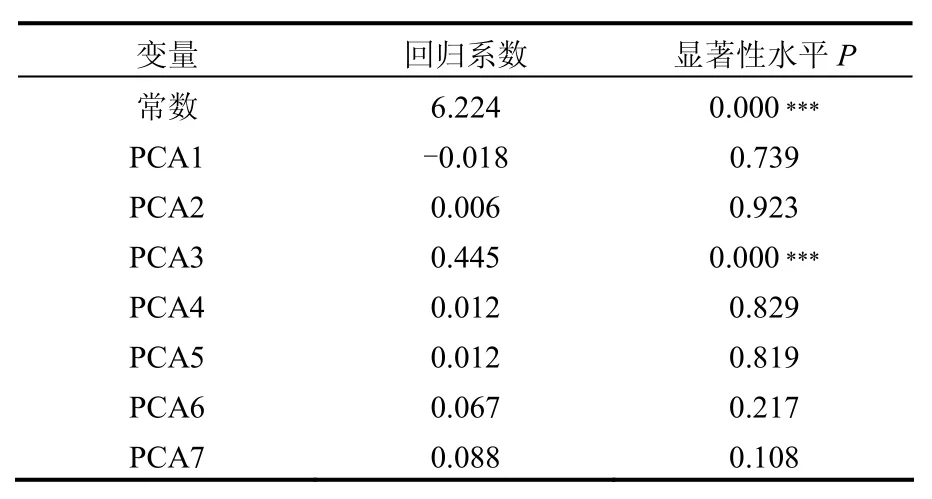
表4 表层海水浮游病毒丰度与主成分的逐步回归分析结果Table 4 Result of stepwise regression between the virioplankton abundance of surface water and PCAs
3 讨论
3.1 象山港海域海洋病毒的时空分布特征
调查期间象山港海域表层海水、上覆水及沉积物中海洋病毒丰度与富营养化程度较高的水体比较接近[22-27].通常营养化程度高的水体,海洋病毒粒子浓度相应要高,病毒的生产率也较高[28].象山港海域水体及沉积物中浮游(底层)病毒丰度均值较高的结果与同期的象山港海域海水水质及沉积物质量监测结果相一致[16].因为调查方法及样品采集等的局限性,样品中浮游(底层)病毒颗粒不可避免地会有裂解,致使病毒丰度的调查结果远远低于实际情况[29-30].
季节的更替导致海水温度、盐度、营养盐等因素的变化,进而影响海洋病毒的丰度,海洋病毒丰度呈现明显的季节变化规律.水体中浮游病毒丰度经常在秋季出现峰值,滞后于浮游植物峰值出现时间(春季),秋季水体中浮游植物的水华是造成此现象的主要原因,病毒的侵染力与宿主种群的产量和生长状况有关[11,14,29].象山港海域表层海水中浮游病毒丰度在秋季极显著高于其他季节进一步验证了此结论,说明浮游植物仍然是象山港海域表层海水中浮游病毒丰度的重要制约因子.象山港海域上覆水及表层沉积物中海洋病毒丰度峰值也出现在秋季,但是在其余季节的变化规律与表层海水稍有不同,表现为秋季远远高于春季、夏季、冬季,此现象进一步说明海洋表层水体及海洋底层沉积物是相对独立不同的环境,推测细菌是沉积物病毒的重要寄主.
调查结果显示,象山港海域支港港底、养殖区附近等富营养化程度较高的站点病毒丰度较高,这与已有报道的其他海域类似[27,29].一般来说,病毒丰度与水体系统的生产力有密切的关系.在海洋水体中近海水体病毒丰度最高,富营养化和污染的沉积物中具有高的病毒增殖率,且病毒丰度由近海到远海有逐渐减少的趋势[27].象山港海域浮游(底层)病毒的平面分布特征均为从港底到港口递减、养殖区高于非养殖区、宁海强蛟国华电厂附近海域出现较高值的趋势,近岸人类的工农业活动造成的陆源污染及海水增养殖活动造成的养殖污染是造成此分布特征的主要原因.另外,不同站位的沉积物种类包括颗粒组成、大小、种类等均可影响底层病毒的吸附,从而影响沉积物底层病毒的丰度[31].
与已有报道类似[15,20,25,27,32],相同季节相同站点,象山港海域表层沉积物中的底层病毒丰度均值高于上覆水中浮游病毒丰度,远远高于表层海水浮游病毒丰度.颗粒丰富的沉积物环境更利于吸附病毒,也更利于病毒存活[23-27].
3.2 象山港海域病毒丰度与环境因子的相关性分析
研究结果表明象山港海域表层海水、上覆水及沉积物中浮游(底层)病毒丰度与相应的浮游(底层)细菌数量均呈极显著正相关,这与文献报道相一致[10,33-34],多元统计分析结果表明浮游细菌丰度是上覆水中浮游病毒丰度的重要影响因素之一,说明浮游细菌作为浮游病毒的重要宿主在上覆水中体现更为明显.病毒生产率与活性细菌丰度及细菌细胞的生产力显著相关,病毒介导的细菌致死非常高,高的浮游(底层)病毒生产率对浮游(底层)病毒细菌动态变化具有显著影响,病毒增殖率应该被包含在水体生态系统的生物地球化学模式中[10,34].
病毒可以感染浮游植物,影响海洋中物质和能量的流动,在微食物环中起着举足轻重的作用
[1,5-13].病毒侵染浮游植物后或以溶原形态与浮游植物共存,或裂解浮游植物细胞,在海水中释放大量新的病毒粒子,因此浮游病毒丰度与浮游植物的消长关系密切.叶绿素 a含量和分布是反映养殖区水体营养状况的重要指标,其含量的高低直接反映浮游植物的生物量,而浮游植物作为海洋浮游病毒丰度的影响因素之一,其影响效果受诸多海洋环境因素的影响,在不同时间、不同海域等具有不同表现[35-37].本研究结果表明叶绿素a是象山港海域表层海水中的浮游病毒丰度主要影响因素之一(P<0.00),说明该海域浮游植物种群尤其是藻类是表层海水中浮游病毒的重要寄主,其数量及变化是浮游病毒丰度变化的重要影响因素.
水温会显著影响浮游植物、浮游(底层)细菌以及浮游(底层)病毒等所有海洋生物的生命活动,因此象山港海域表层海水中浮游病毒丰度与水温显著相关很容易理解.
一般认为,病毒感染是一个依赖于寄主数量的过程,溶解氧可以通过其对细菌或浮游植物的丰度、多样性及细胞活性的控制而影响海洋病毒的数量.本研究结果表明象山港海域表层海水中的浮游病毒丰度与表层海水的溶解氧含量呈显著负相关(P<0.05),且是表层海水中影响浮游病毒丰度的主要因素之一.溶解氧含量对病毒丰度的影响因具体的调查时间、调查海域等不同而影响不同.
营养盐可以通过其对细菌或浮游植物的丰度、多样性及细胞活性的控制而影响海洋(浮游)病毒的数量.Auguet等[36]在对Charenta河口区海洋浮游病毒的研究中发现,浮游病毒丰度与浮游细菌丰度、磷酸盐呈显著正相关. Hewson等[27]研究发现,无机营养物质如 NO3--N、NH4+-N、PO43--P等提高了上覆水及沉积物中的病毒生产率,且富营养化的站点病毒丰度明显高于其他站点.与此相同,研究结果表明N、P等营养盐含量是调查期间象山港海区上覆水中的浮游病毒丰度的主要影响因素,较高的营养盐含量增加了细菌体内病毒的释放量[5].富营养化与病毒增加间正相关性的可能的解释为:富营养化的水体比寡营养的水体中具有更高的细菌存活量,进而为噬菌体提供了高的宿主数量[9,14].另外,象山港海域的富营养化也直接了促进病毒的繁殖[27].
4 结论
4.1 调查期间象山港海域病毒丰度呈现明显的季节分布规律,秋季赤潮的爆发使该季节病毒丰度高于其他季节.
4.2 寄主细胞、营养底物浓度等的差异导致上覆水中病毒丰度大于表层海水;近岸人类的工农业活动带来的陆源污染及水产养殖污染导致病毒丰度呈现从港底到港口递减、养殖区高于非养殖区、电厂附近海域出现较高值的分布特征. 4.3 多元统计分析表明,在发生水华的象山港海域水体及沉积物中,浮游(底层)病毒丰度虽与水体的营养等级相关的指标(营养盐)有正相关关系,但是寄主细胞(浮游植物、浮游细菌、底层细菌)的生物量是决定病毒丰度的最关键因素.
[1] Fuhrman J A. Marine viruses and their biogeochemical and ecological effects [J]. Nature, 1999,399:541-548.
[2] Bratbak G, Heldal M. Viruses rule the waves - the smallest and most abundance members of marine ecosystems [J]. Microbiology Today, 2000,27:171-173.
[3] 王 斐, 郑天凌,洪华生.海洋病毒在微食物环中的重要作用[J]. 海洋科学, 1998,4:41-43.
[4] 张奇亚.浮游病毒 [J]. 水生生物学报, 2002,26(6):691–696.
[5] Bettarel Y, Sime-ngando T, Amblard C, et al. Viral activity in two contrasting lake ecosystems [J]. Applied Environmental Microbiology, 2004,70:2941-2951.
[6] 王 慧,柏仕杰,蔡雯蔚,等.海洋病毒——海洋生态系统结构与功能的重要调控者 [J]. 微生物学报, 2009,49(5):551-559.
[7] Breutbar M, Rohwer F. Here a virus, there a virus, everywhere the same virus [J]? TRENDS in Microbiology, 2005,13(6):278-284.
[8] Suttle C A, Chan A M, Cottrell M T, et al. Infection of phytoplankton by viruses and reduction of primary productivity [J]. Nature, 1990,347:467-469.
[9] Weinhauer M G, Fuks D, Puskaric S, et al. Diel, seasonal, and depth-related variability of viruses and dissolved DNA in the Norhtern Adriatic sea [J]. Microbiology Ecology 1995,30:25-41.
[10] Ronnie N G,Mathias M. Virus and bacteria dynamics of a coastal sediment: Implication for benthic carbon cycling [J]. Limnology Oceanography, 2004,49(6):2073-2081.
[11] Bergh O, Børsheim K Y, Bratbak G, et al. High abundance of viruses found in aquatic environments [J]. Nature, 1989,340: 467-468.
[12] Proctor L M, Fuhrman J A. Viral mortality of marine bacteria and cyanobacteria [J]. Nature, 1990,343:60-62.
[13] Fuhrman J A, Nobler T. Viruses and protists cause similar bacterial mortality in coastal seawater [J]. Limnology Oceanography, 1995, 40(7): 1236-1242.
[14] Brussaard C P. Viral control of phytoplankton populations – a review [J]. The Journal of Eukaryotic Microbiology, 2004,51(2): 125-138.
[15] Danovaro R, Armeni M, Corinaldesi C, et al. Viruses and marine pollution [J]. Marine Pollution Bulletin, 2003,46:301-304.
[16] 贝竹园.象山港海域营养盐污染特征及多种富营养化评价方法的比较[D]. 上海:华东师范大学, 2009.
[17] 顾晓英,陶 磊,尤仲杰,等.象山港大型底栖动物群落特征 [J].海洋与湖沼, 2010,41(2):208-213.
[18] 张海波,蔡燕红,项有堂.象山港水域浮游植物与赤潮生物种群动态研究 [J]. 海洋通报, 2005,24(1):92-96.
[19] Tomohiro K, Yasushi H. Determination of abundance and biovolume of bacteria in sediments by dual staining with 4, 6-diamidino-2-phenylindole and acridine orange: Relationship to dispersion treatment and sediment characteristics [J]. Applied Environmental Microbiology, 1999,65(8):3407-3412.
[20] Helton R, Liu L, Eric Wommack K. Assessment of factors influencing direct enumeration of viruses within estuarine sediments [J]. Applied Environmental Microbiology, 2006,72: 4767-4774.
[21] GB 12763.6-1991 海洋调查规范(海洋生物调查) [S].
[22] 张 喆,孟祥红,肖 慧,等.青岛近岸水体夏冬季浮游病毒、细菌分布特征及其与环境因子的关系 [J]. 武汉大学学报(理学版), 2008,54(2):209-214.
[23] Cochlan W P, Wikner J, Steward G F, et al. Spatial distribution of viruses, bacteria and chlorophyll a in neritc, oceanic and estuarine environments [J]. Marine Ecology Progress Serries, 1993,92:77-87.
[24] Steward G F, Smith D C,Azam F. Abudance and production of bacteria and viruses in the Bering and Chukchi Seas [J]. Marine Ecology Progress Serries, 1996,131:287-300.
[25] Drake L A, Choil K-H, Haskell E A G, et al. Vertical profiles of virus-like particles and bacteria in the water column and sediments of Chesapeake Bay, USA [J]. Aquatic Microbial Ecology, 1998,16:17-25.
[26] Bettarel Y, Bouvy M, Dumont C, et al. Virus-Bacterium Interactions in Water and Sediment of West African Inland Aquatic Systems [J]. Applied Environmental Microbiology, 2006,72(8):5274-5282.
[27] Hewson I, O’Neil J M, Fuhrman J A, et al. Virus-like particle distribution and abundance in sediment and overlying waters along eutrophication gradients in two subtropical estuaries [J]. Limnology Oceanography, 2004,46(7):1734-1746.
[28] Wen K, Ortmann C A, Suttle A C. Accurate Estimation of Viral Abundance by Epifluorescence Microscopy [J]. Applied Environmental Microbiology, 2004,70:3862-3867.
[29] Paul J H, Sullivan M B. marine phage genomics: what have we learned?[J]. Current Opinion Biotechnology, 2005,16(3): 299.
[30] Peduzzi P, Luef B. Viruses, bacteria and suspended particles in a backwater and main channel site of the Danube (Austria) [J]. Aquatic Science, 2008,70:186-194.
[31] Bongiorni L, Maganini M, Aemeni M, et al. Viral production, decay and life strategies along a trophic gradient in the North Adriatic Sea [J]. Applied Environmental Microbiology, 2005, 71:6644-6650.
[32] Drake L A, Choi K H, HaskelL A G E, et al. Vertical profiles of virus-like particles and bacteria in the water column and sediments of Chesapeake Bay, USA [J]. Aquatic Microbial Ecology, 1998,16:17-25.
[33] Mirko Magagnini, Cinzia Corinaldesi, Luis S, et al. Viral abundance and distribution in mesopelagic and bathypelagic waters of the Mediterranean Sea [J]. Deep-Sea Research I, 2007,54:1209-1220.
[34] Corinaldesi C, Crevatin E, Del Negro P, et al. Large-scale spatial distribution of virioplankton in the Adriatic Sea:Testing the trophic state control hypothesis [J]. Applied Environmental Microbiology, 2003,69:2664-2673.
[35] Manini E, Luna G M, Danovaro R. Benthic bacterial response to variable estuarine waters inputs [J]. FEMS Microbial Ecology, 2004,50:158-194.
[36] Auguet J C, Montanie H, Delmas D, et al. Dynamic of virioplankton abundance and its environmental control in the Charente estuary (France) [J]. Microbial Ecology, 2005,50:337-349.
[37] 裴 达,程 凯,丁 奕,等.富营养化水体中浮游病毒与浮游植物生长的关系 [J]. 中国环境科学, 2007,27(6):826-829.
Spatiotemporal distribution of marine viruses with related to environmental factors in the Xiangshan Bay.
WANG Hai-li1, YANG Ji-fang1*, TU Xiao-xia1, CHEN Ji-gang1, FENG Hui-qiang2(1.Municipal Key Laboratory of Microorganism and Environmental Engineering, Faculty of Biological and Environmental Science, Zhejiang Wanli University, Ningbo 315100, China;2.Marine Environment Monitoring Station of Xiangshan Bay, Ningbo 315141, China). China Environmental Science, 2011,31(5):834~844
In July (summer) and October (autumn) 2007 and in January (winter) and April (spring) 2008, an investigation was made on the spatiotemporal distribution of virus in the surface seawater, overlying water and sediment in Xiangshan Bay. A cylindrical High-fidelity gravity sampler instead of conventional grab sampler was used for collecting samples, and principal component analysis and multivariate linear stepwise regression analysis were adopted to analyze the relationships between virus abundance and environmental parameters.Virus abundance during investigation ranged from 6.48×104to 1.01×108cells/mL, with a mean of 1.55×107, 1.03×108, 1.13×108cells/mL of the surface seawater, overlying water and sediment respectively. Significantly high values could be observed for virus abundance in autumn compared to other sampling time with the lowest value in winter. In vertical direction, the number of viruses in the overlying water and in the sediment was higher than that in the surface seawater; in horizontal direction, the number of viruses decreased from the top to the mouth of the bay with higher abundance near the breeding areas. A very high value of virus abundance was observed near Power Plant as well. Such spatial distribution of viruses in Xiangshan Bay demonstrated that anthropogenic coastal land pollution and maricultures pollution played the key roles. The dissolved oxygen, surface seawater temperature and Chl a were the main factors influencing the abundance marine virus in surface seawater. In contrast, the nutrients (N, P) and bacteria abundance were the main factors influencing virioplankton distribution in the overlying water; in addition, the virus abundance had significant positive relation with the bacteria abundance in the sediment (P <0.01).
Xiangshan Bay;marine virus;abundance;temporal and spatial distribution;environmental factors
X55,Q985.885.3
A
1000-6923(2011)05-0834-11
2010-10-09
国家海洋公益性项目(200705014);国家科技部国际合作重点项目(2007DFA21300);国家“863”项目(2007AA091902);宁波市科技局重大科技攻关项目(2006C100030)
* 责任作者, 研究员, jfkwlq@163.com
王海丽(1979-),女,山东潍坊人,讲师,硕士,主要从事海洋微生物学研究.发表论文3篇.
