动物性食品中PCBs的生物有效性及人体日暴露评估
2011-12-20李俊岭张东平余应新韩姝媛吴明红盛国英傅家谟上海大学环境与化学工程学院环境污染与健康研究所上海200444中国科学院广州地球化学研究所有机地球化学国家重点实验室广东广州50640上海大学环境与化学工程学院上海射线应用研究所上海200444
李俊岭,张东平,余应新*,韩姝媛,吴明红,盛国英,2,傅家谟,2 (.上海大学环境与化学工程学院,环境污染与健康研究所,上海 200444;2.中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广东 广州50640;.上海大学环境与化学工程学院,上海射线应用研究所,上海 200444)
动物性食品中PCBs的生物有效性及人体日暴露评估
李俊岭1,张东平1,余应新1*,韩姝媛1,吴明红3,盛国英1,2,傅家谟1,2(1.上海大学环境与化学工程学院,环境污染与健康研究所,上海 200444;2.中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广东 广州510640;3.上海大学环境与化学工程学院,上海射线应用研究所,上海 200444)
通过测定上海市售动物性食品中PCBs的浓度和生物有效性,评估该地区PCBs的人体日暴露量.结果表明,不同种类食品中PCBs的浓度在未检出~3734.3pg/g(湿重)之间,3~6氯PCBs为主要同系物.鱼类中PCBs浓度高于畜类、禽类和软体类.鱼类PCBs的浓度水平遵循以下两规律:海水鱼>淡水鱼;肉食性鱼>杂食性鱼>草食性鱼.采用模拟人体胃肠消化过程测得 PCBs的生物有效性,由于食品中脂肪含量与PCBs的生物有效性具有显著的线性关系,故可用于计算样品中 PCBs的生物有效性.该地区居民每天通过动物性食品摄入的 PCBs量为24439.3pg/d,以PCBs的生物有效性计量为5034.5pg/d.对不同暴露源(包括灰尘和大气颗粒物)的分析表明,鱼类是PCBs人体暴露的主要贡献者,约占人体PCBs日暴露的60%.
多氯联苯;动物性食品;模拟胃肠道;生物有效性;日暴露
多氯联苯(PCBs)是一组由一个或多个氯原子取代联苯分子中的氢原子而形成的氯代芳烃类化合物,被广泛应用于电力工业、塑料加工业、化工和印刷等领域.由于 PCBs具有持久性有机污染物(POPs)的特点并对环境及人类造成危害,20世纪70年代末已经在全球禁止使用.但由于其在环境中难以降解以及远距离迁移,目前在环境中仍然被检测出[1].
PCBs暴露于普通人群的途径主要是通过口腔摄入,因此食品是人体 PCBs暴露的主要源之一.PCBs属于亲脂性化合物,因此,动物性食品扮演着重要角色[2-3].据报道[4-9],口腔摄入的污染物并非全部被人体吸收,只有从介质释放到肠道消化液部分的污染物才能被吸收,通常可以采用体外实验模拟受污染的介质在人体胃肠中消化,测定其溶出率,这被认为是该污染物可以被人体吸收的最大效率,通常用生物有效性表示,也有学者称为生物可给性或生物可利用性.
本课题组前期的研究发现[10],动物性食品中PCBs的生物有效性与脂肪含量具有线性关系.如果通过这一关系,动物性食品中 PCBs的生物有效性有可能直接通过脂肪含量进行计算得到,从而免去对所有样品进行直接测定.但是由于该实验样品中脂肪含量范围窄,没有高脂肪含量的数据,难以用于较高脂肪含量样品中 PCBs生物有效性的计算,为此,本实验选择更宽的脂肪含量(从0.6%到16.7%,湿重)的样品,测定脂肪含量对PCBs生物有效性的影响,以期确定食品中脂肪含量是否可以用于直接计算PCBs的生物有效性.其次,在前期研究的基础上,增大样品量的采集,评估上海地区市售动物性食品中PCBs的暴露水平,使数据更加具有统计意义;此外,评估不同暴露源对人体PCBs日暴露的相对贡献.
1 材料与方法
1.1 样品采集与制备
自2008年9月~2009年6月,从上海市10个不同的行政区采集肉类、鱼类和软体类样品.样品种类包括畜类(猪肉(瘦肉)和牛肉),禽类(鸡肉和鸭肉),鱼类(其中淡水鱼为草鱼、鲫鱼、鳙鱼、黑鱼、鲈鱼、鳊鱼、桂鱼,海水鱼为大黄鱼、带鱼、鲥鱼)、软体类(南美白虾、蛤蜊、螺蛳)共17种,其中猪肉、牛肉、鸡肉和鸭肉样品均为 4个,草鱼和鲫鱼各5个,鲥鱼9个,其他均为10个,共计135个样品.在这些鱼样中,草鱼和鳊鱼为草食性鱼,鲫鱼、鳙鱼和鲥鱼为杂食性鱼,黑鱼、鲈鱼、桂鱼,大黄鱼和带鱼为肉食性鱼.样品运回实验室后,用自来水冲洗干净,然后再用去离子水清洗,接着将畜类和禽类样品中的瘦肉部分、鱼类(去皮的可食用部分)用不锈钢刀割下,切成小块;蛤蜊和螺蛳均去除外壳,虾去壳去头.样品用搅拌器搅碎后冷冻干燥恒重,磨成细粉后于-18℃保存待分析.
由于样品中PCBs具有生物有效部分仅占样品中PCBs很小的一部分[10-11],常用的气相色谱-质谱联用仪(GC/MS)的检测限有限.因此采用加标的方式进行实验.向含有2~3mL二氯甲烷的棕色培养瓶中定量加入 PCBs混合标样,然后加入食物样品,充分混合之后用微弱的氮气流使二氯甲烷挥发,制成受PCBs污染的食物样品.
1.2 PCBs浓度测定
称取 8g样品,加入回收率指示物13CPCB141和PCB209,用250mL正己烷/丙酮(体积比为 1:1)混合溶剂索氏抽提 72h.取出 75%的抽提液用于 PCBs的浓度测定,剩余部分采用重量差法测定脂肪含量.将75%的抽提液浓缩到1mL,上样到凝胶渗透色谱(GPC,填料为200~400目的S-X3生物珠),用115mL正己烷/二氯甲烷 (体积比为1:1)淋洗去除脂肪,后收集115~280mL组分.收集的组分浓缩到 0.5mL后,用酸/碱性硅胶-氧化铝复合层析柱净化.用70mL的正己烷/二氯甲烷 (体积比为 1:1)混合溶剂淋洗并收集,该组分加内标13C-PCB208后浓缩转移到2mL的棕色样品瓶,用微弱的氮气吹干后定容至100μL,样品放于4℃待分析.
1.3 PCBs生物有效性测定
称取0.2g制备的受PCBs污染的样品于培养瓶中,向其中加入 12mL含营养液和胃蛋白酶的模拟胃液,37℃下厌氧避光消化 2h;然后再加入6mL含有胰液和胆汁的小肠模拟液,相同条件下继续消化 6h.消化结束后取出消化混合液在7000g离心10min,上清液过0.45μm膜,加入丙酮后用正己烷/二氯甲烷(体积比为 1:3)萃取[12].萃取液浓缩至 1 mL加入正己烷后用浓硫酸处理,有机相用酸/碱性硅胶-氧化铝复合层析柱净化,过程见1.2部分.样品最后于4℃保存待分析.
实验过程中,当样品中脂肪含量高于 9.6% (湿重)时,在样品离心时有部分未被消化的脂肪残留在离心管液面处,由于在人体中,当肠道中油脂类物质增多时,人体将分泌更多的胆汁进入肠道,此外,亲脂类物质易通过与脂类结合被肠道吸收.对于这类样品,添加了如下实验过程:仔细地用丙酮收集该残留的脂肪,一并加入到上清液中,然后进行后续的实验.
1.4 仪器分析
PCBs的浓度测定在电子冲击离子源(EI)6890N-5975 GC/MS(Agilent)上完成.进样口和离子源温度分别为 280和 230℃,采用选择离子模式(SIM),选择离子为分子离子.色谱柱为DB-5MS(60m×0.25mm×0.25μm, J &W Scientific, USA),以高纯氦气为载气(1.0mL/min),反应气柱流速为60 mL/min,升温程序:110 ℃保留1 min后以10℃/min升至200 ℃,以1℃/min升至250℃,再以8℃/min升至290℃,保留10min.手动1μL无分流进样.
1.5 质量控制与质量保证
在进行样品分析的同时,进行方法空白及样品平行样分析,每6个样品做1个空白,每20个样品做1个重复样品.基质加标样品6个.采用7种质量浓度的混合标样(2~100μg/L)用内标法绘制工作曲线,除个别化合物外,校正曲线的相关系数均>0.99,所检测的PCBs同系物单体有CB19,18, 16,25,28,22,44,71,67,74,66,56,99,87,110,82,147,1 46,153,179,138,187,174,177,173,180,199,203,195, 194,和 206共 31种单体.回收率指示物13CPCB141和PCB209的回收率都在70%~120%之间,3个平行样品分析相对标准偏差(RSD)<15.0%,均符合样品分析要求.采用 5倍信噪比浓度的标样,平行分析6次取其标准偏差S,以3.36S为仪器检出限(IDL).采用该方法,PCBs的仪器检出限为0.4~3.0pg.根据仪器检出限,以6 g干燥样品(以样品的含水率为 80%计)处理后定容体积为 100μL为基准,以上化合物的方法检出限(MDL)为 1.3~10.0pg/g(湿重).所有生物有效性实验都重复3次.
1.6 数据分析
生物有效性的测定均采用加标样品和非加标样品同时进行.根据文献[13],在人体胃肠环境条件下 PCB单体的生物有效性(Ba%)的计算式为:

式中:m加标x和m未加标x(pg)分别为加标样品和未加标样品在消化液中释放的PCB单体质量;m总x(pg)为加入到食品中的PCB单体质量.
食品中PCB单体通过口腔摄入人体的暴露可以通过式(2)进行计算:

式中:ADI为PCB的平均日摄入量, pg/d;C为食品中PCB的浓度, pg/g; m为食品人均日摄入量, g/d; I为PCB在肠道中的吸收率,以PCB的生物有效性进行计算.其中C·I项为生物有效浓度,即意味着样品中具有生物有效作用 PCB单体的浓度.
数据统计分析采用 SPSS 11.5软件进行,作图采用 Excell软件进行.2个变量之间的关系采用线性回归分析,当P<0.05(即95%的置信度)则认为具有统计学意义.
2 结果与讨论
本课题组前期(2008年 9~10月)的实验中,采集了上海市33个动物样品,包括猪肉(5个)、牛肉(6个)、鸡肉(6个)、鸭肉(6个)、草鱼(5个)和鲫鱼(5个),对其中PCBs的暴露进行了初步研究[10].本次实验还采集了其他 11种鱼类和软体类食品共计135个.为了使讨论更加具有统计意义,将前期的33个样品也纳入讨论.所以,以下的讨论包括前期的33个样品,即共计168个样品.
2.1 PCBs的浓度水平
在所有样品中,有 165个样品检测到 PCBs (下文中PCBs浓度指31个PCB单体浓度的总和),其检出率达到98.2%,表明虽然目前国家已经禁止生产和使用PCBs,但是,由于PCBs的典型持久性特性,在环境中难以降解,目前仍然广泛存在于环境介质中,并通过生物体累积.研究结果如表 1,这些食品中 PCBs的浓度从低于检测限到3734.3pg/g,这一最高浓度在大黄鱼样品中检测到.在这些不同种类的食品中,大黄鱼中PCBs的浓度最高,平均为 1502.3pg/g(323.3~3734.3pg/g),中值为 1489.1pg/g;桂鱼(平均为 696.4pg/g)次之.浓度最低的为鸡肉,平均为 31.0pg/g(6.8~70.3pg/g),中值为32.3pg/g;猪肉(平均为34.3pg/g)次之.本研究中,鱼类样品与中国其他省市的研究结果基本上处于同一数量级[3,14],但远低于欧美市场样品[15-16].这表明,目前我国PCBs的整体残留水平较低.
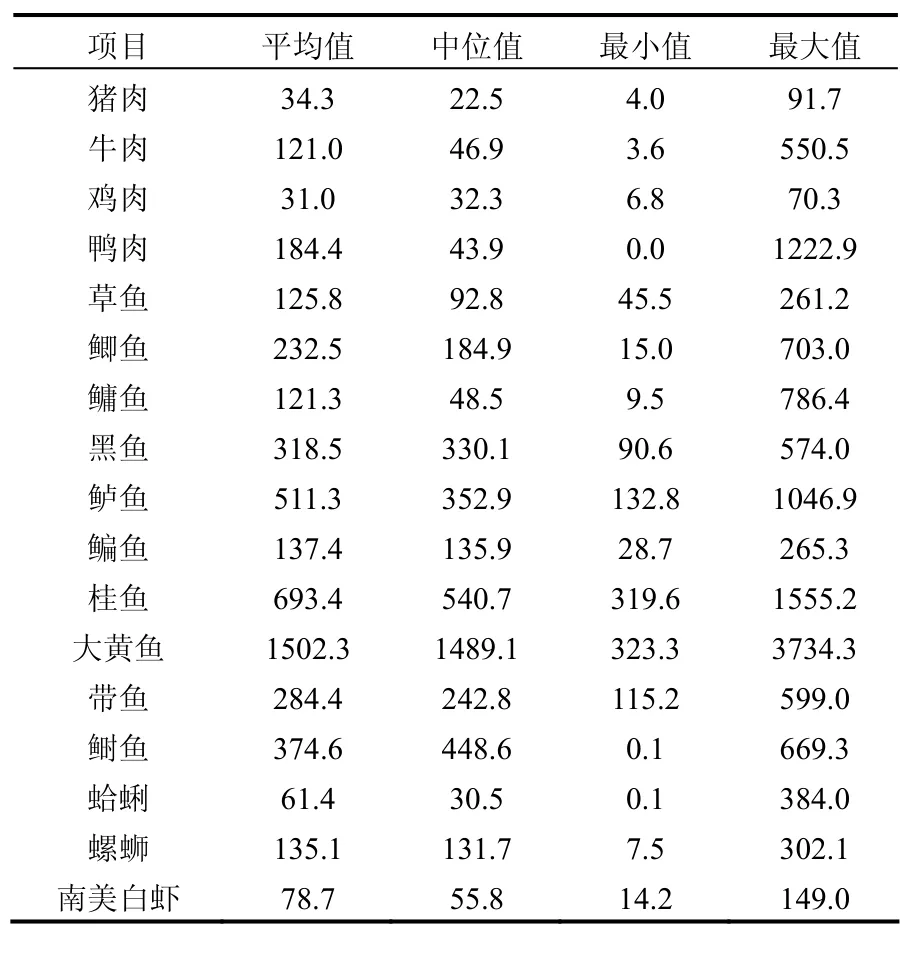
表1 不同食品中PCBs的浓度(pg/g)Table 1 Concentrations of PCBs in the different types of foods (pg/g)
在这些样品中,生物种类及生物生活习性对PCBs的浓度具有重要影响.表2综合展示了不同类别的样品中PCBs的浓度水平,其顺序为:海水鱼类>淡水鱼类>(禽类、软体类、畜类).在这些样品中,其脂肪含量分别为 6.5%,2.3%和 1.0%~2.0%.由于环境中 PCBs易通过生物体富积并在脂肪组织中蓄积,从而导致高脂肪含量的生物体中PCBs浓度高.如图1所示,样品中PCBs含量与样品中的脂肪含量呈现显著正相关.对于不同食性的鱼类,PCBs的浓度顺序为:肉食性>杂食性>草食性(表 2),这是由于当亲脂类物质辛醇水分配系数的对数值 logKOW>5时,该物质易通过食物链放大,且 logKOW越大,该物质越易被放大[17].本研究中,PCBs的logKOW均>5,因此,可以通过生物放大,在食物链高端的鱼类(如肉食性鱼类)中 PCBs浓度含量高.
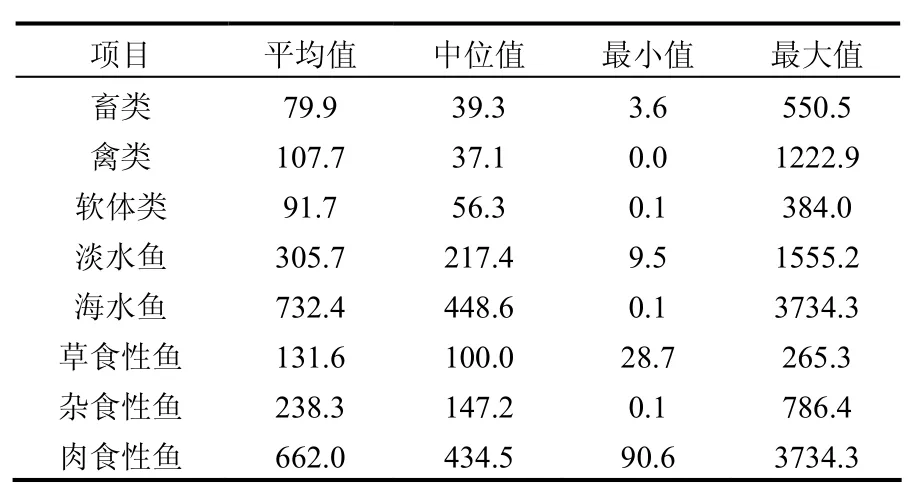
表2 不同种类食品及不同食性鱼类中PCBs的浓度(pg/g)Table 2 Concentrations of PCBs in the different type of foods and fish with different habits (pg/g)
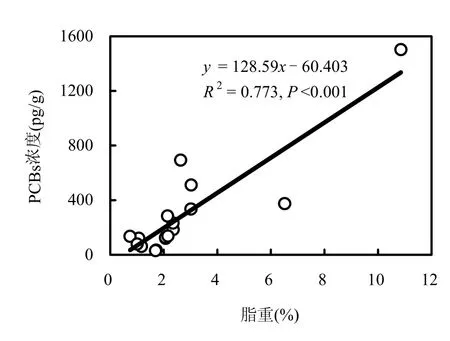
图1 PCBs浓度与脂肪含量关系Fig.1 Relationship between the concentrations of PCBs and fat contents
2.2 PCBs同系物分布特征
不同氯原子取代的PCBs具有不同的物理化学性质.对样品中 PCBs同系物的组成分析从一定程度上可以了解其来源.
在所有样品中PCBs同系物主要以PCB153、PCB28、PCB138、PCB180和PCB18为主.PCBs同系物的分布特征如图 2所示,其中 3氯包括CB19,18,16,25,28,22;4氯包括CB44,71, 67,74,66, 56;5氯包括CB99,87,110,82;6氯包括CB147,146, 153,138;7氯包括CB179,187,174, 177,173,180;8氯包括CB199,203,195,194;9氯为CB206.在这些样品中,无论是畜类、禽类还是鱼类和软体类样品,3~6氯PCBs占绝对优势,其含量从67.9%(牛肉)到 93.2%(草鱼).这可能反映了其工业来源,如常见的工业品 Aroclor1232、Aroclor1016和Aroclor122其主要成分为 5氯以下的 PCBs; Aroclor1260的主要成分为6-7氯PCBs.但是不同种类样品中同系物的分布又有所区别,如猪肉和禽类样品中,主要以3~5和3~6氯代PCBs为主,且均高于牛肉样品;在这些牛肉样品中7~8氯 PCBs占 29.4%,而猪肉和禽类样品中仅占11.5%~13.6%.这可能与这些动物的食物来源有关,如猪和禽类主要为饲料,而牛主要为草料,其食物更易受环境的影响,如土壤和大气降尘.由于不同氯代PCBs具有不同的挥发性,氯原子越多,挥发性越差,更易在降尘和土壤中吸附,从而导致牛肉中高氯代PCBs占有较大比例.
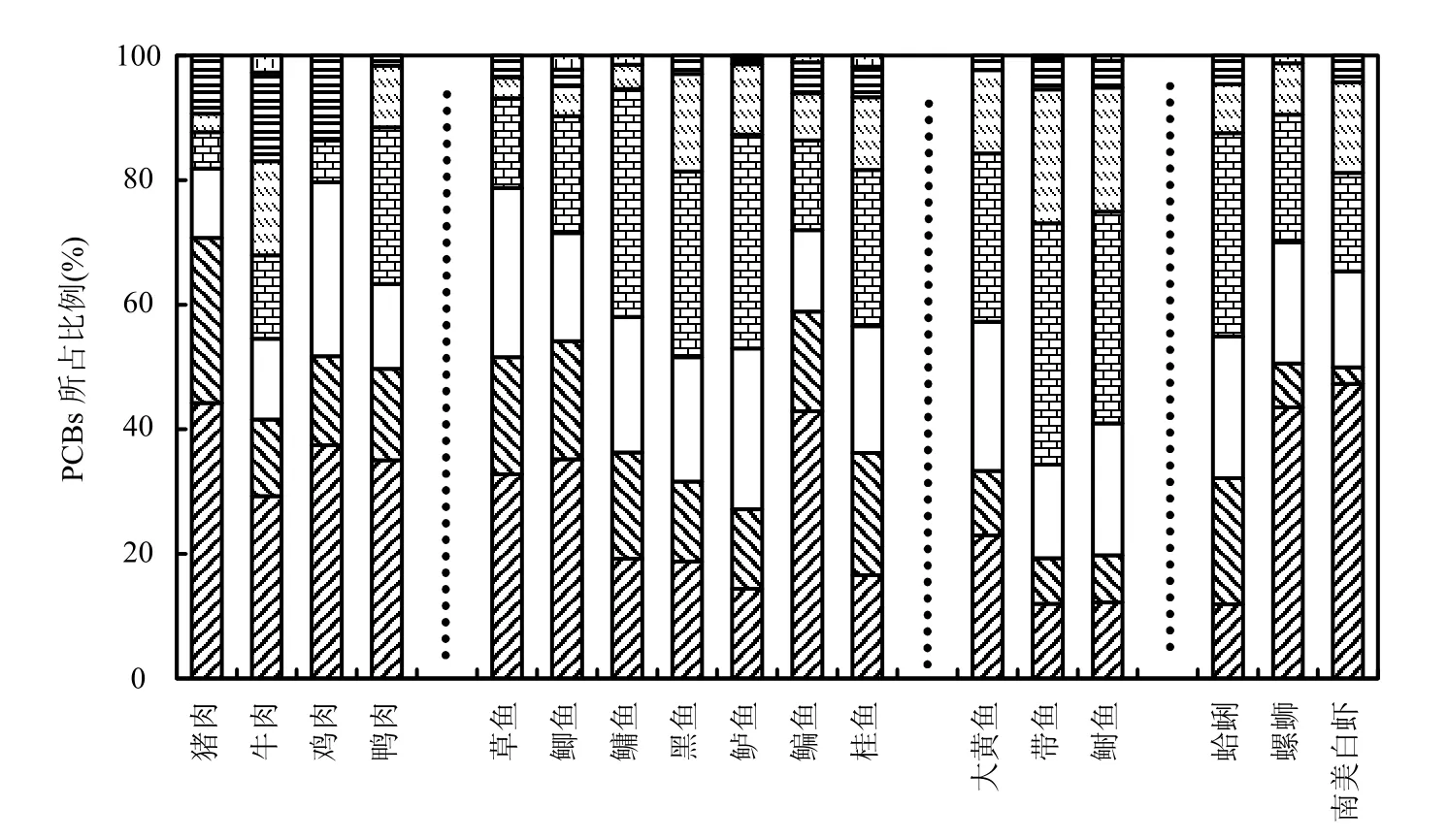
图2 不同食品中PCBs同系物的分布特征Fig.2 PCB congener profiles in the different types of foods
对于鱼类样品,主要以3~6氯代PCBs为主,这与Meng等[3]对广东的鱼类样品中PCBs的研究结果一致,这反映了中国过去 PCBs的使用主要以低氯代PCBs为主.进一步分析发现,不同生活习性的鱼类样品中PCBs的同系物有一定差别,将鱼分为草食性、杂食性和肉食性鱼时,发现草食性鱼中3~5氯代PCBs占75.4%,杂食性和肉食性鱼样中分别为56.8%和54.1%;而6氯代PCBs分别为14.4%、29.8%和28.2%,7氯代PCBs分别为5.5%、9.6%和13.5%.如前所述,本研究中,PCBs的logKOW均高于5,可以通过食物链放大,但是不同氯代 PCBs具有不同的放大能力,PCBs的logKOW越高,其生物放大能力越强.此外,高氯代的PCBs比低氯代PCBs在生物体内更易于代谢降解,脱氯生成低氯代PCBs,因此当PCBs的氯原子数达到一定时,其在生物体的净富积量下降.据报道[18],PCBs在生物体中的放大能力与 logKOW呈现抛物线关系,即中等氯原子取代的 PCBs同系物在生物体中的生物放大能力高于低、高氯代的PCBs同系物,其放大能力6-7氯代PCBs最高.
2.3 PCBs的生物有效性
人体中,物质吸收主要发生在小肠部分,因此,文中只研究 PCBs在小肠中的生物有效性.为了讨论脂肪对 PCBs生物有效性的影响,选用了不同种类的食品以及不同脂肪含量的食品进行研究.由于大黄鱼中脂肪含量高,因此选取了4个大黄鱼样品.此外,还选择了不同脂肪含量的其他鱼类和软体类样品,如鲈鱼、鳊鱼和蛤蜊.利用加标样品,通过模拟人体胃肠消化测定的动物性食品中PCBs生物有效性结果如表3所示.
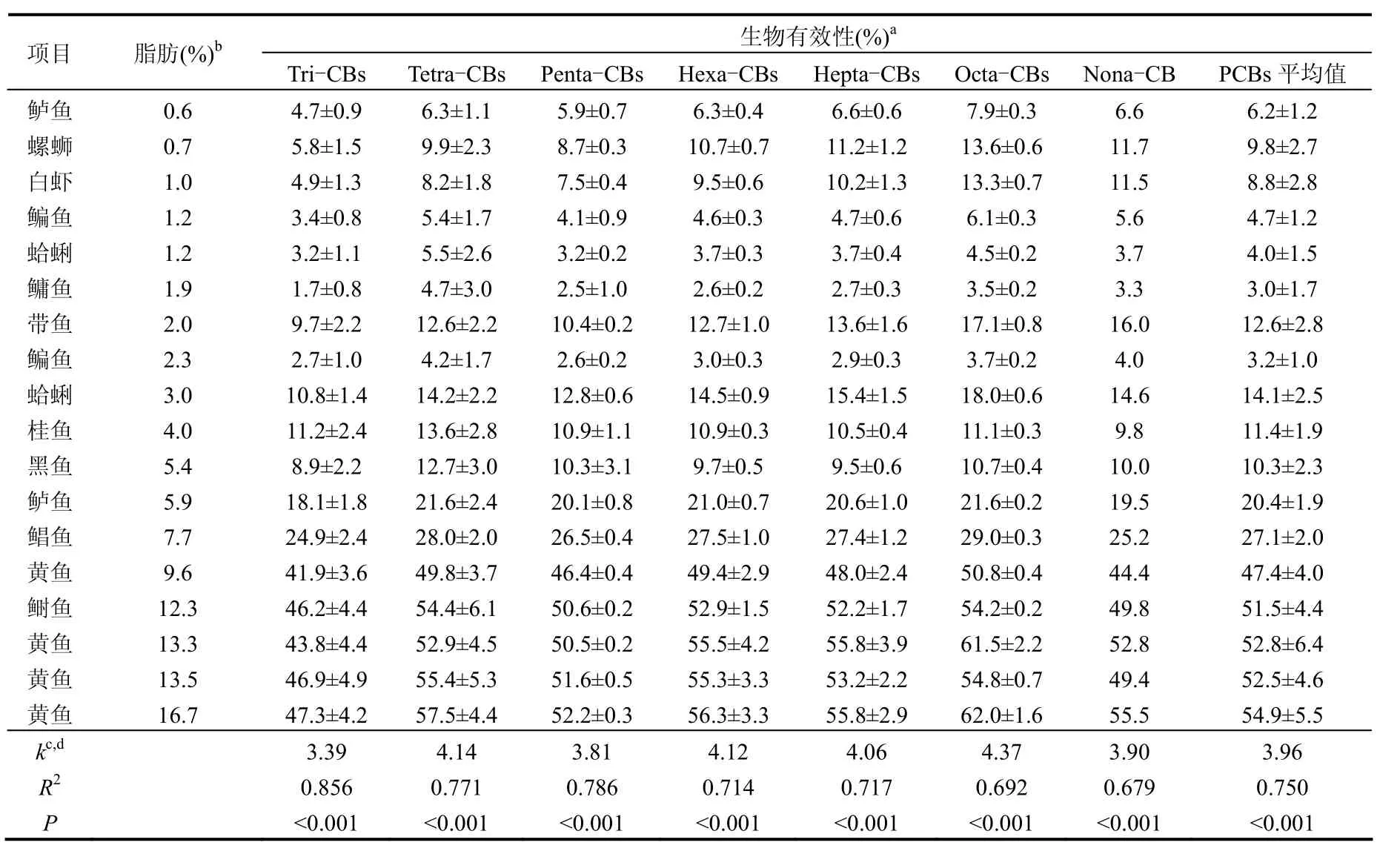
表3 不同脂肪含量食品中PCBs的生物有效性及其与脂肪含量的关系Table 3 Bioaccessibility of PCBs in foods with different fat contents and their correlations with fat contents
从表 3可以看出,不同脂肪含量的样品中,PCBs的生物有效性随样品中脂肪含量的升高而增大.当样品中的脂肪含量由 0.6%(湿重)升高到16.7%(湿重),其中不同PCBs同系物的平均生物有效性由最低的3%上升到54.9%.结合前期的研究结果[10],采用线性拟合(强制过原点)分析脂肪含量和 PCBs生物有效性之间的关系,发现所有PCBs同系物单体与样品中的脂肪含量均具有显著的正相关性(P<0.05).类似的结果已有文献报道,如陆敏等人[12]的研究表明,胡萝卜中DDT及其衍生物的生物有效性随着添加食用豆油量的增大而增大.肉类食品中多溴联苯醚(PBDEs)的生物有效性与脂肪含量具有显著的正相关[13].Adenugba等[19]也发现了类似的趋势,但是因其只有4个样品,并未发现有显著正相关关系.相同氯原子数取代 PCBs的生物有效性及线性方程参数列于表 3,其使用的样本数为本实验测定的18个和文献[10]中的6个,共计24个样本(后面的讨论也相同).图3显示了31个PCB同系物平均生物有效性与脂肪含量的关系.基于PCBs生物有效性与脂肪含量之间的这种强线性关系,可以利用这种关系,直接根据样品中的脂肪含量计算PCBs的生物有效性,即:

式中:k为PCB单体生物有效性与脂肪含量关系曲线的直线斜率, F(%)为样品中的脂肪含量.
最近,也有少量采用体外实验测定食品中PCBs生物有效性的报道,如Adenugba等[19]测得鲭和鲑鱼样品中 PCBs的生物有效性为30%~82%,但Xing等[11]测定2种淡水鱼(鳙鱼和泥鳅)中PCBs的生物有效性平均值为3%,最大值仅为 7%.这种差异,一方面,可能由于不同研究采用了不同的消化条件(如pH值、消化酶和胆汁浓度、样品量和消化液体积的比例)所导致.例如,Oomen等[4]对比了5种不同的体外胃肠模拟实验方法测定重金属的生物有效性,其结果表明,由于不同体外实验模型采用的消化液的组分、pH值、消化时间的差异,样品中重金属的生物有效性不同.另一方面,可能与样品本身有关.如本研究中,同是鲈鱼样品,当鲈鱼中脂肪含量为0.6%和5.9%时,PCBs的平均生物有效性分别为6.2%和 20%.Yu等[13]报道,肉类食品中脂肪含量与PBDEs的生物有效性之间具有显著的正相关性,而蛋白质却对PBDEs的生物有效性具有显著的负影响.由于肉类食品主要由水、蛋白质和脂肪组成,因此可以预测,对于PCBs这类与PBDEs结构与性质类似的疏水性化合物,当样品中脂肪含量升高,蛋白质含量下降时,PCBs的生物有效性会随之升高.这一预测也可以从以下分析得到验证,小肠液中含有对脂肪具有重要作用的物质即胆汁,一方面,胆汁中的胆汁盐,可以对脂肪起到乳化作用,形成一种胶束溶入消化液中;另一方面,胆汁中的脂肪酶可以使样品中的脂肪分解.这两个过程降低了样品中疏水性化合物的逸度容量(逸度增大)而提高了消化液中该类物质逸度容量(逸度降低).此外,胆汁为一种表面活性剂类物质,提高了消化液中的表面张力,增加了疏水性物质的溶解度,进一步提高了该类物质的逸度容量,从而在样品和消化液之间形成了一个逸度梯度,导致样品中的疏水性物质容易从样品中释放,直到该类物质在样品和消化液中的逸度到达平衡.由于消化液的量远远高于样品(消化液:样品=90:1),因此当消化初始样品中脂肪含量越高,两个体系中PCBs的逸度达到平衡时,PCBs的释放程度就越高,即表现为生物有效性越大.
由于不同氯代 PCBs具有不同的疏水性,氯原子越多,疏水性越强,因此在相同作用下,在样品和消化液之间形成的逸度梯度就越大,表现为氯原子数越多(即logKOW越大),其生物有效性越大;同时,脂肪含量越高,对这种影响也越大.这一预测可以通过脂肪含量和PCBs的logKOW及其生物有效性之间的关系得到验证.如图 4a所示,31种PCB单体的平均生物有效性与logKOW之间具有显著的正线性关系(PCB单体也相同),这一结果与Adenugba等[19]和Xing等[11]的结果相反.当以脂肪为横坐标,以PCBs的logKOW及其生物有效性关系曲线的斜率为纵坐标,得到图4b,由图4b可知,脂肪含量越高,logKOW对PCBs生物有效性的影响越大.
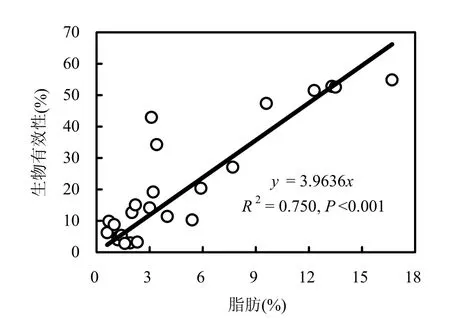
图3 PCBs生物有效性与脂肪含量的关系Fig.3 Relationship between the bioaccessibility of PCBs and fat contents
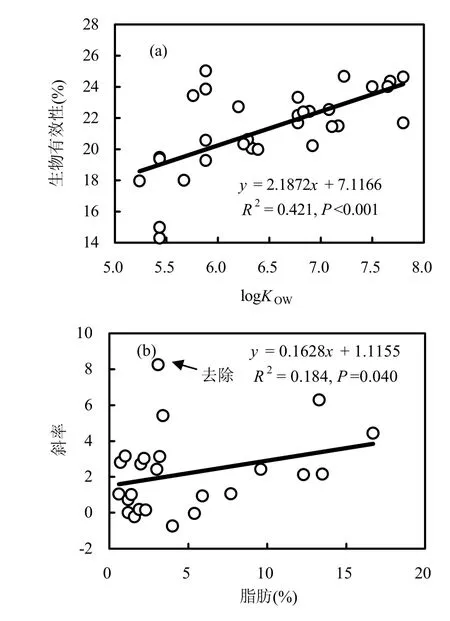
图4 PCB生物有效性与logKOW及脂肪的关系Fig.4 Relationships between the bioaccessibility and logKOW of PCBs or fat contents
2.4 日暴露评估
目前,对PCBs的人体暴露评估常采用PCBs在介质(如食品、灰尘)中的浓度乘以人体对该介质的日摄入量,而将污染物的吸收效率认为100%.有研究表明[4-9],由于污染物在人体肠道吸收率不会达到 100%,这种评估会高估污染物的人体暴露,从而高估污染物的人体暴露风险.
本研究根据实验测定的不同脂肪含量的样品中PCB单体的生物有效性和脂肪之间的线性关系,根据式(3)计算得到每个样品中PCB单体的生物有效性,然后根据式(2)中,C·I项计算每个样品中 PCB单体的生物有效浓度.最后根据式(2)计算上海地区居民通过食品摄入的PCBs,即ADI值,同时也给出不考虑生物有效性(即100%吸收)的 ADI值.结果如表 4所示.从表 4可知,对于PCBs通过这些食品对人体的日暴露,当不考虑生物有效性时,上海地区居民通过猪肉、牛肉、鸡肉、鸭肉、鱼类和软体类食品摄入的PCBs为 1636.4,961.2,619.9,1313.3,18526.2,1382.3 pg/d,当考虑PCBs的生物有效性时,PCBs的摄入量分别为 122.5,66.3,35.2,119.9,4632.6,57.9pg/d,这比前期研究结果稍小[10].可以看出,考虑PCBs的生物有效性后,PCBs的日暴露量下降了75.0%~95.8%.由此可见,在进行暴露评估及相关健康风险评估中,生物有效性所扮演着重要作用.以猪肉和鱼这两种食用量最大的食品为例,鱼类样品中 PCBs的浓度是猪肉样品的12.5倍,即等量食用鱼类的风险是食用猪肉的12.5倍,但是,当考虑PCBs的生物有效性时,鱼类样品中的生物有效性浓度是猪肉样品的41.9倍,即等量食用鱼类的风险是食用猪肉的 40多倍.但是值得注意的是,本实验使用的模拟方法由于仍然缺乏体内消化的许多酶,也未考虑小肠的吸收作用,因此,应谨慎使用得到的生物有效性数据评估人体暴露水平.

表4 不同食品及摄入途径对人体PCBs的日暴露量Table 4 Human daily intake of PCBs via ingestion of food and dust, and inhalation of air
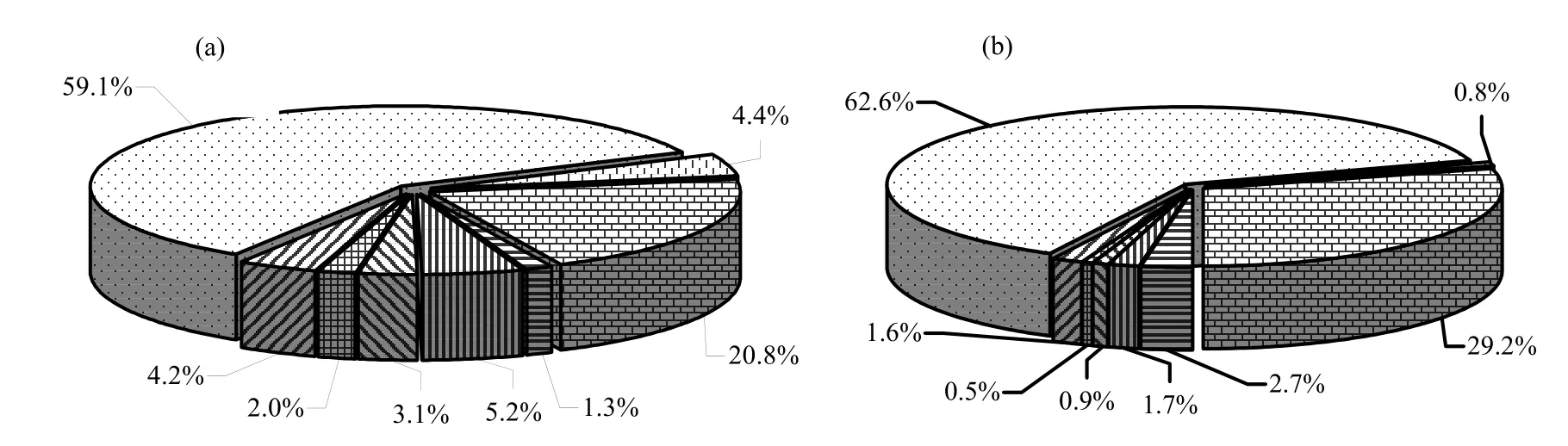
图5 不同暴露源对人体PCBs日暴露贡献Fig.5 Contributions of PCBs via different sources to human daily intake of PCBs
为了评估不同暴露源对人体PCBs暴露的贡 献,引用相关文献数据进行了统计分析.需要说明的是,课题组曾在上海市采集了100多个蔬菜及主食(大米和面粉)样品[20],但是基本没有检测到PCBs(数据未报道),且目前没有上海大气中气态PCBs的浓度报道,为此本研究仅就动物性食品、室内外灰尘和大气中总悬浮颗粒物中的PCBs进行比较,结果见表 4.不同源对 PCBs人体日暴露贡献如图5所示.可以看出,无论是否考虑 PCBs的生物有效性,鱼类是这些暴露源中 PCBs的主要贡献者,其次是室内外灰尘,该结果与文献[2]结果类似.然而需要指出的是,由于采用的样品量有限,猪肉样品都是瘦肉部分,此外,据报道,副食品如油脂类、乳制品类中也含有较高浓度的PCBs[24],文中均没有考虑.因此,有必要在此研究的基础上收集更多的资料,进一步研究各种源中PCBs对该地区人体暴露的贡献.
3 结论
3.1 测定了上海市售动物性食品中 PCBs的浓度水平,98.2%的样品中都检测到PCBs.鱼类样品中 PCBs浓度最高,其中大黄鱼由于其脂肪含量高,PCBs浓度最高,平均为 1502.3pg/g,且最高浓度的PCBs也在大黄鱼中检测到.鸡肉中PCBs的浓度最低,平均为 31.0pg/g.不同鱼类:海水鱼>淡水鱼;肉食性鱼>杂食性鱼>草食性鱼.
3.2 模拟食品在人体胃肠中的消化过程,测定了PCBs的生物有效性,结果表明,食品中的脂肪含量与PCBs生物有效性之间具有显著的线性关系,可以用于计算动物性食品中 PCBs的生物有效性,免去对所有样品中 PCBs生物有效性的测定.PCBs的生物有效性与其logKOW成正相关,即logKOW越大,PCBs的生物有效性越大.
3.3 该地区居民通过食用动物性食品摄入的PCBs为24439.3 pg/d,当考虑PCBs的生物有效性时为5034.5 pg/d,因此,不考虑PCBs的生物有效性将高估PCBs的人体暴露.
3.4 鱼类是PCBs人体暴露的主要贡献者,约占PCBs日暴露的60%.
[1] 周婕成,毕春娟,陈振楼,等.上海崇明岛农田土壤中多氯联苯的残留特征 [J]. 中国环境科学, 2010,30(1):116-120.
[2] Dirtu A, Covaci A. Estimation of daily intact of organohalogenated contaminants from food consumption and indoor dust ingestion in Romania [J]. Environment Science and Technology, 2010, 44(16):6297-6304.
[3] Meng X Z, Zeng E Y, Yu L P, et al. Persistent halogenated hydrocarbons in consumer fish of China: Regional and global implications for human exposure [J]. Environmental Science and Technology, 2007,40(6):1821-1827.
[4] Oomen A G, Hack A, Minekus M, et al. Comparison of five in vitro digestion models to study the bioaccessibility of soil contaminants [J]. Environmental Science and Technology, 2002, 36(15):3326-3334.
[5] Dean J R, Ma R L. Approaches to assess the oral bioaccessibility of persistent organic pollutants: a critical review [J]. Chemosphere, 2007,68(8):1399-1407.
[6] Tang X Y, Tang L, Zhu Y G, et al. Assessment of the bioaccessibility of polycyclic aromatic hydrocarbons in soils from Beijing using an in vitro test [J]. Environmental Pollution, 2006,140(2):279-285.
[7] 崔岩山,陈晓晨,付 瑾.污染土壤中铅、砷的生物可给性研究进展 [J]. 生态环境学报, 2010,19(2):480-486.
[8] 李 莉, 苗明升,丁俊男,等.土壤中锁定残留芘在体外消化系统中的生物可给性 [J]. 生态毒理学报, 2009,4(5):634-640.
[9] 张东平,余应新,张 帆,等.环境污染物对人体生物有效性测定的胃肠模拟研究现状 [J]. 科学通报, 2008,53(21):2537-2545.
[10] 韩姝媛,余应新,李俊岭,等.上海地区肉类和鱼类食品中多氯联苯含量特征及其对人体的生物有效性[J]. 环境科学学报, 2010,30(6):1322-1330.
[11] Xing G H, Yang Y, Chan J K Y, et al. Bioaccessibility of polychlorinated biphenyls in different foods using an in vitro digestion method [J]. Environmental Pollution, 2008,1569(3): 1218-1226.
[12] 陆 敏,余应新,张东平,等.胡萝卜中滴滴涕对人体生物有效性影响因素的体外研究 [J]. 环境化学, 2009,28(2):220-224.
[13] Yu Y X, Li J L, Zhang X Y, et al. Assessment of the bioaccessibility of polybrominated diphenyl ethers in several foods and the correlation of the bioaccessibility with nutrient contents [J]. Journal of Agricultural and Food Chemistry, 2010. 58(1):301-308.
[14] Shen H T, Yu C, Ying Y, et al. Levels and congener profiles of PCDD/Fs, PCBs and PBDEs in seafood from China [J]. Chemosphere, 2009,77(9):1206-1211.
[15] Bocio A, Domingo J L, Falco G, et al. Concentrations of PCDD/PCDFs and PCBs in fish and seafood from the Catalan (Spain) market: estimated human intake [J]. Environment International, 2007,33(2):170-175
[16] Rawn D F, Forsyth D S, Ryan J J, et al. PCB, PCDD and PCDF residues in fin and non-fin fish products from the Canadian retail market 2002 [J]. Science of the Total Environment, 2006,359 (1-3):101-110.
[17] Kelly B C, Ikonomou M G, Blair J D, et al. Food web-specific biomagnifications of persistent organic pollutants [J]. Science, 2007,317(5835):236-239.
[18] Wu J P, Luo X J, Zhang Y, et al. Bioaccumulation of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in wild aquatic species from an electronic waste (e-waste) recycling site in South China [J]. Environment International, 2008,34(8):1109-1113.
[19] Adenugba A A, Mcmartin D W, Beck A J. In vitro approaches to assess bioavailability and human gastrointestinal mobilization of food-borne polychlorinated biphenyls (PCBs) [J]. Journal of Environmental Science and Health, Part B, 2008,43(5):410-421.
[20] 陆 敏.蔬菜中持久性有机污染物的暴露及对人体的生物有效性 [D]. 上海:上海大学, 2009.
[21] 李 琛,余应新,张东平,等.上海室内外灰尘中多氯联苯及其人体暴露评估 [J]. 中国环境科学, 2010,30(4):433-441.
[22] 上海统计年鉴.主要年份城市居民家庭平均每人主要消费品消费量 [EB/OL]. http://www.stats-sh.gov.cn/2003shtj/tjnj/nj09. htm?d1 =2009tjnj/C0919.htm. 2009.
[23] 李欣年,熊幼幼,徐殿斗,等.上海市大气环境中有机卤素污染物的来源及分布规律 [J]. 环境科学, 2007,28(3):466-471.
[24] Kiviranta H, Ovaskainen M L, Vartiainen T. Market basket study on dietary intake of PCDD/Fs, PCBs, and PBDEs in Finland [J]. Environment International, 2004,30(7):923-932.
Concentrations and bioaccessibility of polychlorinated biphenyls in animal-based food collected from markets in Shanghai and assessment of associated human daily intake.
LI Jun-ling1, ZHANG Dong-ping1, YU Ying-xin1*, HAN Shu-yuan1, WU Ming-hong3, SHENG Guo-ying1,2, FU Jia-mo1,2(1.Institute of Environmental Pollution and Health, School of Environmental and Chemical Engineering, Shanghai University, Shanghai 200444, China;2.State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China;3.Shanghai Applied Radiation Institute, School of Environmental and Chemical Engineering, Shanghai University, Shanghai 200444, China). China Environmental Science, 2011,31(6):1019~1028
The concentrations and bioaccessibility of PCBs in animal-based food collected from markets in Shanghai were determined. The associated human daily intake of PCBs was estimated. The concentrations of PCBs ranged from lower than limit of detection to 3734.3 pg/g (wet weight). Tri- to hexa-CBs were the predominant congeners. The PCB concentrations in fish were higher than those in livestock, poultry or shellfish. The following sequences of PCB concentrations in fish were observed: seawater fish > freshwater fish; carnivorous fish > omnivorous fish > herbivorous fish. The bioaccessibility of PCBs were determined via simulating the digestion process in human gastrointestinal tract. The fat contents in animal-based food had a significantly linear correlation with the bioaccessibility of PCBs. Thus the bioaccessibility of PCBs was able to be calculated from the fat contents. The human daily intake via ingestion of animal-based food was 24439.3 pg/d, however, it was reduced to 5034.5 pg/d when the bioaccessibility of PCBs was added to the calculation. Fish was the major contributor to human exposure to PCBs, accounting for 60% of the total PCBs intake coming from food, dust and particulates in the air.
polychlorinated biphenyls;animal food;simulating human gastrointestinal tract;bioaccessibility;daily intake
X32
A
1000-6923(2011)06-1019-10
2010-10-09
国家自然科学基金资助项目(20807026);国家“973”项目(2008CB418205);上海市重点学科项目(S30109)
∗ 责任作者, 副研究员, yuyingxin@staff.shu.edu.cn
李俊岭(1985-),男,河南濮阳人,上海大学环境与化学工程学院环境污染与健康研究所硕士研究生,从事持久性有机污染物对人体的生物有效性研究.发表论文3篇.
