重组 GATA4腺病毒的构建及心肌细胞感染*
2011-12-17胡晓青姜科声周春燕
李 涛, 胡晓青, 姜科声, 周春燕
(1.浙江师范大学化学与生命科学学院,浙江金华 321004;2.北京大学基础医学院生物化学与分子生物学系,北京 100191)
GATA4是调控心脏基因表达的重要转录因子,参与了心脏的正常发育、起搏节律形成、功能基因表达和心肌肥大等生理、病理过程.
小鼠 GATA4的 mRNA早在交配后 7.0~7.5 d便可在胚胎心脏中胚层检测到,并可持续表达,其蛋白质在心脏中胚层和原始心管的表达比心脏特异性收缩蛋白要早 6~12 h[1-2].GATA4缺失的小鼠在胚胎发育第 8~9天因心脏发育畸形和前肠腹侧闭合缺陷而导致死亡,胚胎腹侧不能融合而出现心管分叉,形成双心管[3-4].GATA4在成年鼠中调控多种心脏结构基因,如α-肌球蛋白重链 (α-MHC)、心钠素 (ANF)、脑钠素 (BNP)等[2].GATA4是导致心肌肥大的一个关键性的转录因子[5].机械刺激或体液刺激可通过MAPK和ERK1/2通路激活 GATA4,GATA4与激活蛋白-1(AP-1)和活化 T细胞核因子 (NFAT)首先诱导c-fos和 c-jun表达,继之使胚胎期基因α-MHC,ANF和 BN P表达增加,以及收缩蛋白基因如α-actin及内皮素 (ET-1)等基因表达上调,蛋白合成增加,细胞体积增大[5-7].此外,GATA4亦是重要的心肌抗凋亡分子,在阿霉素、柔毛霉素和氯化汞诱导凋亡时,GATA4被MAPK/ERK通路磷酸化,亲核能力和转录活性增强,降解减慢,能够诱导 Bcl-xL表达,发挥抗凋亡作用[8-12].在 B cl-2基因转录起始位点前 266 bp处含有一个保守的GATA位点,GATA4能够激活 B cl-2表达,通过RNAi抑制乳鼠心肌细胞中 GATA4的表达,则Bcl-2的表达降低 48%[13].
关于 GATA4的功能研究正在逐步深入,但由于原代心肌细胞转染效率低,难以进行常规转基因操作,需要借助于病毒感染等方法实现GATA4在心肌细胞的过表达.本研究构建了 GATA4过表达的重组腺病毒,包装病毒感染原代心肌细胞,从而为深入研究 GATA4的功能、挖掘 GATA4的下游靶基因提供了有力的转基因工具.
1 材料和方法
1.1 材料和试剂
含 GATA4 cDNA全长序列的 pCG-GATA4质粒由加拿大蒙特利尔大学 NemerM教授惠赠.腺病毒穿梭质粒 pAdTrackcmv,骨架质粒pAdEasy-1,JM109菌和BJ5183菌均为北京大学医学院生化系保存.
1.2 质粒构建及 Ad-GATA4腺病毒包装鉴定
使用AdEasy腺病毒载体系统构建重组腺病毒,此系统由去除了 E1和 E3区的缺陷性腺病毒AdEasy-1和穿梭质粒 pAdTrackcmv组成.pCGGATA4质粒经限制性内切酶 XbaⅠ酶切,回收GATA4基因片段,pUC18载体连接.经 B amH Ⅰ和NotⅠ酶双切鉴定插入方向后,将正向插入GATA4基因的 pUC18-GATA4载体行 BamH Ⅰ和SalⅠ双酶切,释放目的片段,与经 B glⅡ和 SalⅠ酶切线性化的 pAdTrack连接,转化挑选克隆后经XbaⅠ酶切鉴定.正确插入目的片段的pAdTrackcmv-GATA4穿梭质粒用 Pm eⅠ进行线性化并经凝胶回收,再转入到携带腺病毒骨架载体 pAdEasy-1的 E.coli.BJ5183菌株进行细菌内重组.利用卡那霉素抗性和 PacⅠ酶切鉴定,获得重组正确的 pAd-GATA4腺病毒质粒.提取质粒DNA后,PacⅠ酶切线性化,按照 lipofectamine 2000说明书转入 293A细胞中进行病毒包装.分别于感染后 2,4,7,14 d在荧光显微镜下连续观察病毒噬斑的变化;14 d后收集细胞,液氮反复冻融细胞 4次,1 000 r/min离心 10 min后收集上清液.利用收集的病毒重复感染 293A细胞扩增病毒.倍比稀释后感染 293A细胞,24 h后荧光显微镜观察,按发荧光细胞数 ×稀释度 /病毒液体积计算病毒滴度.对照病毒为北京大学医学院生化系既往构建.
1.3 Western blot检测 GATA4表达
重组 Ad-GATA4腺病毒的鉴定:HeLa细胞接种于 24孔板上,培养过夜后分别加入 100感染复数(multiplicity of infection,MO I)的病毒液,48 h后弃培养液,提取蛋白,BCA(Bicinchoninic acid)法蛋白定量.30μg蛋白样本中加入 2×上样缓冲液,煮沸后,12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE),电转膜,5%脱脂奶粉封闭1 h后加入抗 GATA4或抗 GAPDH抗体 (体积比1∶1 000)进行杂交,辣根过氧化物酶 (HRP)标记的二抗以1∶2 000稀释,用化学发光法进行显色.同样的方法对乳鼠心肌细胞病毒感染后进行检测.蛋白条带经灰度扫描后由Multi Gauge软件(v3.0)进行半定量分析.
1.4 乳鼠心肌细胞离体培养及感染
出生 1~3 d的大鼠,无菌操作下取出心脏,剪除心房,将心室放于含 0.1%胰蛋白酶和0.05% Ⅰ型胶原酶的消化液中,剪碎后置于 4℃冰箱消化 1 h,离心,加入含 5%胎牛血清的DMEM高糖培养基制成细胞悬液,以差速贴壁法取心肌细胞,将细胞密度调至 5×105~6×105细胞 /mL,接种于 12孔板中,37℃,5%CO2,继续培养至 24 h后见细胞搏动.
待细胞稳定生长 24~48 h后,感染不同MO I的腺病毒,24 h后荧光显微镜下观察细胞绿色荧光表达效率和细胞形态变化,选择最适感染剂量.Hoechst 33342复染 1 h显示细胞核的形态,Olympus FV1000激光共聚焦显微镜下随机选取 5个视野拍照,随机选择 5~10个细胞测量发光心肌细胞的表面积.
1.5 实时定量聚合酶链反应 (Real-time PCR)
按照 Trizol试剂说明书提取细胞的总 RNA,取 4μg经 AMV逆转录酶逆转录成 cDNA作为PCR的模板.将 4μg总 RNA与 2μL随机引物溶液 (0.5μg/μL)混合,加焦碳酸二乙酯 (DEPC)处理水补足至终体积为12.5μL,70℃水浴变性5 min,置冰上 5 min.每管中再加入下列试剂:4μL反应缓冲液,2μL三磷酸脱氧核苷酸(dNTP)溶液 (10 mmol/L),0.5μL核糖核酸酶抑制剂 (RNasin)溶液 (40 U/μL),1μL AMV溶液(200 U/μL),加 DEPC处理水补足至 20μL后混匀,轻微离心,37℃反应 1 h,70℃灭活 5 min,离心 1 min,-80℃保存备用.采用 TOYOBO公司的SYBR Green Real-time PCR MasterMix在AB I7700型定量 PCR仪上进行 PCR反应.反应体系如下:7.5μL 2×SYBR Green Master Mix buffer试剂,0.25μL正向引物溶液 (10 pmol/μL),0.25μL反向引物溶液 (10 pmol/μL),1μL cDNA模板溶液,灭菌去离子水补足至 15μL.PCR反应条件:95℃变性 10 min,95℃15 s,60℃ 1 min,40循环.测定样品的循环阈值 (Cycle threshold,Ct),通过计算 2-ΔΔCt比较不同样品之间特定基因的表达AN F基 因 正 向 引 物 为 5′-ATCTGATGGATTTCAAGAACC-3′,反 向 引 物 为 5′-CTCTGAGACGGGTTGACTTC-3′;GAPDH基因正向引物为 5′-GCACCACCAACTGCTTAGC-3′,反向引物为5′-TCTTCTGGGTGGCAGTGATG-3′.
1.6 统计方法
数据以 x ±s表示,采用 SPSS 13.0统计软件进行 t检验和单因素方差分析.
2 结 果
2.1 重组 GATA4腺病毒质粒的构建及鉴定
pCG-GATA4质粒经 XbaⅠ单酶切后释放2.6 kb的 GATA4表达片段,在紫外灯下切下该片段,与 XbaⅠ单酶切的 pUC18载体连接.由于GATA4编码基因于 350 bp左右处含一内源 N otⅠ酶切位点,因此由 B amH Ⅰ和 N otⅠ双酶切判别GATA4基因在 pUC18载体中的插入方向,正向插入的重组质粒经双酶切将释放一约 350 bp的片段,反向插入将释放一约 2.2 kb的片段.因此,经鉴定 4号克隆为正向克隆 (见图 1(a)).将克隆方向正确的 pUC18-GATA4质粒经 B amHⅠ和SalⅠ双酶切释放 GATA4基因片段;同时,将pAdTrackcmv骨架质粒使用 B glⅡ和 SalⅠ双酶切,使其线性化,同样在紫外灯下切下该片段.上述DNA片段均经凝胶回收、连接、转化至 JM109感受态细菌中,过夜培养挑选克隆,继续培养单克隆转化菌,小量提取质粒 DNA.
为了鉴定 GATA4片段是否插入 pAdTrackcmv骨架质粒中,需要进行酶切鉴定.由于 pAdTrackcmv-GATA4质粒中 BglⅡ位点已遭破坏,故使用GATA4片段内部酶切位点 XbaⅠ进行鉴定.质粒经 XbaⅠ酶切后鉴定结果如图 1(b)所示,可知:克隆 2,3,4均为正确插入 GATA4片段的克隆.
pAdTrackcmv-GATA4经 Pm eⅠ线性化,转入事先转入腺病毒骨架质粒 pAdEasy-1的 BJ5183菌进行同源重组,经卡那霉素筛选,重组克隆经PacⅠ酶切鉴定.正确重组的质粒可切出 3.0或4.5 kb的片段.酶切结果见图 1(c),阳性克隆切 出 4.5 kb的片段,pAd-GATA4质粒构建成功.
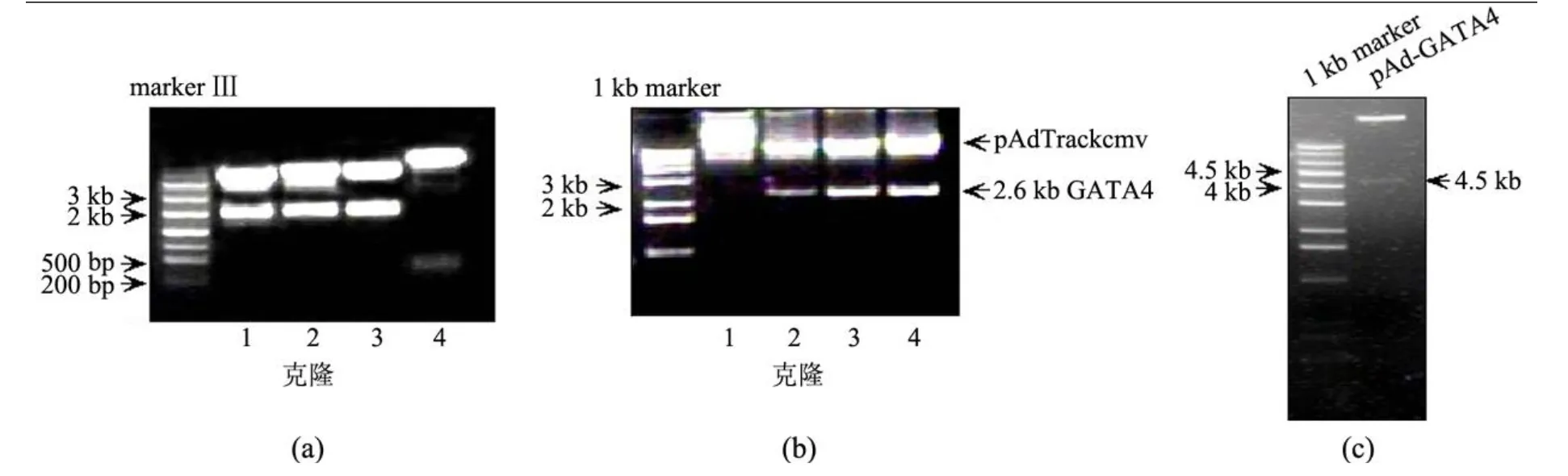
图 1 pAd-GATA4质粒的构建及鉴定
2.2 重组 GATA4腺病毒的包装
将经过 PacⅠ线性化的 pAd-GATA4质粒转染 293A细胞进行包装.转染后荧光显微镜下观察病毒噬斑:2 d起逐步出现噬斑;14 d后有大量的病毒噬斑形成 (见图 2),293A大量表达增强型绿色荧光蛋白 (EGFP),形态变圆并且呈漂浮状态.此时收获细胞裂解后继续感染 293A细胞,扩增病毒,倍比稀释法测定病毒滴度,重组Ad-GATA4滴度为 6×1011efu/mL.
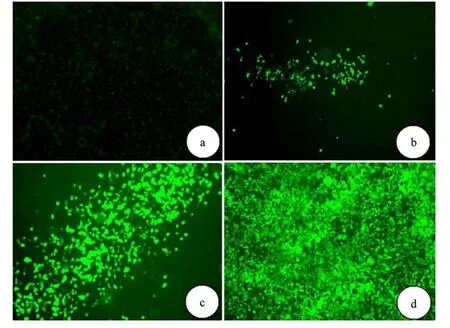
图 2 原代病毒包装
2.3 GATA4重组腺病毒的鉴定
为了进一步对 Ad-GATA4腺病毒进行鉴定,将 Ad-GATA4腺病毒感染无内源性 GATA4表达的 HeLa细胞,并通过蛋白质印迹法 (Western blot)检测发现 GATA4的表达 (见图 3),而未感染病毒的 HeLa细胞及感染对照病毒的细胞均未检测到 GATA4表达.

图 3 Western blot法检测 GATA4蛋白表达
2.4 GATA4重组腺病毒感染乳鼠心肌细胞
胰酶消化和差速贴壁法分离乳鼠心肌细胞,细胞形态呈短杆分支状,有自发搏动.原代乳鼠心肌细胞生长 24~48 h,状态稳定后按MO I为 100的病毒量感染乳鼠心肌细胞,激光共聚焦显微镜观察发现 80%以上的细胞表达 EGFP,发光细胞形态清晰,表明感染成功,且结果显示 Ad-GATA4诱导心肌细胞表面积明显增加,肌纤维更加丰富(见图 4).随机挑选视野测定细胞表面积,对照病毒感染的心肌细胞表面积为 (360±104)μm2,感染 GATA4病毒的心肌细胞表面积为 (489±124)μm2(见图 5(a)).提取蛋白检测发现,Ad-GATA4感染后心肌细胞 GATA4蛋白表达上升 2.3倍(P<0.01.见图 5(b)).提取 RNA进行实时定量PCR检测 GATA4下游基因 ANF表达,以 GAPDH作为内参,结果显示 Ad-GATA4组 ANF表达明显增强,比 Ad-Con组高 6倍 (P<0.01.见图 5(c)).这些结果表明 Ad-GATA4腺病毒成功感染大鼠心肌并诱导了其心肌肥大表型的出现.

图 4 Ad-GATA4感染乳鼠心肌细胞激光共聚焦显微镜观察图
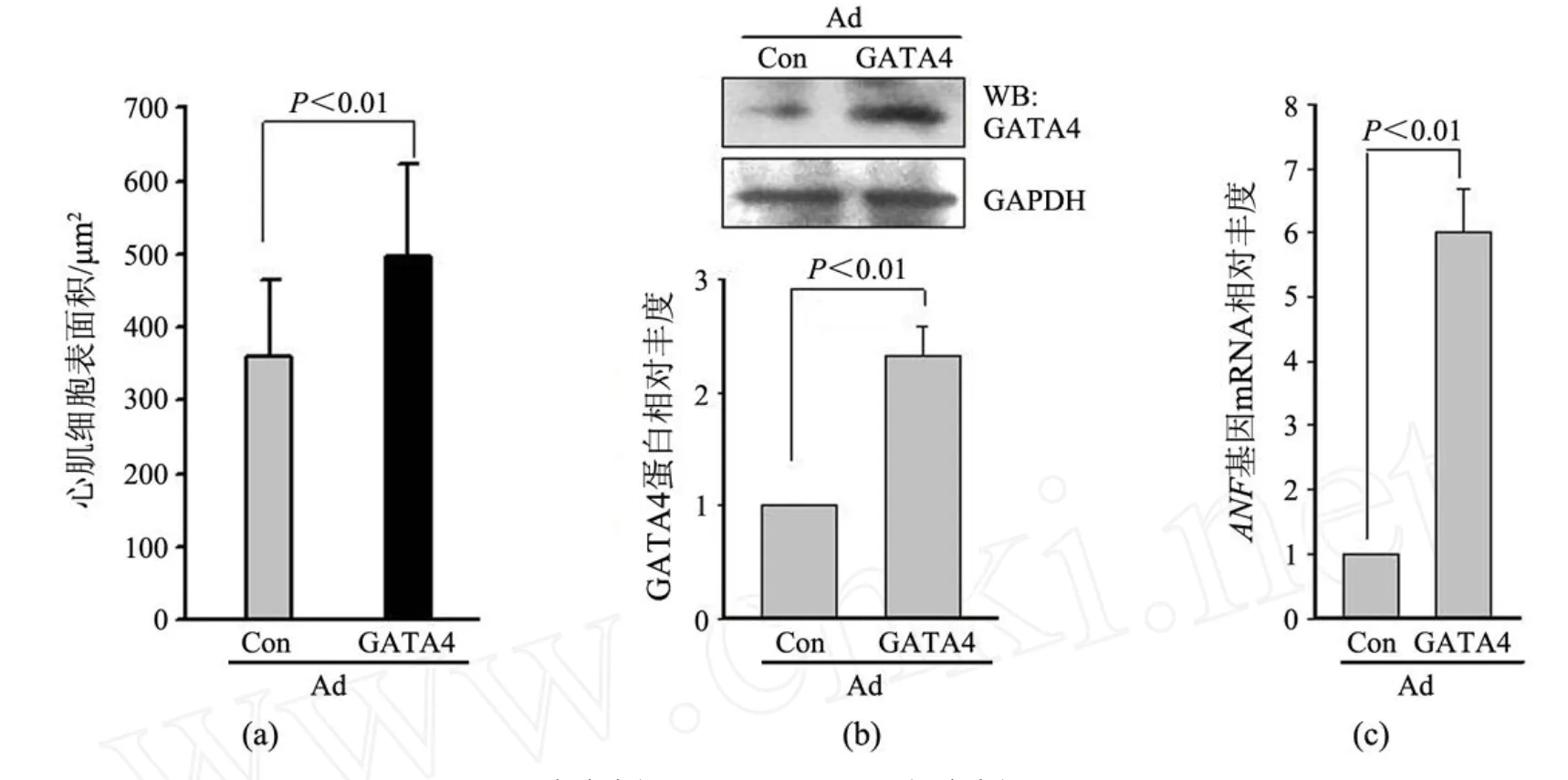
图 5 乳鼠心肌细胞肥大指标的检测
3 讨 论
由于常规方法如磷酸钙、脂质体法转染原代心肌细胞效率低下,逆转录病毒又无法感染非增殖细胞,而携带外源基因的腺病毒或慢病毒则可高效感染非增殖细胞,因而成为研究心肌细胞病理生理变化的有效转基因工具.本实验成功地包装重组 GATA4腺病毒,感染原代乳鼠心肌细胞,并结合 EGFP的表达,可方便有效地检测到细胞呈现肥大表型,细胞表面积增大,心肌胚胎期基因ANF表达增高.
重组 GATA4病毒可应用于多个研究领域,如干细胞向心肌细胞的诱导分化、抗缺血凋亡及心肌梗死后心肌重构与修复、心肌肥大机制研究等.
既往研究认为 GATA4是心肌细胞分化发育的关键基因,GATA4基因缺失可致胚胎死亡,而不同位点的错义突变导致心脏发育畸形,与临床先天性心脏病的发生密切相关.在干细胞诱导分化领域的研究表明,GATA4过表达可促进 P19畸胎瘤干细胞及胚胎干细胞向自发搏动的心肌细胞定向分化[14].骨髓间充质干细胞在体内心肌微环境的诱导下能够分化为心肌细胞,心肌梗死区局部注射能有效改善心功能指标.过表达 GATA4诱导脐带血干细胞及诱导多能干细胞 (iPS cells)向心肌的特异定向分化正在研究之中.如果通过转基因技术转入 GATA4因子或其他心肌关键因子,将可能增加干细胞诱导分化效率[15-17].
心肌细胞凋亡可见于各种心脏疾病,如缺血性心肌梗死、高糖性心肌重构、蒽环类抗癌剂致心肌毒性.GATA4具有较强的抗凋亡作用,可能与其上调抗凋亡基因 Bcl-2和 B cl-xL有关.此外,GATA4亦具有抗内质网应激及调节自噬的作用[18-19].文献 [20]构建了 GATA4与穿膜蛋白VP22的融合蛋白表达载体,稳定转染心肌成纤维细胞,然后注射到左室冠脉前降支结扎模型大鼠的心肌梗死区,移植 6周后,发现能够缩小梗死区面积,诱导周边区代偿性肥大,减轻病理性重构,恢复心功能.本研究构建的重组 GATA4病毒是否有助于改善心肌梗死后的心功能,有待进一步实验研究.
GATA4是一个重要的心肌肥大相关转录因子.心肌肥厚是心肌细胞体积增大而不是心肌细胞增殖,尽管最初的心肌肥厚能够增加损伤心肌的心排出量,但是长期心肌肥厚最终会导致心脏功能丧失代偿而发生心排出量降低,失代偿后发
生心力衰竭,并可发生扩张性心肌病、心肌梗死、心律失常和猝死.因此,确定心脏肥大的分子机制非常重要,将有助于找到预防和治疗的有效措施.实验证明 GATA4的过度表达能诱导心肌肥厚,但机制尚不完全清晰.本研究所构建的重组 GATA4腺病毒提供了良好的转基因工具,将有助于心肌肥大分子机制的研究,挖掘 GATA4下游靶基因.
[1]ArceciR J,KingA A,SimonM C,et al.Mouse GATA-4:a retinoic acid-inducible GATA-binding transcription factor expressed in endodermally derived tissues and heart[J].Mol CellBiol,1993,13(4):2235-2246.
[2]Molkentin J D.The zinc finger-containing transcription factors GATA-4,-5,and-6 ubiquitously expressed regulators of tissue-specific gene expression[J].J Biol Chem,2000,275(50):38949-38952.
[3]Molkentin J D,Lin Q,Duncan SA,et al.Requirement of the transcription factor GATA4 for heart tube formation and ventral morphogenesis[J].GenesDev,1997,11(8):1061-1072.
[4]Kuo C T,Morrisey E E,Anandappa R,et al.GATA4 transcription factor is required for ventral morphogenesis and heart tube for mation[J].GenesDev,1997,11(8):1048-1060.
[5]LiangQ,Molkentin J D.Divergent signaling pathways converge on GATA4 to regulate cardiac hypertrophic gene expression[J].JMolCellCardiol,2002,34(6):611-616.
[6]LiangQ,DeW L,W itt SA,et al.The transcription factors GATA4 and GATA6 regulate cardiomyocyte hypertrophy in vitro and in vivo[J].J Biol Chem,2001,276(32):30245-30253.
[7]Morimoto T,Hasegawa K,Kaburagi S,et al.Phosphorylation of GATA-4 is involved in alpha 1-adrenergic agonist-responsive transcription of the endothelin-1 gene in cardiac myocytes[J].J Biol Chem,2000,275(18):13721-13726.
[8]Suzuki Y J.Stress-induced activation of GATA-4 in cardiac muscle cells[J].Free Radic BiolMed,2003,34(12):1589-1598.
[9]Suzuki Y J,Nagase H,Day R M,et al.GATA-4 regulation ofmyocardial survival in the preconditioned heart[J].J Mol Cell Cardiol,2004,37(6):1195-1203.
[10]Kitta K,Day R M,Kim Y,et al.Hepatocyte growth factor induces GATA-4 phosphorylation and cell survival in cardiac muscle cells[J].J Biol Chem,2003,278(7):4705-4712.
[11]AriesA,Paradis P,Lefebvre C,et al.Essential role of GATA-4 in cell survival and drug-induced cardiotoxicity[J].ProcNatlAcad SciU SA,2004,101(18):6975-6980.
[12]Suzuki Y J,Evans T.Regulation of cardiac myocyte apoptosis by the GATA-4 transcription factor[J].Life Sci,2004,74(15):1829-1838.
[13]Kobayashi S,Lackey T,Huang Y,et al.Transcription factor gata4 regulates cardiac BCL2 gene expression in vitro and in vivo[J].FASEB J,2006,20(6):800-802.
[14]Grepin C,Nemer G,NemerM.Enhanced cardiogenesis in embryonic stem cells overexpressing the GATA-4 transcription factor[J].Development,1997,124(12):2387-2395.
[15]PittengerM F,Martin B J.Mesenchymal stem cells and their potential as cardiac therapeutics[J].Circ Res,2004,95(1):9-20.
[16]Takeuchi J K,Bruneau B G.Directed transdifferentiation ofmouse mesoderm to heart tissue by defined factors[J].Nature,2009,459(7247):708-711.
[17]IedaM,Fu J D,Delgado-Olguin P,et al.Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors[J].Cell,2010,142(3):375-386.
[18]Mao C,TaiW C,Bai Y,et al.In vivo regulation of Grp78/BiP transcription in the embryonic heart:role of the endoplasmic reticulum stress response element and GATA-4[J].J Biol Chem,2006,281(13):8877-8887.
[19]Kobayashi S,Volden P,Timm D,et al.Transcription factor GATA4 inhibits doxorubicin-induced autophagy and cardiomyocyte death[J].J Biol Chem,2010,285(1):793-804.
[20]Bian J,Popovic Z B,Benejam C,et al.Effect of cell-based intercellular delivery of transcription factor GATA4 on ischemic cardiomyopathy[J].Circ Res,2007,100(11):1626-1633.
