猪胆汁中鹅去氧胆酸提取工艺的研究
2011-12-05曹荣安李良玉张丽萍
曹荣安 ,李良玉 ,张丽萍 ,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江农产品加工工程技术研究中心,黑龙江 大庆 163319)
猪胆汁中鹅去氧胆酸提取工艺的研究
曹荣安1,李良玉2,张丽萍1,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江农产品加工工程技术研究中心,黑龙江 大庆 163319)
以提取出胆红素的猪胆粉为原料,研究了反应温度、pH、CaCl2添加量、反应时间对CDCA纯度的影响,实验显示:反应温度为45℃、样品pH为10.5、CaCl2添加量为样品质量的10%、反应时间为2h,鹅去氧胆酸纯度达到47.05%。
猪胆汁;鹅去氧胆酸;提取
鹅去氧胆酸(chenodeoxycholic acid,CDCA),又称3α,7α-二羟基-5β-胆烷酸,是动物体胆汁中的一种生化物质。CDCA为无色针状结晶,无臭、味苦,几乎不溶于水,易溶于乙醇、冰乙酸、微溶于氯仿[1-3],在临床上主要用于治疗胆结石症,尤其对胆固醇胆结石有很好的溶解作用,还具有显著的平喘、抗炎、镇咳和祛痰作用。本研究采用胆红素和胆酸联产工艺方案,以胆汁提取胆红素生产过程中的滤去胆钙盐的母液为原料,采用CaCl2为沉淀剂进行鹅去氧胆酸提取工艺研究[4-8]。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
新鲜猪胆:采购自大庆金锣公司;鹅去氧胆酸标准品:中国药品生物制品检定所;氢氧化钠、氯化钙、盐酸、乙酸乙酯、氨水:均为分析纯,沈阳市华东化学试剂厂。
1.1.2 主要仪器
恒温水浴箱:上海森信实验仪器有限公司;MD100-2电子分析天平:沈阳华腾电子有限公司;烘干箱:天津市泰斯特仪器有限公司;岛津UV-260紫外分光光度计。
1.2 方法
1.2.1 猪胆汁预处理
猪胆汁提取胆红素后剩余的母液烘干成胆粉[9-11]。
1.2.2 实验方案
胆粉→加水→15%NaOH调pH→加氯化钙→水洗沉淀→清液加盐酸调pH→水洗沉淀至中性→烘干→鹅去氧胆酸粗品
1.2.3 CDCA的测定[12-15]
1.2.3.1 标准曲线的绘制
精密量取CDCA标准品12.5 mg,置于25 mL容量瓶中,加入60%醋酸定容,摇匀,精密量取0.2、0.4、0.6、0.8、1.0 mL分别置带塞试管中,用60%醋酸溶液稀释1.0 mL,加1%糠醛溶液1 mL,在冰浴中放置5 min,加硫酸溶液[V(H2SO4):V(H2O)=50:65]13 mL 混匀,在70℃水浴中加热10 min迅速移至冰浴中放置2 min取出,以相应试剂为空白,在380 nm波长处紫外分光光度计测定吸光度,根据吸光光度值绘出标准曲线图,并计算R2值。CDCA测定的标准曲线图见图1。

图1 鹅去氧胆酸标准曲线Fig.1 The standard curve of CDCA determination
1.2.3.2 粗品CDCA的测定
精密称取样品12.5 mg,加60%醋酸液适量,充分搅拌,移入25 mL容量瓶中,残渣再用60%醋酸液搅拌,全部移入容量瓶中并稀释至25 mL,精密量取溶液1 mL,置于试管中加1%糠醛液1 mL,在冰浴中放置5 min,加[V(H2SO4):V(H2O)=50:65]硫酸溶液 13 mL 混匀,在70℃水浴中加热10 min,迅速移至冰浴中放置2 min,取出,以相应试剂为空白,紫外分光光度计在380 nm波长处测定吸光度,根据吸光度计算样品中CDCA的含量。
2 结果与讨论
2.1 反应温度对CDCA纯度的影响
准确称取5份10 g胆粉加50 mL蒸馏水,用15%的NaOH调pH至10.5,CaCl2添加量为10%,设置反应温度为 35、40、45、50、55 ℃ 5 个水平,反应时间 1 h,再根据实验方案进行水洗、调pH和烘干处理。测定胆粉中CDCA的含量,根据所得数据绘制出水浴温度与CDCA纯度的关系图,见图2。

图2 反应温度与鹅去氧胆酸纯度关系图Fig.2 The relation between different temperature and the purity of CDCA
由图2可以看出,随着反应温度的升高CDCA纯度显著提高(p<0.05),当温度为45℃时CDCA纯度最高。这是由于温度在低于45℃时,反应不完全;温度高于45℃时可能是分子运动过于活跃,不容易形成胆酸钙盐,因此选择40、45、50℃为提取CDCA的最佳反应温度。
2.2 样品pH对CDCA纯度的影响
准确称取5份10 g胆粉加50 mL蒸馏水,用15%的 NaOH 分别把样品 pH 调至 8.5、9.5、10.5、11.5、12.55个水平,CaCl2添加量为10%,50℃水浴1 h,再根据实验方案进行水洗、调pH和烘干处理。测定胆粉中CDCA的含量,根据所得数据绘制出样品pH与CDCA纯度的关系图,见图3。

图3 样品pH与鹅去氧胆酸纯度关系图Fig.3 The relation between different pH and the purity of CDCA
由图3可以看出,随着pH值的增加CDCA的纯度显著提高(p<0.05),在pH为10.5时CDCA纯度最高,之后随着pH的增加CDCD纯度显著降低(p<0.05)。这是由于胆酸在碱性条件溶解度较大,随着pH的升高溶解度逐渐增加,但在pH达到10.5后胆酸分子遭到破坏使胆酸含量降低。因此9.5、10.5、11.5为提取CDCA的最佳pH。
2.3 CaCl2添加量对CDCA纯度的影响
准确称取5份10 g胆粉加50 mL蒸馏水,用15%的NaOH调pH至10.5,CaCl2添加量为6%、8%、10%、12%、14%5个水平,在50℃下水浴处理时间1 h,再根据实验方案进行水洗、调pH和烘干处理。测定胆粉中CDCA的含量,绘制出CaCl2添加量与CDCA纯度的关系图,见图4。
由图4可以看出,添加量为6%~8%时CDCA纯度显著提高(p<0.05),10%时 CDCA 的纯度最高,添加量高于12%纯度提高趋于平缓,差异不显著(p>0.05)。因此,添加8%、10%、12%时为提取CDCA的CaCl2最佳添加量。
2.4 反应时间对CDCA纯度的影响

图4 氯化钙添加量与鹅去氧胆酸纯度的关系图Fig.4 The relation between CaCl2and the purity of CDCA
准确称取5份10 g胆粉加50 mL蒸馏水,用15%的NaOH调pH至10.5,CaCl2添加量为10%,水浴温度为 50 ℃,分别选择反应时间为 0.5、1.0、1.5、2.0、2.5 h,再根据实验方案进行水洗、调pH和烘干处理。测定胆粉中CDCA的含量,根据所得数据绘制出反应时间与CDCA纯度的关系曲线图,见图5。

图5 氯化钙反应时间与鹅去氧胆酸纯度的关系图Fig.5 The relation between different time and the purity of CDCA
由图5可以看出,随着反应时间的增加CDCA纯度显著提高(p<0.05),反应时间为2 h时CDCA纯度最高,之后随着反应时间的增加CDCA纯度显著下降(p<0.05)。反应时间小于2 h时,反应不完全;反应时间大于2 h时,由于时间过长使胆酸分子遭到破坏,CDCA纯度降低。因此2 h为提取CDCA的最佳反应时间。
2.5 CDCA提取正交试验
根据单因素试验结果进行正交试验,因素水平表见表1,正交试验结果见表2。

表1 因素水平表Table 1 The table of factor levels
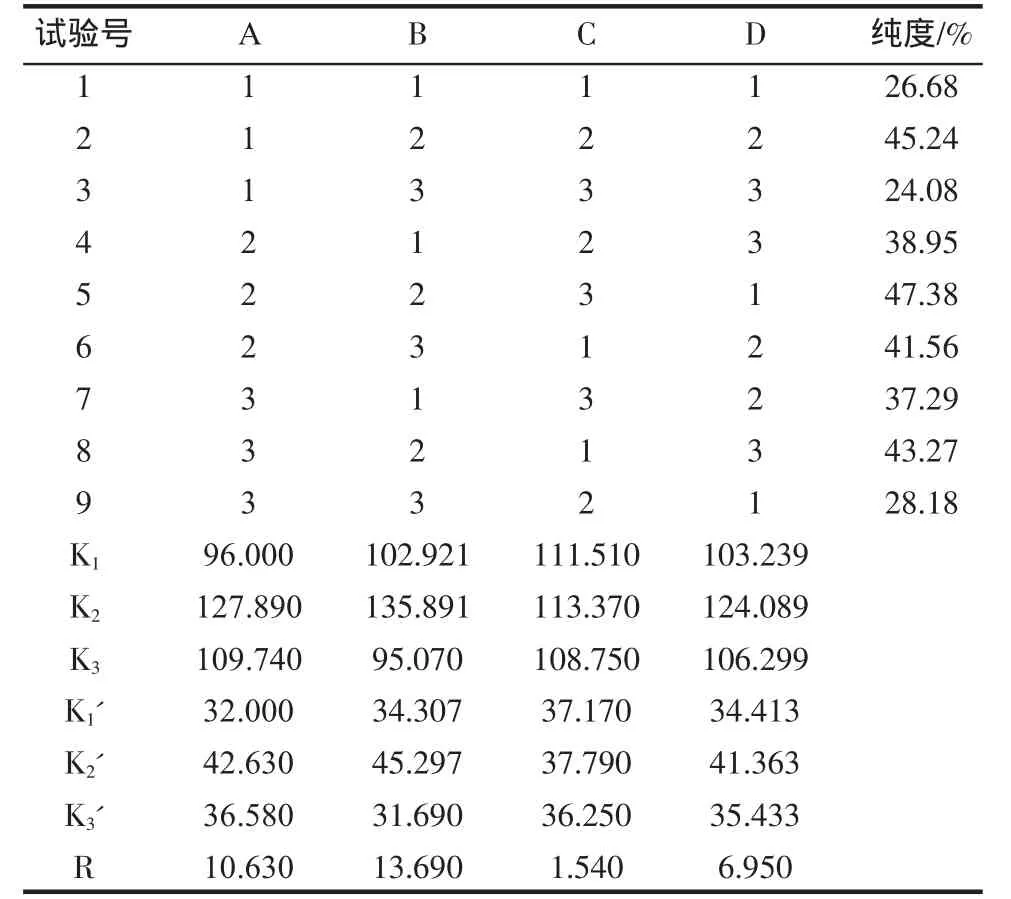
表2 正交试验结果表Table 2 Scheme and results of regression orthogonal rotary design
根据试验结果进行方差分析见表3,结果显示:A因素F值为47.330,大于在0.05水平上的F统计量的值,因此因素A(反应温度)对试验的影响显著(p<0.05);B因素F值为99.256,大于在0.01水平上的F统计量的值,因此因素B(样品pH)对试验的影响极显著(p<0.01);D 因素 F值为23.448,大于在 0.05水平上的F统计量的值,因此因素D(反应时间)对试验的影响显著(p<0.05)。为确定最佳的工艺参数对因素A、B、D进行多重比较,见表4~表7。

表3 方差分析表Table 3 The table of ANOVA

表4 多重比较SSR及LSR值表Table 4 The SSR and LSR of multiple comparison

表5 反应温度多重比较Table 5 The multiple comparison of temperature
由表5可以看出,A因素K2-K3=6.050>LSR0.05=4.0876,所以 A2,A3差异显著,因此 A2最好。

表6 样品pH多重比较Table 6 The multiple comparison of pH
由表6可以看出,B因素K2-K3=10.99>LSR0.01=9.3970,所以 B2,B1差异显著,因此 B2最好。

表7 反应时间因素多重比较Table 7 The multiple comparison of time
由表7可以看出,B因素K2-K3=5.930>LSR0.05=4.0876,所以 D2,D3差异显著,因此 D2最好。
由于C因素对试验影响较小,所以选择低能耗的C1(8%)。经多重比较分析后,最佳的工艺参数为A2B2C1D2,即为:反应温度为50℃,样品pH为10.5,CaCl2添加量为8%,反应时间为2.0 h。用正交试验得出的最佳工艺参数A2B2C1D2作验证试验,设平行样3组,以提取率为指标,结果显CDCA的平均纯度为47.05%,且重复实验相对偏差不超过2%,说明试验条件重现性良好。
3 结论
通过以上试验数据证明,在单因素的基础上以CDCA纯度为指标,对反应温度、pH、CaCl2添加量、反应时间4个因素进行L9(43)正交试验。确定出最佳提取条件:反应温度为45℃,样品pH为10.5,CaCl2添加量为8%,反应时间为2.0 h,纯度达到47.05%。
采用CaCl2为沉淀剂提取CDCA的方法研究猪胆汁中CDCA的提取工艺,通过正交试验得到了最佳的提取工艺条件,为对动物胆汁进行提取纯化及加工生产开辟了一条新的切实可行的途径;其工艺简单易行,适合工业化生产;同时也达到了进一步提高畜禽副产物附加值的作用。
[1]潘现军.从猪胆膏中分离纯化鹅去氧胆酸的新工艺[J].河北医药,2006,28(2):147-148
[2]都丽莉.具有开发价值的动物胆汁的药用研究[J].中国医学学报,2000,15(1):27-28
[3]郝丽莉,赵文静.动物胆汁的药用研究[J].中国民族民间医药杂志,1999,(40):279-280
[4]张天民.动物生化制药学[M].北京:北京人民出版社,1981:259-266
[5]张宗信,盖雪.动物胆汁药的应用[J].河北医学,2006,12(2):191-192
[6]郭文.胆汁酸代谢的进展[J].国外医学生理病理科学与临床分册,1996,16(1):18-20
[7]陈怀庆,谭子平.猪胆汁中胆红素和胆酸含量的测定[J].时珍国医国药,2001,12(40):315-334
[8]王有同,吴文俊.CDCA的制备[J].农副产品加工,1995,13(2):39-40
[9]高玉琼,刘建华.CDCA制备新工艺[J].中国生化药物杂志,1996,17(1):17-18
[10]罗小明,吴思维.猪胆汁中CDCA的提取[J].重庆广播电视大学学报,1999,9(5):46-48
[11]吕军,赵松华.HDCA精品的生产工艺[J].中国药业,1999,4(1):27-28
[12]丁新腾.从猪胆汁提取鹅去氧胆酸及猪胆酸[J].医药工业,1987,18(9):416
[13]吴健.猪胆汁中胆酸的分离研究[J].贵阳医学院学报,1991,16(1):50-51
[14]张德桐,张能容.鸡胆汁与蛇胆汁组分的对比研究[J].中国生化药物杂志,1994,15(10):4-7
[15]吴健.猪胆汁中胆酸的分离研究[J].贵阳医学院学报,1991,16(1):50-51
Study on the Extraction Technology of Chenodeoxycholic Acid from Porcine Bile
CAO Rong-an1,LI Liang-yu2,ZHANG Li-ping1,*
(1.Heilongjiang August First Agricultural Reclamation University Food College,Daqing 163319,Heilongjiang,China;2.HLJ Agricultural Food Process Engineering and Technological Research Center,Daqing 163319,Heilongjiang,China)
This experimental uses the production which is extracted bilirubin,selects temperature,pH,concentration of CaCl2and time as the factors.The result shows that the optimal extraction method is temperature 45℃,pH 10.5,concentration of CaCl210%,time 2 h.The purity of CDCA is 47.05%.
porcine bile;CDCA;extraction
黑龙江省农垦总局《大鹅系列快餐化食品及其副产物综合利用技术研究》(HNKXIV-08-11)
曹荣安(1980—),男(汉),讲师,硕士,研究方向:畜产品加工。*通信作者
2010-08-06
