单缩二氨基硫脲的微波合成及其抗菌活性*
2011-11-26杨学军石治川赵志刚
杨学军, 石治川, 赵志刚
(西南民族大学 化学与环境保护工程学院,四川 成都 610041)
研究表明,硫脲及其衍生物具有抗菌、抗病毒、抗肿瘤、抗疟疾等广泛的生物活性[1~4]。其中以双缩二氨基硫脲或者取代氨基硫脲衍生物居多,单缩二氨基硫脲则少见报道[5,6]。因此设计合成新的单缩二氨基硫脲用于各种药物开发并且与其他硫脲衍生物进行比较具有重要的理论和现实意义。
微波反应是绿色合成方法之一[7,8],本课题组[9,10]应用微波技术合成硫脲衍生物的研究已经取得了相当的进展。
本文在微波辐射下,设计并合成了9个未见文献报道的单缩二氨基硫脲化合物(1a~1i, Scheme 1),其结构经1H NMR, IR, ESI-MS和元素分析表征。初步生物活性测试结果表明,1对大肠杆菌具有较好的抑制作用。
1 实验部分
1.1 仪器与试剂
X-4型数字显示显微熔点仪(温度未校正);Varian INOVA-400 MHz型核磁共振仪(DMSO-d6作溶剂,TMS作内标);PE 1700型傅立叶变换红外光谱仪(KBr压片);FINNIGAN-LCQ型质谱仪;Carlo-Erba-1106型元素分析仪;北京祥鹤科技有限公司商用微波反应器(XH-100A)。
所用试剂均为分析纯。
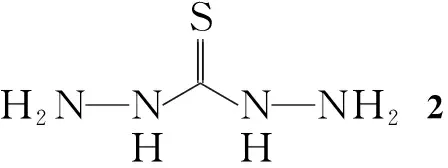
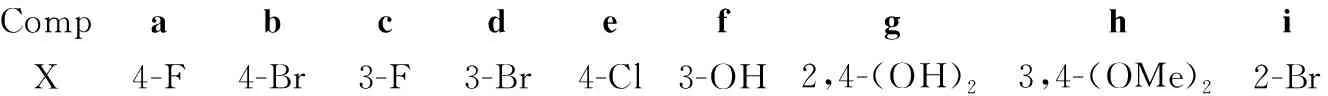
Scheme1
1.2 合成
(1) 1,3-二氨基硫脲(2)的合成
在三颈瓶中加入80%水合肼80 mL和2-氯乙醇3 mL,冰浴冷却,搅拌下缓慢滴加CS230 mL,滴毕,反应3 h(有黄色固体生成);加入NaOH 3 g,于80 ℃反应8 h。冷却至室温,抽滤,滤饼用水重结晶得无色针状晶体2,收率84%, m.p.171 ℃~172 ℃(170 ℃~172 ℃[11])。
(2) 1的微波合成通法
在三颈瓶中加入水60 mL, 2 1.06 g(10 mmol)和几滴醋酸,搅拌下缓慢加入取代芳香醛(3)(10 mmol)的乙醇溶液50 mL,置微波反应器中,微波辐射(400 W)下回流反应5 min~7 min。冷却析晶,过滤,滤饼用乙醇重结晶得1。
(3) 1的常规合成通法
在三颈瓶中加入水60 mL, 2 1.06 g(10 mmol),加热使其完全溶解后再加几滴醋酸,搅拌下缓慢加入3(10 mmol)的乙醇溶液50 mL,于80 ℃反应6 h~7 h。冷却析晶,过滤,滤饼用乙醇重结晶得1。
1的理化数据,MS和元素分析结果见表1;1H NMR和IR数据见表2。
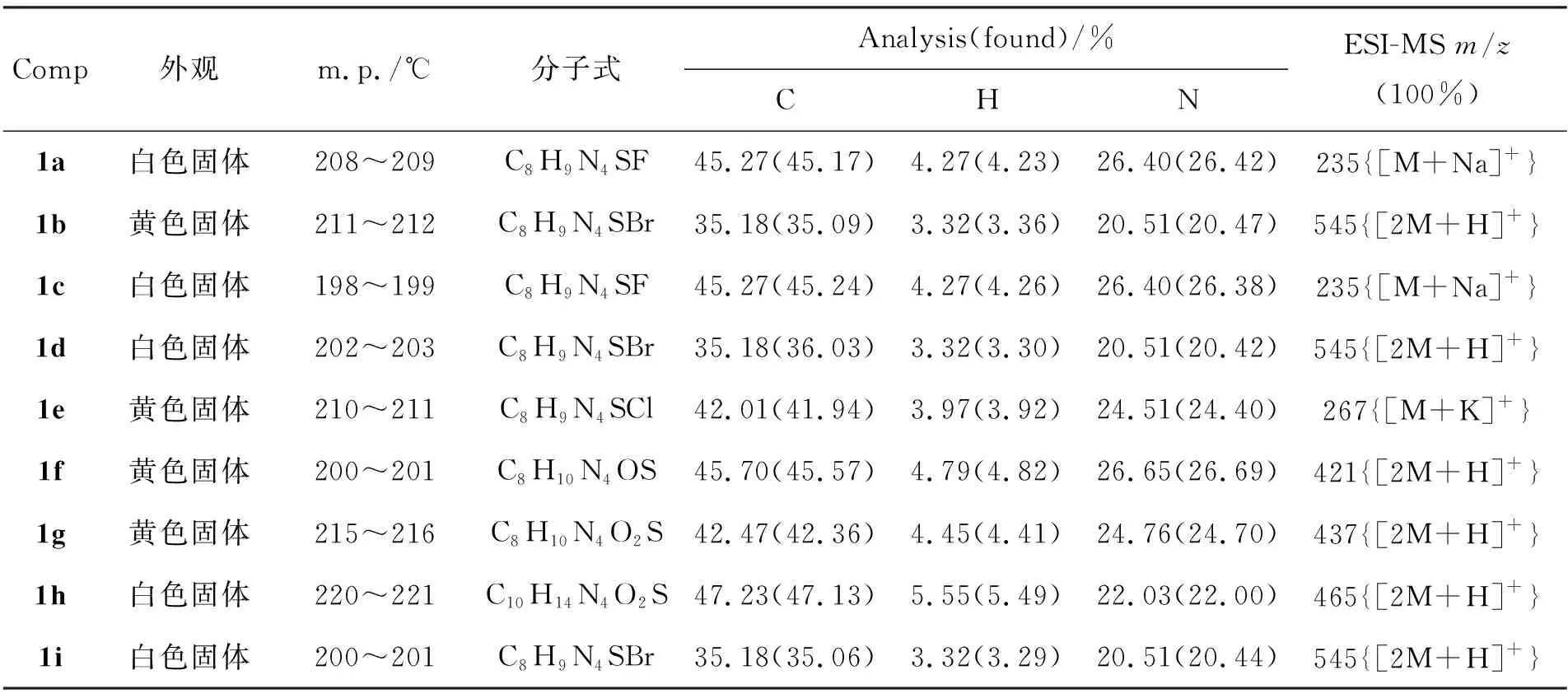
表 1 合成1的实验结果

表 2 1的1H NMR和IR数据

续表2
2 结果与讨论
2.1 微波反应条件的选择
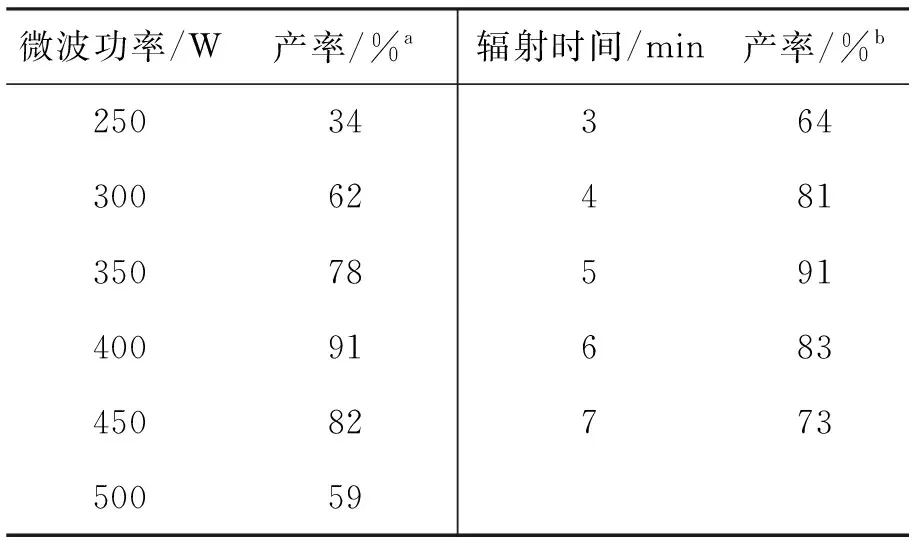
表 3 微波反应条件对合成1a的影响
a微波辐射5 min;b微波功率400 W;其余反应条件同1.2(2)
以合成1a为例,考察了微波功率、辐射时间对产率的影响,结果见表3。从表3可以看出,在400 W下辐射5 min为较佳的反应条件。
2.2 微波合成与常规合成的比较
1的微波合成与常规合成的结果比较见表4。由表4可见,与常规合成方法相比,微波合成具有以下优点: (1)反应速度增大60倍~72倍,极大的缩短了反应时间; (2)产率得到较大提高(微波法87%~95%,常规法47%~62%)。因此微波合成是一种安全、快速、高效的合成单缩二氨基硫脲的好方法。
2.3 1的抗菌活性
采用体外活性测试,抑菌实验采用药物纸片扩散法,培养温度37 ℃,培养时24 h,以抑菌圈直径大小判断抑菌效果。受试菌种为大肠杆菌、金色葡萄球菌和化脓性葡萄球菌。1的抗菌活性测试结果见表5。从表5可以看出,1对大肠杆菌有一定的抑制作用,而对金色葡萄球菌基本抑菌效果一般,对化脓性葡萄球菌的抑菌效果很差,因此1具有选择性抗菌活性。
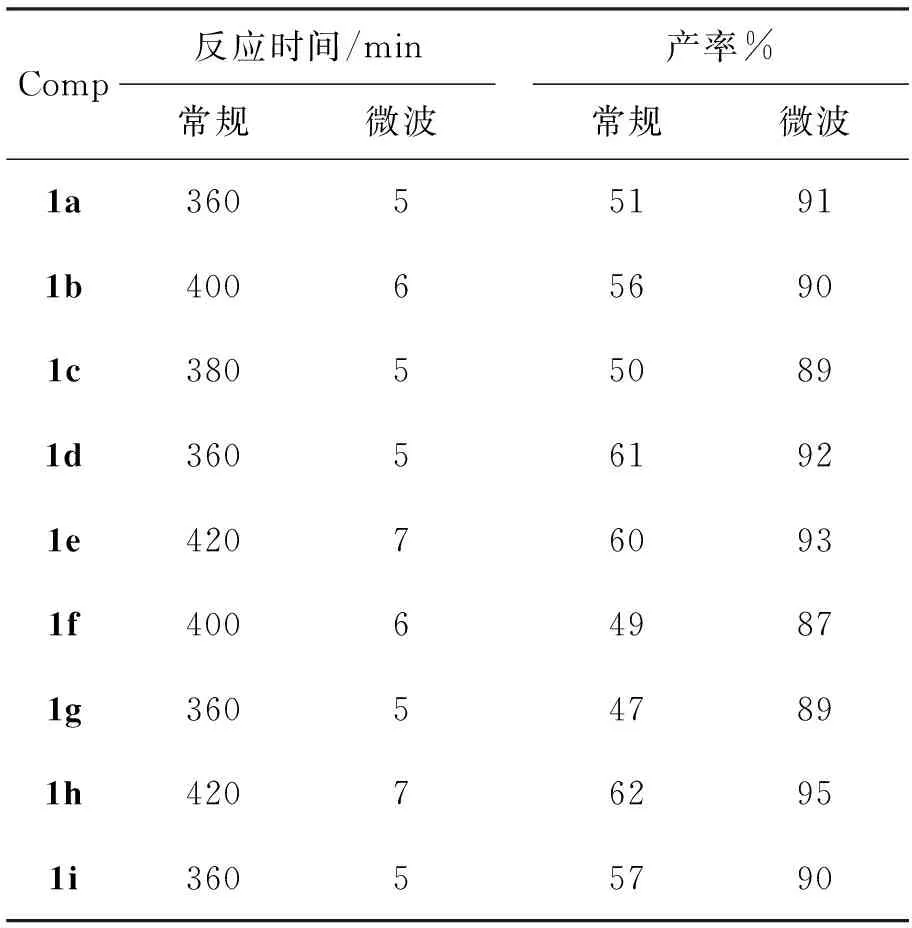
表 4 微波与常规方法合成1的比较*
*微波反应条件同1.2(2); 常规反应条件同1.2(3)
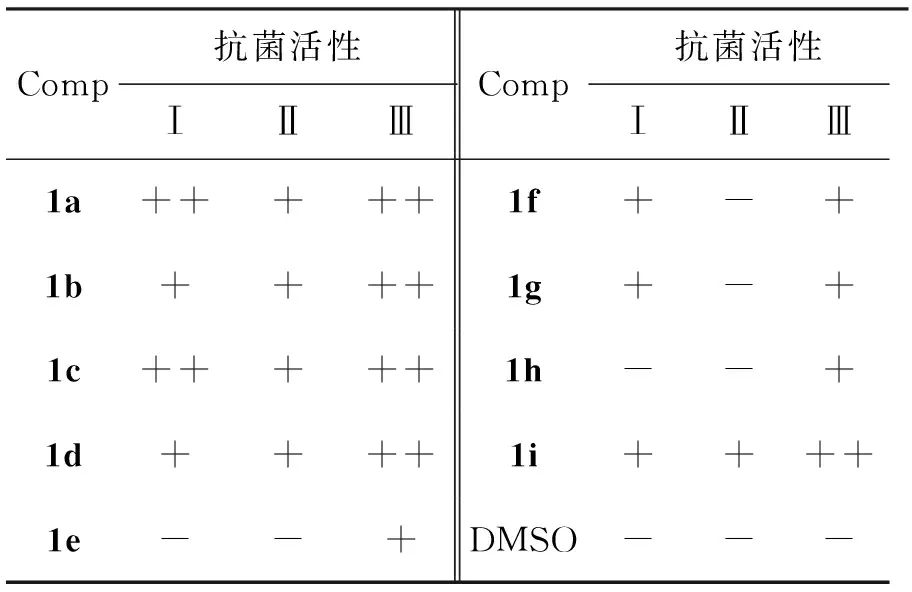
表 5 1的抗菌活性测试结果*
*++: 强, +: 中等, -: 弱或无; Ⅰ: 金色葡萄球菌, Ⅱ: 化脓性葡萄球菌, Ⅲ: 大肠杆菌
[1] Brockman R W, Thomson J R, Bell M J,etal. Observations on the ant leukemic activity of pyridine-2-carboxaldehyde thiosemicarbazone and thiocarbohy drazone[J].Cancer Res,1956,16:167-170.
[2] Bauer D J. A history of the discovery and clinical application of antiviral drugs[J].Br Med Bull,1985,41:309-314.
[3] Yang B, Zhang S S, Li H X. Synthesis and characterization of novel thiosemicarbazones bearing sugar moieties[J].Chem Res Chinese U,2006,22:738-741.
[4] Singh S, Athar F, Azam A. Synthesis spectral studies and in vitro assessment for antiamoebic activity of new cyclooctadiene ruthenium(Ⅱ) complexes with 5-nitrothiophene-2-carboxaldehyde thiosemicarbazones[J].Bioorg Med Chem Lett,2005,15:5424-5428.
[5] Beraldo H, Gambino D. The wide pharmacological versatility of semicarbazones,thiosemicarbazones and their metal complexes[J].Mini Rev Chem,2004,4:31-39.
[6] Reddy K H, Reddy P S, Babu P R. Synthesis,spectral studies and nuclease activity of mixed ligand copper(Ⅱ) complexes of heteroaromatic semicarbazones /thiosemicarbazones and pyridine[J].Inorg Biochem,1999,77:169-176.
[7] Polshettiwar V, Varma R S. Microwave-assisted organic synthesis and transformations using benign reaction media[J].Acc Chem Res,2008,41:629-639.
[8] Katritzky A R, Angrish P. Efficient microwave assisted access to chiralO-(α-protected-aminoacy)steroids[J].Steroids,2006,71:660-669.
[9] 刘玲玲,刘兴利,赵志刚. 萘满酮类缩氨基硫脲的微波无溶剂快速合成[J].化学研究与应用,2010,22(5):660-664.
[10] Shi Z C, Zhao Z G, Liu X L,etal. Synthesis of new hyodeoxycholic acid thiosemicarbazone derivatives under solvent-free conditions using microwave[J].Chin Chem Lett,2011,22(4):405-408.
[11] 李清寒,赵志刚. 不对称双缩二氨基硫脲类化合物的合成及表征[J].西南民族大学学报(自然科学版),2008,34(5):983-984.
