HPLC-ELSD法测定家桑野桑植株中1-脱氧野尻霉素的含量
2011-11-23邓洁丽周光雄
宋 婕,邓洁丽,周光雄
暨南大学药学院中药及天然药物研究所广东省高校中药药效物质基础与创新药物研究重点实验室,广州510632
HPLC-ELSD法测定家桑野桑植株中1-脱氧野尻霉素的含量
宋 婕,邓洁丽,周光雄*
暨南大学药学院中药及天然药物研究所广东省高校中药药效物质基础与创新药物研究重点实验室,广州510632
采用HPLC-ELSD法对桑植株各部位所含的1-脱氧野尻霉素(DNJ)进行了含量测定,使用TSKgel Amide-80(4.6 mm×250 mm,5 μm)色谱柱,流动相为:乙腈-水(84∶16,6.5 mM醋酸铵),流速为1.00 mL/min,柱温:30℃,线性范围为0.505 μg~20.2 μg(r=0.9991,n=6),平均回收率为94.95%(n=5),RSD=1.98。测定结果表明,野桑叶、嫩枝和根皮部位的DNJ含量较高,而家桑的叶、枝皮和根皮中含量较高。本方法准确度高、重现性好,能快速检测桑树资源及类似植物和相关产品中1-脱氧野尻霉素的含量。
1-脱氧野尻霉素;高效液相色谱法;蒸发光散射检测器;桑
桑是我国广泛栽植的经济作物,并且有悠久的用药历史。历代医学古籍都有记载可用桑叶治疗消渴症,现代药理研究表明桑叶具有降血糖的作用,其降血糖活性成分为多羟基生物碱[1],其中主要成分为1-脱氧野尻霉素(1-deoxynojirimycin,简称DNJ),化学名称为3,4,5-三羟基-2羟甲基四氢吡啶。DNJ因结构与糖非常类似,能够竞争性的抑制二糖与α-葡萄糖苷酶的结合,阻止麦芽糖、异麦芽糖、蔗糖等二糖水解为单糖被人体吸收,从而明显降低餐后血糖浓度峰值。DNJ对所有哺乳动物的α-葡萄糖苷酶均有抑制作用[2],能用于治疗II型糖尿病、肥胖症等疾病,并且还具有抗病毒及抗HIV病毒、抗肿瘤转移等作用[3-5],高效低毒,有优越的保健食用及药用价值。而桑的许多部位中均含有DNJ,Yoshiaki等已首次从桑枝及桑白皮中分离出DNJ[6],Asano等也从桑叶和桑葚中分离出DNJ[7]。我国桑树种类繁多,分布广,各地栽培条件及地理气候不同,为了能快速检测桑树各个部位中的DNJ含量,以便对不同产区、品种桑资源的DNJ含量进行分析,使桑树资源得到合理、有效和充分利用,为DNJ产业化应用提供参考,需要建立桑树资源中DNJ含量的测定方法。已有研究人员用HPLC-ESD法分别测定了不同产地的桑叶中DNJ的含量[8],不同地区桑白皮中DNJ的含量[9],本文中使用HPLC-ELSD法,改进了提取方法和液相条件,使得DNJ提取较完全且杂质峰大大减少,对不同品种桑的不同部位、不同产地的桑树资源以及不同采集期得到的桑叶中的DNJ含量均进行了测定和综合分析。
1 仪器、试剂与材料
1.1 仪器
美国Agilent1200高效液相色谱仪:G1329A自动控温进样器,G1311A四元泵,G1316A柱温箱; Allchrom plus色谱工作站,美国Alltech ELSD-2000蒸发光散射检测器。
1.2 试剂
乙腈为色谱纯;732强酸性阳离子树脂为广东时美树脂厂产品;醋酸铵、氨水均为分析纯;水为双重蒸馏水;DNJ为实验室自制(纯度大于98%)。
1.3 材料
野桑样品为暨南大学周光雄教授从安徽省绩溪县采集并经鉴定为野桑品种中的鸡桑(Morus australis)Poir.家桑为白桑(Morus alba L.)。
2 方法
2.1 色谱条件
色谱柱:TSKgel Amide-80(4.6 mm×250 mm,5 μm);流动相:乙腈-水(84∶16,v/v),水中含6.5 mM醋酸铵;流速:1.00 mL/min;柱温:30℃;ELSD漂移管温度:55℃,载气流速:3.2 L/min。进样量10 μL。将对照品及样品按上述色谱条件进行测定,随行外标两点法计算含量。
2.2 供试品溶液的制备
精密称取粉碎至80~100目的桑叶粉末1 g,加入50%乙醇水100 mL,加热回流提取2次,每次2 h,两次提取液过滤合并,旋蒸至无醇味。提取液经过732强酸性阳离子树脂柱处理,用0.5 N氨水洗脱。洗脱液浓缩,过滤,移至5 mL容量瓶,用去离子水定容至刻度,作为供试品溶液,保存在4℃冰箱,临用时经微孔滤膜(0.45 μm)过滤后进样。
2.3 对照品溶液的制备
精密称取DNJ对照品10.10 mg,去离子水溶解,定容至10 mL,摇匀,得1.01 mg/mL对照品溶液。对照品波谱数据:ESI-MS m/z:164.3[M+ H]+,162.5[M-H]-;1H NMR(400 MHz,D2O)δ: 3.87(1H,dd,J=11.6,2.9 Hz,H-2'a),3.68(1H,dd,J=11.7,6.2 Hz,H-2'b),3.54(1H,ddd,J= 10.8,9.0,5.1 Hz,H-5),3.36(1H,t,J=9.0 Hz,H-4),3.28(1H,t,J=9.4 Hz,H-3),3.17(1H,dd,J= 12.3,5.2 Hz,H-6e),2.60(1H,ddd,J=9.4,6.2,3.0 Hz,H-2),2.51(1H,t,J=11.6 Hz,H-6a);13C NMR(100 MHz,D2O)δ:60.0(d,C-2),60.9(t,C-2'),71.0(d,C-3),77.9(d,C-4),70.4(d,C-5),48.2(t,C-6).
2.4 标准曲线的建立
取DNJ对照品溶液,分别进样0.5、0.8、2.5、4.0、12.5和20 μL,依照上述色谱条件测定。以峰面积的对数作为纵坐标,以进样量的对数作为横坐标,进行线性回归,回归方程为:y=1.3325x+ 5.4437(r=0.9991,n=6)。结果表明,DNJ在0.505 μg~20.2 μg范围内呈现良好的线性关系。按5倍噪音计算检测限为0.303 μg/mL。
2.5 精密度试验
在色谱条件不变的情况下,将DNJ对照品溶液连续进样五针,每次进样10 μL,考察仪器的精密度,计算峰面积RSD。
2.6 稳定性实验
取同一份桑叶的供试品溶液(野桑1号叶,记为WML-1)分别在第0、5、10、15、20、30日进样,每次进样10 μL,按上述色谱条件测定,考察其稳定性。
2.7 重现性实验
依照供试品溶液制备方法平行制备5份WML-1供试品溶液,分别进样10 μL,按上述色谱条件并随行外标两点法测定WML-1中DNJ的含量。
2.8 加样回收率实验
精密称取5份已知含量的WML-1粉末约1 g,分别加入2.14 mg/mL的DNJ对照品溶液1 mL,按2.2项供试品溶液制备方法制备溶液,再按上述色谱条件测定含量。
2.9 样品测定:
取野桑植株1号中的叶、枝皮、枝木质部、嫩枝(一年生)、根皮、根木质部粉末;野桑植株2号中的老根根皮(三年以上)、根木质部粉末;野桑植株3号中的叶、枝皮、嫩枝木质部、嫩茎、老茎木质部(两年以上)、根皮粉末;家桑植株1号中的叶、枝皮、枝木质部粉末;家桑植株2号中的枝、枝皮粉末;家桑植株3号中的枝皮和枝木质部,根皮和根木质部粉末分别进行测定,另外还对不同产地的桑椹、桑白皮和桑叶(白桑,M.alba)粉末以及不同时间采集的桑叶(白桑,M.alba)粉末,按2.2项供试品溶液制备方法制备,再分别进行测定。
3 实验结果与讨论
3.1 实验结果
3.1.1 对照品及样品色谱图
3.1.2 精密度
根据实验结果计算峰面积RSD为1.77%。
3.1.3 稳定性

图1 DNJ对照品色谱图Fig.1 HPLC chromatogram of DNJ

图2 样品WML-1谱图Fig.2 HPLC chromatogram of WML-1
测定结果表明在4℃条件下保存,样品在30天内稳定,峰面积RSD=3.73%(n=6)。
3.1.4 重现性
测得WML-1中DNJ平均含量为0.2316%,RSD=1.24%(n=5),结果表明本方法重现性良好。
3.1.5 加样回收率
结果见表1,测得样品加样回收率的平均值为94.55%,RSD=1.99%(n=5)。

表1 DNJ的加样回收率Table 1 Recovery rate of DNJ
3.1.6 样品测定结果
结果见表2~5。
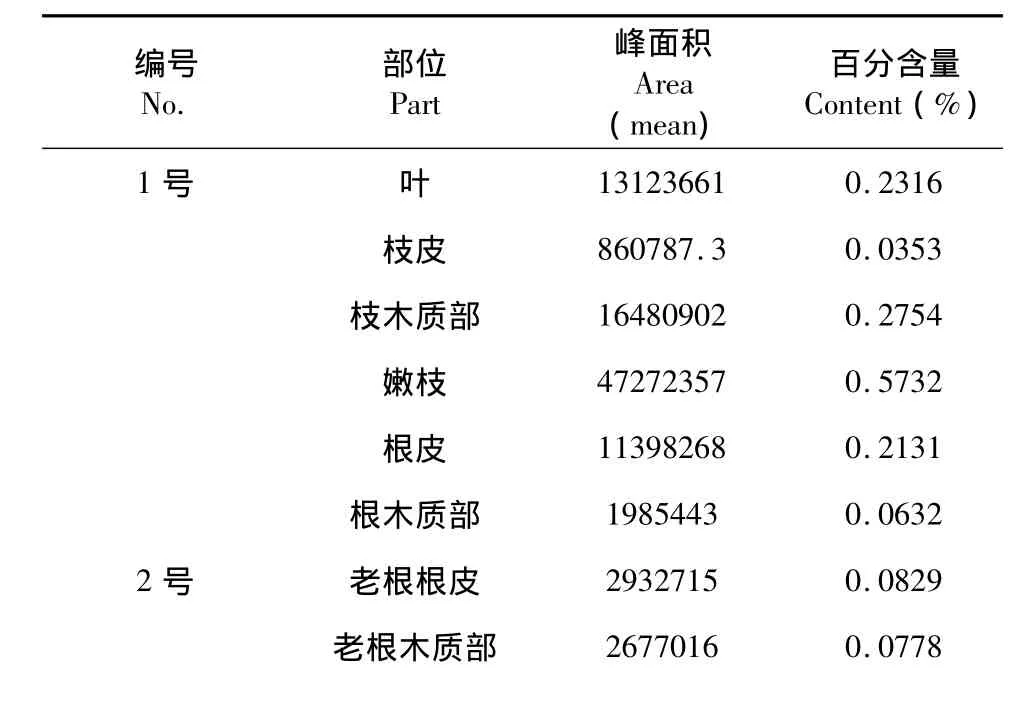
表2 野桑资源的DNJ含量Table 2 The content of DNJ in wild mulberry(M.australis)resouces

3号 叶 1 8 7 2 7 8 6 1 0 . 3 0 1 0枝皮 2 4 9 0 4 0 3 0 . 0 7 4 0嫩茎 3 1 0 1 4 9 4 0 . 0 8 6 2嫩枝木质部 9 9 4 6 5 7 0 . 0 3 9 0老茎木质部 无明显峰 <0 . 0 1 5 0根皮5 0 8 0 6 7 3 0 . 1 2 1 5
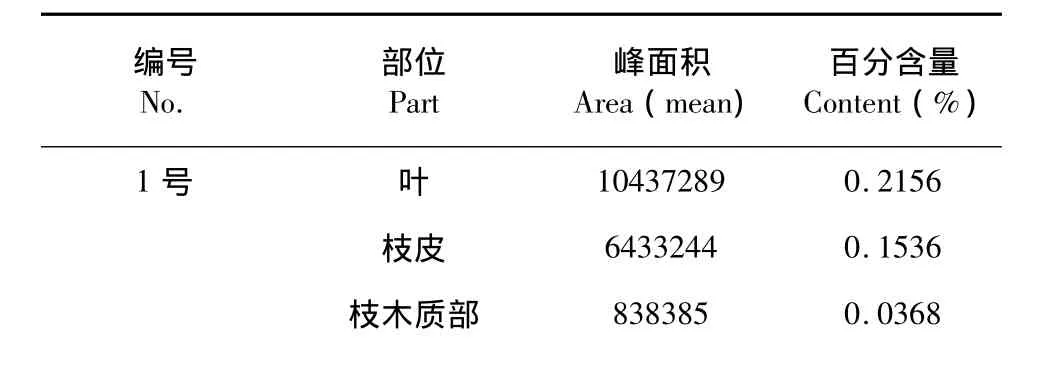
表3 家桑资源的DNJ含量Table 3 The DNJ content of culture mulberry(M.alba)resources

2号 枝皮 2 2 4 3 6 3 2 0 . 0 7 3 4全枝 1 6 7 5 1 7 3 0 . 0 5 9 8 3号 枝皮 5 6 2 2 2 4 1 0 . 1 3 8 0枝木质部 无明显峰 <0 . 0 1 5 0根皮 8 9 2 0 3 2 9 0 . 1 4 3 9根木质部3 3 3 9 7 8 0 0 . 0 7 2 2
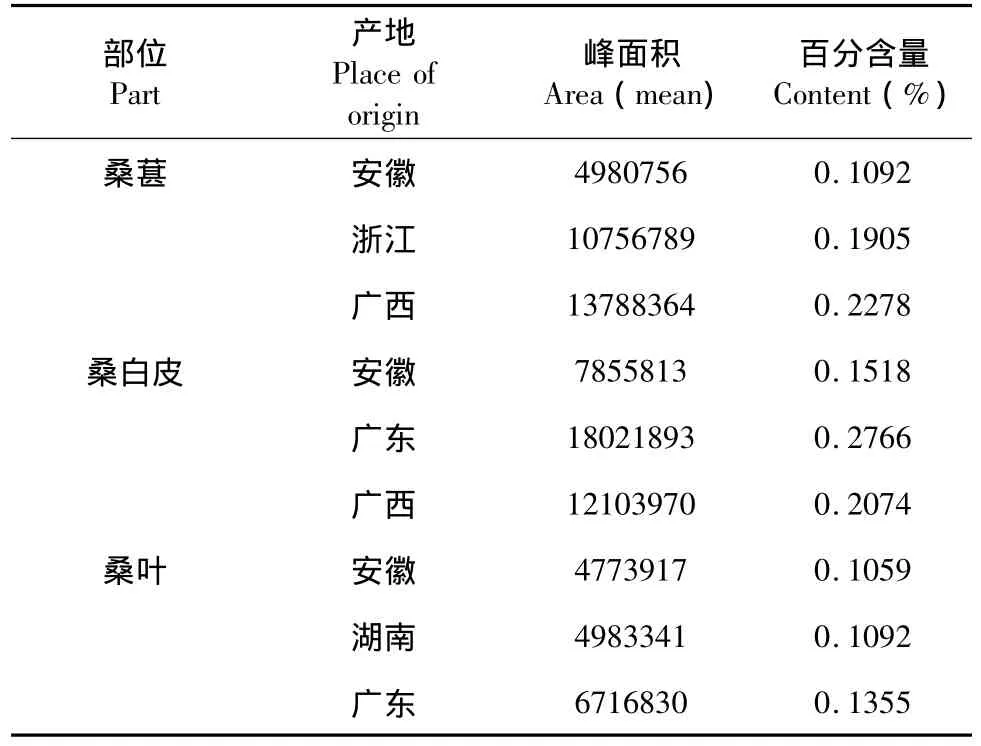
表4 不同产地桑葚、桑白皮、桑叶的DNJ含量Table 4 The DNJ content of mulberry fruit,mulberry root bark,and mulberry leaves

表5 不同时间采集的桑叶(M.alba)的DNJ含量Table 5 The DNJ content of mulberry leaves(M.alba)in different collecting time
3.2 讨论
DNJ结构中没有共轭基团,难以通过紫外检测器检测。目前常用质谱鉴定[10,11],检测方法有硅烷衍生化后GC-MS检测[12]、柱前荧光衍生化-高效液相荧光或紫外检测[13,14],以及红外光谱 IR或ELSD[15,16]检测,也有人使用高效阳离子交换色谱-脉冲安培检测法(HPCEC-IPAD)[17]。但是硅烷化和衍生化方法操作步骤繁琐、误差较大;RI检测器则灵敏度有限、专一性差;离子色谱仪不是一般实验室常用设备,且使用此方法DNJ出峰时间过早,故使用ELSD为较佳选择。
试验曾尝试用超声提取法提取,但是对于桑枝、根木质部含纤维较多的部位则提取不完全,故采用加热回流提取,提取两次为宜。对提取溶剂也进行了筛选,分别用50%甲醇水、50%乙醇水、50%乙腈水对药材进行提取,结果表明,用50%乙醇水提取的DNJ含量较高。且提取物经阳离子交换树脂纯化后,杂质峰大大减少,峰型也较好。
植物韧皮部的筛管输送叶产生的有机物质,而木质部的导管则输送从根部吸收的水、无机盐等物质,理论上DNJ在桑枝韧皮部的含量应该比木质部高。从实验结果看,家桑的枝皮中DNJ含量比其木质部高,但是在野桑中,枝木质部的DNJ含量比枝皮的高,对于家桑与野桑中枝皮与枝木质部DNJ含量高低相反的情况,还需进一步实验研究。无论家桑中与野桑,DNJ在根皮中的含量普遍比根木质部高,在茎皮及茎木质部中含量都较低,叶及根皮的DNJ含量比较稳定。根据不同地区产的桑叶、桑白皮、桑椹中DNJ含量来看,平均气温较高,雨水较充分的地方,DNJ含量也较多。中药学中通常认为经霜后的桑叶药用为佳,本实验中对同一植株上不同时间连续采集的桑叶进行测定,其DNJ含量呈现波动,其变化可能受气候条件变化影响。对于DNJ含量与桑树的种类、不同部位以及气候、地域影响含量的确切关系,还需进一步研究。
1 Asano N,Oseki K,Tomiokaa E,et al.N-containing sugars from Morus alba and their glycosidase inhibitory activities. Carb Res,1994,259:243-255.
2 Elbain AD.Glycosidase inhibitors:inhibitors of N-linked oligosaccharide processing.FASEB J,1991,5:3055-3063.
3 Tsuruoka T,Fukuyasu H,Ishii M,et al.Inhibition of mouse tumor metastasis with nojirimycin-related compound.J Antibiot,1996,49(2):155-161.
4 Hughes AB,Rudge AJ.Deoxynojirimycin:synthesis and biological activity.Nat Prod Rep,1994,11(2):135-162.
5 Emmanuel F,Papandréou MJ,Jonest IM.Recombinant HIV envelope expressed in an α-glucosidase I-deficient CHO cell line and its parental cell line in the presence of 1-deoxynojirimycin is functional.Virology,1997,231:89-95.
6 Yoshiaki A,Hivomu M.The structure of moranoline,a piperidine alkaloid from Morus species.Nippon Nogei Kagaku Kaishi,1976,50:571-573.
7 Asano N,Yamashitq T,Yasuda K,et al.Polyhydroxylated alkaloids isolated from mulberry trees(Morus alba L.)and sikworms(Bombyx mori L.)J Agric Food Chem,2001,49: 4208-4213.
8Yang M(杨梅),Liu YM(刘玉明),Gao RC(高瑞昶).Determination of DNJ in Morus alba L.leaves by HPLC.Med J Chin PAPF(武警医学),2007,18:121-124.
9 Liang JN(梁建宁),Chen ZS(陈正收),Wu L(吴璐),et al.HPLC-ELSD determination of 1-deoxynojirimycin in Cortex Mori.Chin Tradit Pat Med(中成药),2007,29:1654-1657.
10 Egan MJ,Kite GC,Porter EA,et al.Electrospray and APCI analysis of polyhydroxyalkaloids using positive and negative collision induced dissociation experimentsin a quadrupole ion trap Analyst,2000,125:1409-1414.
11 Kite GC,Porter EA,Egan MJ,et al.Rapid detection of polyhydroxyalkaloid mono-and diglycosides in crude plant extracts by direct quadrupole ion trap mass spectrometry.Phytochem Anal,1999,10:259-263.
12 Keiner R,Dräger B.Calystegine distribution in potato(Solanum tuberosum)tubers and plants.Plant Sci,2000,150:171-179.
13 Guan LP(关丽萍),Zheng GH(郑光浩),Jin QH(金晴昊),et al.Determination of 1-deoxynojirimycin in mulberry leaves in different resources and different collect times by RP-HPLC.Chin Tradit Herb Drugs(中草药).2005,36: 1881-1882.
14 Ouyang Z(欧阳臻),Chen J(陈钧).Determination of 1-deoxynojirimycin in Morus alba L.leaves in different seasons. Food Sci(食品科学),2004,25:211-213.
15 Ouyang HX(欧阳华学),Li YQ(黎源倩),Xiao QW(肖全伟).Determination of 1-deoxynojirimycin in Morus alba L. leaves by HPLC.Chin Tradit Herb Drugs(中草药),2007,38:774-776.
16 Kimura T,Nakagawa K,Saito Y,et al.Determination of 1-deoxynojirimycin in mulberry leaves using hydrophilic interaction chromatography with evaporative light scattering detection.J Agric Food Chem,2004,52:1415-1418.
17 Mellor HR,Adam A,Platt FM,et al.High-performance cation-exchange chromatography and pulsed amperometric detection for the separation,detection,and quantitation of N-alkylated imino sugars in biological samples.Anal Biochem,2000,284:136-142.
Determine the Content of 1-Deoxynojirimycin in Mulberry Resources by HPLC-ELSD
SONG Jie,DENG Jie-li,ZHOU Guang-xiong*
Guangdong Province Key Laboratory of Pharmacodynamic Constituents of Traditional Chinese Medicine and New Drugs Research,Institute of Traditional Chinese Medicine and Natural Products,College of Pharmacy,Jinan University,Guangzhou 510632,China
The content of 1-deoxynojirimycin(DNJ)in mulberry resources was determined by HPLC with an evaporative light scattering detector(ELSD).The HPLC method was established using TSKgel Amide-80(4.6 mm×250 mm,5 μm)column with acetonitrile-water(84∶16 containing 6.5 mM ammonium acetate)as mobile phase.The flow rate was 1.00 mL/min,column temperature 30℃.The standard curve for DNJ using ELSD was linear in the range of 0.505 μg~20.2 μg,r=0.9991(n=6).The average recovery was 94.95%(n=5),RSD=1.98%.The results showed that the contents of DNJ in mulberry leaves,root barks,and twigs were higher than other parts of Morus australis.And the contents of DNJ in mulberry leaves,branch bark,and root barks were higher than other parts of M.alba.The method was accurate and reproducible.It could be used for the rapid determination of DNJ in mulberry resources and other related products.
1-deoxynojirimycin;HPLC;ELSD;mulberry
1001-6880(2011)03-0490-05
2010-09-27 接受日期:2011-03-11
广东省教育部产学研结合项目(2009B090600117)
*通讯作者 Tel:86-20-85221469;E-mail:guangxzh@sina.com
Q946.91;R284.1
A
