芦丁与人血清白蛋白相互作用的紫外可见光谱特性研究
2011-11-23黄汉昌姜招峰
黄汉昌,姜招峰
1北京联合大学应用文理学院;2北京联合大学生物活性物质与功能食品北京市重点实验室,北京100191
芦丁与人血清白蛋白相互作用的紫外可见光谱特性研究
黄汉昌1*,姜招峰2
1北京联合大学应用文理学院;2北京联合大学生物活性物质与功能食品北京市重点实验室,北京100191
本文通过测定芦丁与HSA相互作用前后的紫外可见吸收光谱、圆二色性及人血清白蛋白(HSA)的荧光特性,研究了芦丁与HSA结合作用。结果表明,芦丁在紫外区有三个特征的吸收峰(264.0、285.5及354.5 nm)、在330~300 nm及300~230 nm处显示圆二色性,HSA引起芦丁紫外可见吸收光谱波峰红移;芦丁与HSA相互作用后,不引起HSA二级结构的改变,但对其三级结构有影响,同时对HSA荧光激发及发生光谱最大峰位及幅度有影响。
芦丁;人血清白蛋白;紫外吸收;圆二色性;荧光光谱
芦丁(Rutin)亦称芸香苷(Rutinoside)是黄酮类生物活性物质,存在于70多种植物中,如烟叶、槐花、荞麦和蒲公英等,其中以槐米和荞麦叶的含量较高[1]。芦丁具有降低毛细血管的异常通透性和脆性的作用,具有维持与增强毛细血管抵抗力,降低其通透性,促进细胞增生和抗炎、抗过敏、利尿、降血脂等作用。临床上用于治疗毛细血管引起的出血症,并常作为高血压的辅助治疗药[2]。芦丁为黄酮类物质,由于很容易得到对照品,因此中药或中药制剂常以芦丁为对照品测定总黄酮含量[3-6]。在研究中芦丁常作为黄酮类化合物的模型化合物,研究黄酮类物质的理化性质及生理活性[7-11]。人血清白蛋白(Human Serum Albumin,HSA)是血浆中含量最丰富的载体蛋白,是生物活性物质发挥生物效应的重要载体和靶向分子。本文就芦丁与HSA相互作用的光谱特性进行了研究。
1 实验材料与实验方法
1.1 仪器与材料
圆二色光谱仪(JASCO 810,日本分光公司);紫外可见分光光度计(UV-2450,日本岛津公司);荧光分光光度计(RF-301,日本岛津公司)。
芦丁,中国生物制品药品鉴定所(Mw 610,HPLC>97%);人血清白蛋白HSA(Mw 66000,96%~99%,MERK公司);甲醇(色谱纯,北京化学试剂公司),磷酸钾盐缓冲液(PBS)(pH=7.40,内含NaC1溶液0.5 mol/L)。
1.2 实验方法
1.2.1 紫外可见吸收光谱(UV-Vis Abs)测定
芦丁UV-Vis Abs:精密称取芦丁样品30.5 mg于50 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀配成0.001 mol/L(M)的芦丁样品储备溶液。吸取适当芦丁储备液,用水稀释,制备1.0×10-5M,1.5× 10-5M,2.5×10-5M,5.0×10-5M的芦丁待测样品。分别以待测芦丁待测样品空白溶液为对照,测定芦丁500~200 nm紫外可见吸收光谱。
HSA对芦丁UV-Vis的影响:精密称取14.0 mg HSA于10 mL的容量瓶中,磷酸盐缓冲溶液溶解并稀释至刻度,摇匀配成2.0×10-5M的HSA储备溶液。吸取适当的HSA储备溶液,先用待加体积的PBS溶液稀释后,再加入适当的芦丁储备液溶液(下同),制备含1.5×10-5M芦丁、5.0×10-7M HSA的芦丁HSA样品溶液。以待测芦丁待测样品空白溶液为对照,测定芦丁HAS样品500~250 nm紫外可见吸收光谱。
1.2.2 圆二色光谱(CD)测定
芦丁UV-Vis CD:吸取适当的芦丁储备液及HSA储备溶液,制备合适浓度芦丁样品溶液,以其空白溶液为对照,测定芦丁500~200 nm紫外可见圆二色光谱。
HSA二级结构:制备合适浓度HSA溶液,测定其250~190 nm的CD值,杨氏拟合法拟合HSA的二级结构组成。仪器条件:1 mm石英比色池,1 nm狭缝宽度,100 nm/min扫描速度,1 s响应值,扫描3次取平均值。
HSA对芦丁二级结构的影响:固定HSA的含量(5.0×10-8M),制备芦丁与HSA不同配比的样品溶液,测定其250~190 nm的CD值。仪器条件:1 mm石英比色池,1 nm狭缝宽度,100 nm/min扫描速度,1 s响应值,扫描3次取平均值。
HSA对芦丁三级结构的影响:固定HSA的含量(1.0×10-5M),制备不同芦丁与HSA配比的样品溶液,测定其350~250 nm的CD值。仪器条件:10 mm石英比色池,1 nm狭缝宽度,100 nm/min扫描速度,1 s响应值,扫描3次取平均值。
1.2.3 荧光光谱测定
HSA荧光激发光谱:配制系列合适浓度HSA PBS溶液,以320~190 nm波长作为激发光源,测定345 nm的发射荧光强度。固定HSA的含量(5.0× 10-8M),制备芦丁与HSA不同配比的样品溶液,测定320~190 nm波长范围的345 nm的荧光强度。比较以上荧光强度的变化。仪器条件:10 mm石英比色池,狭缝宽度4 nm,100 nm/min扫描速度,1 s响应值,扫描3次取平均值。
HSA荧光发射光谱:固定HSA的含量(1.0× 10-6M),制备不同芦丁与HSA不同配比的样品溶液,测定其300~500 nm的发射荧光光谱。仪器条件:10 mm石英比色池,激发波长为283 nm,狭缝宽度4 nm,100 nm/min扫描速度,1s响应值,扫描3次取平均值。
芦丁对HSA荧光发射光谱的吸收:制备合适浓度HSA溶液,283 nm光源激发HSA溶液产生发射荧光光谱,在荧光光路上放置不同浓度的芦丁溶液,测定300~500 nm的发射荧光光谱。仪器条件: HSA溶液荧光激发采用10 mm石英比色池;芦丁溶液采用1 mm石英比色池。激发波长为283 nm,狭缝宽度4 nm,100 nm/min扫描速度,1 s响应值,扫描3次取平均值;芦丁溶液采用1 mm石英比色池。
2 实验结果与讨论
2.1 芦丁紫外可见吸收光谱及圆二色性分析
芦丁为黄酮类化合物,具有α-苯基色原酮的基本结构,羰基与二个芳香环形成两个较强的共轭系统(图1),浓度为1.0,1.5,2.5,5.0×10-5M的芦丁甲醇溶液,在500~200 nm波长下作光谱扫描,其图谱见图2。芦丁对紫外光谱的两个区域有很强的特征吸收。吸收带I在330~380 nm较长波长范围最大ε在22000左右,吸收峰归属色原酮结构氧原子n→π*的电子跃迁R带吸收;吸收带II在240~280 nm波长范围,最大ε在26000左右,吸收峰归属苯环共轭结构π→π*的电子跃迁B带吸收。吸收带III在200~240 nm,最大摩尔吸光系数ε在48000左右,吸收峰归属苯环双键π→π*的电子跃迁E带吸收。
当平面圆偏振光通过这些光活性的生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的吸收不相同,产生的吸收差值。由于这种吸收差的存在,造成了偏振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是手性化合物的圆二色性。芦丁的紫外可见圆二色光谱图见图3。芸香糖虽然存在不对称结构,但在500~200 nm纳米范围内没有光谱吸收,所以在检测波长范围内不表现CD值。500~330 nm波长范围内芦丁没有明显的CD值,表明原酮结构氧原子处于对称微环境中,没有手性。330~300 nm、300~230 nm波长范围分别有正的科顿效应,这可能与苯环B对色原酮(C+A环)平面不对称性有关。
1.5 ×10-5M的芦丁溶液吸光度在0.2~0.8范围,试验误差小,因此采用此浓度测定HSA对芦丁紫外吸收光谱的影响。含5.0×10-7M HSA的1.5 ×10-5M芦丁溶液500~250 nm波长紫外吸收光谱见图4。由图4可见,芦丁溶液中加入HSA后,其最大紫外吸收峰发生了红移;264.0 nm的波峰红移至267.5 nm,最大ε稍有增加,285.5 nm的波谷红移至291.5 nm,354.50 nm的波峰红移至363.0 nm,最大ε明显降低,并且R吸收带明显向长波方向扩展(红移)。紫外吸收波长的红移表明芦丁与HSA发生了相互作用。



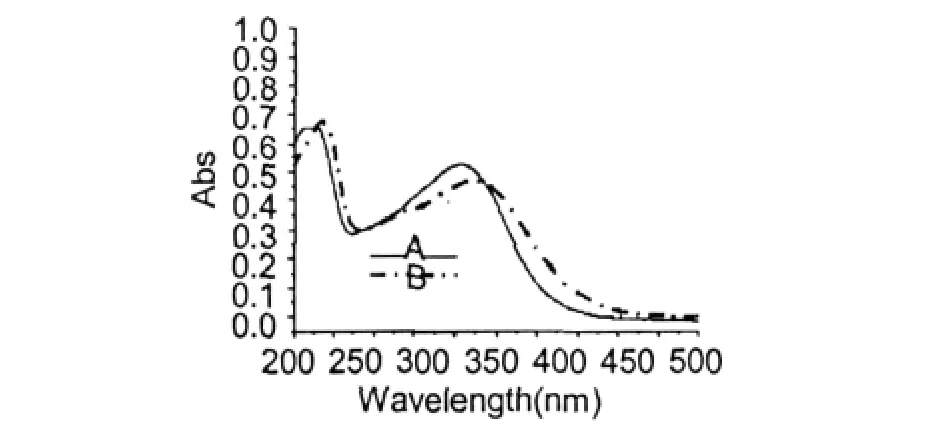
图4 HSA对Rutin紫外吸收光谱的影响Fig.4 The effection of HSAon the rutin’s UV-Vis absorption spectrum
由于芦丁在500~330 nm波长范围内没有明显的CD值,而330~190 nm以下HSA的CD值很明显,会给芦丁CD值分析带来很大干扰,因此很难测定及分析HSA作用对芦丁手性的影响。
2.2 芦丁对HSA结构的影响
圆二色光谱能够灵敏地反映蛋白质溶液构象的改变[12]。在蛋白质或多肽中,主要的光活性基团是肽链骨架中的肽键、芳香氨基酸残基及二硫桥键。蛋白质的CD光谱一般分为两个波长范围,即190~250 nm为远紫外区CD光谱,250~320 nm为近紫外区CD光谱。远紫外区CD光谱由肽键产生,反映蛋白质二级结构的圆二色性。在蛋白质或多肽的二级结构中,肽键是高度有规律排列的。排列的方向性决定了肽键能级跃迁的分裂情况。因此,具有不同二级结构的蛋白质或多肽所产生CD谱带的位置、吸收的强弱都不相同。近紫外CD主要由侧链芳香基团、二硫键等生色基团产生,近紫外CD与蛋白质的三级结构密切相关。
2.2.1 HSA二级结构的影响
HSA和芦丁的190~250 nm的圆二色光谱图见图5。可见相同浓度的HSA溶液中,HSA与芦丁比例从2∶1~1∶20,HSA的208及222 nm处的α-螺旋特征光谱变化没有浓度依赖关系;造成其光谱微细差异主要由实验样品间浓度差异造成。芦丁对HSA在190~250 nm的圆二色光谱并没有明显影响,表明芦丁与HSA发生作用后并没有引起HSA二级结构的变化。本实验结果与吴锦绣等[13]认为芦丁引起HSA二级结构的改变有矛盾。其可能的原由:(1)供试品与对照品HSA的浓度差异造成。HSA的圆二色性很强,浓度稍有差异,对HSA在200~230 nm的CD值影响明显;(2)芦丁甲醇储备液加入高浓度HSA储备液后,再加入PBS溶液稀释成所需浓度的供试样品。甲醇对HSA的二级结构组成有一定的影响(图6),在低含量下(小于10%),甲醇对HSA二级结构影响不明显;但甲醇含量较高时,HSA二级结构改变明显,208及222 nm处的α-螺旋特征光谱明显减弱。



图7 芦丁对HAS三级结构的影响Fig.7 The effection of rutin on the tertiary structure of HSA
2.2.2 HSA三级结构的影响
HSA和芦丁的250~350 nm的圆二色光谱图见图7。可见,芦丁对HSA 250~350 nm的CD光谱有轻微的影响。HSA在250~270 nm有精细的CD光谱值,其CD值主要来自芳香氨基酸残基中测量色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)的贡献。HSA在262及268 nm处有两个精细的最大CD值;在芦丁存在条件下,明显的加强这两个CD波峰值。表明芦丁与HSA发生作用后引起HSA三级结构的变化。
2.3 芦丁对HSA荧光光谱的影响
HSA中含有芳香氨基酸,使其具有很强的内源荧光性,当某些小分子如药物与蛋白质结合后,会导致HSA激发及发射光谱特性的改变。药物与蛋白质结合后,导致蛋白质荧光强度下降现象,这种现象称为药物对蛋白质的荧光猝灭作用。但当药物在HSA的发射荧光光谱范围内有强烈的吸收时,在同一溶液中即使药物与HSA没有发生直接的结合作用,也能导致检测器中HSA荧光强度下降,造成药物对荧光猝灭作用的假象。我们曾经报道随着芦丁浓度的增加HSA内源荧光强度逐渐降低现象[14],但我们没有考虑到芦丁自身对HSA发射荧光的吸收因素。HSA内源荧光强度的降低究竟是由芦丁的电子吸收作用引起的,还是由芦丁与HSA发生分子相互作用后引起的,还有待进一步的研究。本部分重新考查了芦丁与HSA的相互作用及对HSA荧光光谱的影响。
2.3.1 HSA荧光激发光谱
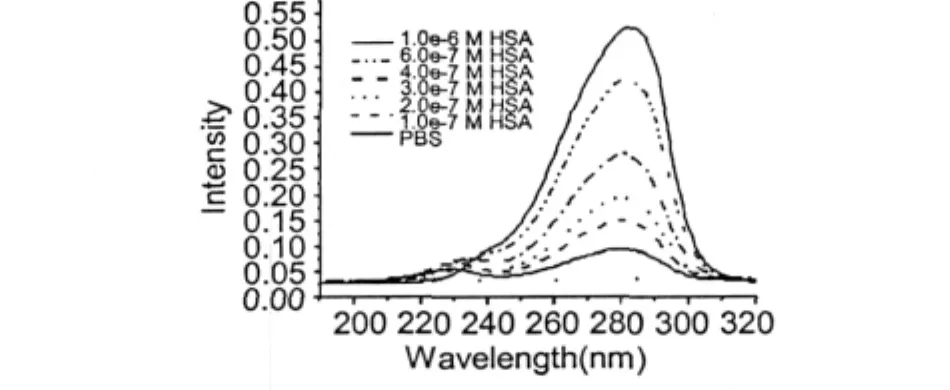
图8 HSA激发荧光光谱Fig.8 The excitation fluorescence spectra of HSA
配制1.0×10-7~1.0×10-6M HSA的PBS溶液,以190~320 nm波长光源作为激发光源,记录345 nm处HSA的荧光发射光强,考察HSA浓度对其荧光激发光谱的影响。HSA荧光激发光谱见图8,PBS在190~320 nm波长光源激发下不产生荧光,对HSA荧光强度测定无干扰。HSA的最大激发波长在280 nm附近,随HSA的浓度稍有变化,当HSA浓度当1.0×10-7M升高到1.0×10-6M时,最大激发波长从280 nm变化到283 nm。280 nm附近激发光源下,HSA的荧光发射光强与其浓度呈依赖关系,随HSA浓度的升高而增大。在250~300 nm范围内芳香氨基酸的侧链生色基团有较强的紫外吸收,HSA中含有酪氨酸及色氨酸残基,280 nm附近激发光源的HSA荧光发射光谱主要为酪氨酸及色氨酸残基激发的内源性荧光。
值得注意的是,230左右nm的激发光源下,HSA的荧光发射光强与浓度没有依赖关系。
2.3.2 芦丁对HSA荧光激发光谱影响
芳香氨基酸残基的激发波普与其所处的微环境,特别是疏水性有关,蛋白质与药物结合后可能会对芳香氨基酸残基的微环境产生影响,其最大激发波长可能会产生变化。
配制1.0×10-6M HSA的PBS溶液及其不同芦丁含量的PBS溶液,以190~320 nm波长光源作为激发光源,记录345 nm处HSA的荧光发射光强,考察芦丁对HSA荧光激发光谱的影响。芦丁对HSA荧光激发的影响光谱见图9。芦丁在190~320 nm波长光源激发下不产生荧光,对HSA荧光强度测定无干扰。芦丁对HSA的最大激发波长产生明显的影响,在相同HSA浓度下,当芦丁浓度从1.0×10-8M升高到5.0×10-6M时(HSA与芦丁的摩尔比100∶1~1∶5),最大激发波长从283 nm变化到286 nm。表明芦丁对HSA中酪氨酸及色氨酸残基侧链生色基团的微环境产生了影响,而这种影响与HSA蛋白质的空间构象变化密切相关。
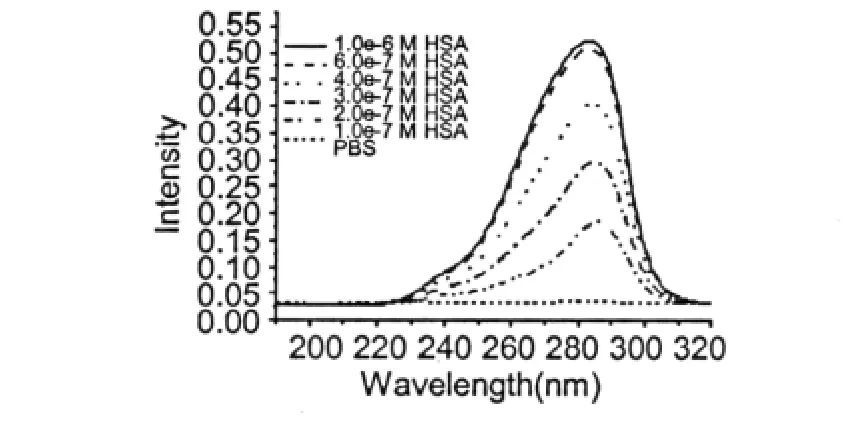
图9 芦丁对HSA激发荧光光谱的影响Fig.9 The effection of rutin on excitation fluorescence spectra of HSA
2.3.3 芦丁对HSA荧光发射光谱影响
配制1.0×10-6M HSA的PBS溶液及其不同芦丁含量的PBS溶液,以283 nm波长光源作为激发光源,记录300~450 nm波长范围的HSA荧光发射光谱,考察芦丁对HSA荧光发射光谱的影响,结果见图10。芦丁溶液本身不产生荧光,因此,研究中不用考虑“内滤光效应”的干扰。固定HSA的量,改变芦丁与HSA的含量比例,随着芦丁浓度的增加,HSA的内源荧光强度有规律地降低,当HSA与芦丁浓度比达到1∶12时,基本检测不到HSA的发生荧光光强。这种荧光发生强度的降低来源于:(1)芦丁本身对300~450 nm光谱的吸收;(2)芦丁对HSA酪氨酸及色氨酸残基侧链生色基团的微环境产生影响,部分抑制了其产生荧光的能力。
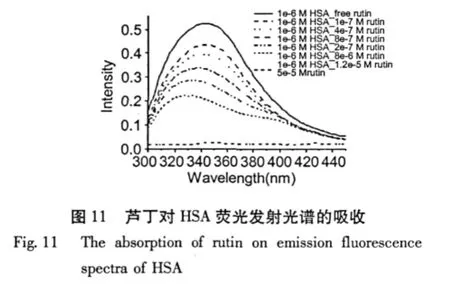
HSA在345 nm附近的发射峰可归属于其酪氨酸及色氨酸残基的发生荧光,而酪氨酸、色氨酸残基的最大发射波长与其所处的微环境相关[8]。芦丁-HSA溶液体系中,HSA荧光最大发射峰位及峰形随芦丁浓度的增加发生蓝移,相同1.0×10-6M HSA浓度条件下,当芦丁浓度由1.0×10-7M升高到8.0 ×10-6M时,HSA最大发射荧光峰位从345 nm蓝移到338 nm(最大荧光强度由5.0下降到0.15左右)。
为了探讨芦丁对HSA发射荧光光谱直接吸收的影响,设计以下实验:在HSA溶液发生荧光光路上,放置芦丁溶液,记录经芦丁溶液吸收后的HSA荧光发射光谱。实验结果见图11。芦丁对HSA发射荧光有较强的吸收作用,相同1.0×10-6M HSA浓度条件下,HSA发射荧光强度随芦丁浓度的增加而降低,但是与芦丁-HSA溶液体系不同的是:(1)即使HSA与芦丁浓度比达到1∶50时,仍能检测到一定的HSA荧光光强;并且芦丁对360 nm附近的荧光有较强的吸收作用,这与芦丁的360附近有最大吸收的紫外吸收光谱相吻合。(2)在相近发射荧光强度条件下,最大发射荧光峰位发生更大的蓝移,HSA最大发射荧光峰位从345 nm蓝移到326 nm (最大荧光强度由0.45下降到0.22左右)。
以上实验结果表明,芦丁-HSA溶液体系中,芦丁除了本身对300~450 nm光谱的有吸收外,芦丁与HSA分子之间确实发生了相互作用,芦丁对HSA酪氨酸及色氨酸残基侧链生色基团的微环境产生影响,部分抑制了其产生荧光的能力。HSA发射的荧光能量向芦丁发生了转移,芦丁对HSA的荧光有猝灭作用。

3 结论
芦丁是重要的黄酮类生物活性物质,其经常作为黄酮类化合物的模型化合物,研究黄酮类物质的理化性质及生理活性。HSA是血浆中含量最丰富的载体蛋白,是生物活性物质发挥生物效应的重要载体和靶向分子。HSA影响芦丁的紫外吸收光谱;芦丁与HSA相互作用,其不引起HSA二级结构的改变,但对HSA三级结构分子构象有一定的影响。以芦丁为黄酮类物质的分子模型,开展黄酮类物质与HSA分子相互作用的研究,探讨黄酮类物质与蛋白质的相互作用机制,对揭示黄酮类药物药效具有重要意义。
1Zhao WB(赵文彬),Xu YH(许玉华),Wang LS(王鲁石).The Purification and Determination of Rutin.Lishizhen Med Mater Med Res(时珍国医国药),2007,18:876-878.
2 Long QJ(龙全江),Yang T(杨韬).General Situation and Prospect of Research on Rutin.Chin J Inf Tradit Chin Med (中国中医药信息杂志),2002,9(4):39-42.
3 Ma TT(马陶陶),Zhang QL(张群林),Li J(李俊).AlCl3Color imetry for Determ ina tion of Total Flavonoids.Lishizhen Med Mater Med Res(时珍国医国药),2008,19:54-56.
4 He SM(何书美),Qiao LX(乔兰侠),Liu JL(刘敬兰).Quantitative Determination of Total Flavonoids in the Extraction of Celery Leaves by IR.J Anal Sci(分析科学学报),2008,24:201-204.
5 Gui JS(桂劲松),Wei HY(韦汉燕),Dai P(戴平).The Content Determination of Total Flavones in Mallotus Apelta Leaf by Difference Spectrophotometry.J Yangtze Univ,Nat Sci(长江大学学报,自科版医学卷),2009,6:64-65.
6Zhou WP(周吴萍),Li JS(李军生),Wei YY(韦媛媛).A-nalysis of Total Flavonoids Content in Emilia sonchifolia from Different Regions and at Different Collecting Times.Food Sci (食品科学),2008,29:469-471.
7 Luan NN(栾尼娜),Wu JX(吴锦绣),Song YM(宋玉民).Thermodynamics Studies on the Binding of Rutin and Serum Albumin.Spectroscopy Spectral Anal(光谱学与光谱分析),2008,28:856-859.
8 Ma GB(马贵斌),Gao F(高飞),Ren BZ(任斌知).Study on the Interaction of Human Serum Albumin and Drug Molecules by the Fluorescence Method.Acta Chim Sin(化学学报),1995,53:1193-1197.
9 Guo JJ(郭菁菁),Yang XF(杨秀芬).Research progress of the protective effect of flavanoids on experimental liver injury of animals.Chin Pharm Bull(中国药理学通报),2008,24: 5-10.
10 Zhang AH(章爱华),Deng B(邓斌),Jiang GB(蒋刚彪).Preliminary study on antioxidant activity of flavone extractive from purslane.Food Sci Techno(食品科技),2008,8:140-143.
11 Yu TZ(愈天智),Yang RD(杨汝栋).Study on the interaction of rutin and serum albumin.Spectroscopy Spectral Anal (光谱学与光谱分析),2003,23:763-765.
12 Huang HC(黄汉昌),Zhu HJ(朱宏吉),Jiang ZF(姜招峰).The methods of protein conformation predicted by UV-circular dichroism.Chem Bull(化学通报),2007,70:501-506.
13 Wu JX(吴锦绣),Zhang Y(张胤),Li M(李梅).Influence of rutin on conformation of serum albumin.Spectroscopy Spectral Anal(光谱学与光谱分析),2008,28:2619-2622.
14 Huang HC(黄汉昌),Zhang A(张艾),Jiang ZF(姜招峰).A study on extraction of rutin from flos sophorae immaturus and fluorescence of human serum albumin interacted with rutin.J Beijing Union Univ,Nat Sci(北京联合大学学报,自科版),2008,22:11-14.
The UV-Vis Spectrum Analysis on the Interaction between Rutin and Human Serum Albumin
HUANG Han-chang1*,JIANG Zhao-feng21College of Arts and Science of Beijing Union University;2Beijing Key Laboratory of Bioactive Substances and Functional Foods of Beijing Union University,Beijing 100191,China
In order to inveatigate the interaction between rutin and human serum albumin(HSA),this article determined the ultraviolt-visible(UV-Vis)absorption spectrum,circular diachroism and HSA fluorescence spectrum,and further to analyse the difference between the spectra before and after rutin and HSA mixed.The results indicated that rutin shows three particular UV absorption-peak at the wavelength 264.0,285.5 and 354.5 nm and circular diachroism at the wavelength ranges 330~300 nm and 300~230 nm.When rutin interacted with HSA,the UV absorption peak of Rutin will be shifted to long wavelength.However,for the structure of HSA,rutin will change the HSA tertiary structure rather than secondary strcture.The fluoresence of HSA is also influenced by rutin.The excitation wavelength will be shift towards long wavelength,while emission wavelength will be shift towards short wavelength when HSA interacted with rutin.
rutin;Human Serum Albumin(HSA);UV-Vis absorption;Circular Diachroism;fluorescence
1001-6880(2011)03-0476-06
2009-09-09 接受日期:2010-01-21
北京联合大学应用文理学院科学研究发展基金,北京市教育委员会科技计划项目资助(KM201011417002)。
*通讯作者 Tel:86-10-62004534;E-mail:hanchang@ygi.edu.cn
Q81
A
