藏药蕨麻多糖的光谱性质及单糖组成分析
2011-11-23孙志伟李国梁索有瑞尤进茂
夏 莲,孙志伟,李国梁,索有瑞,尤进茂,2*
1中国科学院西北高原生物研究所,西宁810001;2山东省曲阜师范大学化学与化工学院生命有机分析重点实验室,曲阜273165;3中国科学院研究生院,北京1000491
藏药蕨麻多糖的光谱性质及单糖组成分析
夏 莲1,2,3,孙志伟1,3,李国梁1,3,索有瑞1,尤进茂1,2*
1中国科学院西北高原生物研究所,西宁810001;2山东省曲阜师范大学化学与化工学院生命有机分析重点实验室,曲阜273165;3中国科学院研究生院,北京1000491
本研究对藏药蕨麻多糖进行了分离提纯,并测定其水溶性多糖含量为99.4%;通过紫外光谱与红外光谱分析表明,蕨麻多糖为分子量较小的α-吡喃糖,并含有氨基糖;蕨麻多糖的水解单糖经过NMP衍生后进行毛细管电泳分析,测得其单糖组成为木糖、阿拉伯糖、葡萄糖、鼠李糖、甘露糖、岩藻糖、半乳糖、葡萄糖醛酸和半乳糖醛酸,含量分别为3.945、77.445、17.568、17.646、3.942、2.165、65.268、13.037 μg/mg和33.484 μg/mg,与GC-MS的定性分析结果一致。
蕨麻;多糖;光谱性质;单糖组成
蕨麻(Potentilla anserine L.)为蔷薇科委陵菜属植物鹅绒委陵菜的根,为藏医常用药,又名戳玛、卓老洒曾、延寿果、人参果、仙人果等。蕨麻分布很广,但据《新华本草纲要》记载“只在青藏高原,本种始有块根发育”[1]。本药具有应用历史悠久、民族药特征明显等特点,深受藏族同胞的喜爱,是当地人的“常用上药”[2]。现代药理学表明:蕨麻具有健脾胃、收敛止血、补血益气、生津利痰之功效,主治脾虚腹泻、贫血及营养不良等症[3],另有报道蕨麻具有治疗黄疸性及病毒性肝炎的功效[4,5]。据文献记载,蕨麻中含有糅质、糖类、蛋白质、脂肪酸及委陵菜苷等成分[6-9],但对蕨麻多糖的研究还仅限于总糖含量的测定[10,11]。
研究表明,多糖类物质不仅具能够提高免疫系统功能,而且具有较高的抗癌等生物活性[12,13]。不同植物中提取的多糖其生物活性也有很大差别,主要取决于多糖的单糖组成,分子量以及链构象[14]。因此,对多糖的单糖组成分析具有重要意义。本研究利用紫外光谱、红外光谱、毛细管电泳以及气相色谱-质谱联用等方法对蕨麻多糖的单糖组成进行了研究,为进一步开发利用藏药蕨麻提供理论基础。
1 材料与方法
1.1 原料、试剂及主要仪器
蕨麻植物样品8月份采自青海玉树地区,经中国科学院西北高原生物研究所藏药中心周昌范研究员鉴定。
1-萘基-3-甲基-5-吡唑啉酮(NMP)由本实验室合成[15];单糖标准品(sigma公司,美国);硼砂(分析纯,徐州试剂二厂);水为Milli-Q超纯水;其它试剂均为分析纯。
CARY 300紫外可见光度计(Varian公司),Nicolet 10DX-FTIR红外光谱仪。HP6890和HP5973气相色谱-质谱联用仪(美国安捷伦公司),HP-3D毛细管电泳仪(美国,Agilent公司),配备二极管阵列检测器;毛细管,总长58.5 cm,有效长度50 cm,内径50 μm(河北省永年锐沣色谱器件有限公司)
1.2 实验方法
1.2.1 蕨麻多糖的提取、分离纯化及水解
干燥、研细的蕨麻根块100 g,加100 mL乙醇和乙醚(体积比1∶1)混合液,65℃水浴回流3 h去脂,抽滤,沉淀物溶于100 mL 85%的乙醇,超声波提取30 min去单糖,抽滤,沉淀物加水溶解后超声波提取90 min,抽滤,旋转蒸发滤液,得60 mL粘稠液,补加3倍体积95%的乙醇,静止放置24 h,离心,沉淀物加水溶解后用氯仿-正丁醇(体积比4∶1)萃取三次(脱蛋白);上清液继续补加95%乙醇至乙醇浓度为90%,放置24 h,离心沉淀,沉淀物于70℃烘干,得蕨麻粗多糖。
取蕨麻粗多糖10 mg于安培瓶中,加3 mol/L的三氟乙酸2 mL溶解后封口,于110℃下水解10 h,放冷后N2吹干。
1.2.2 总糖含量的测定
精密量取1 mg/mL的葡萄糖对照品溶液0.05,0.25,0.75,1.0,1.25 mL,分别置于10 mL具塞试管中,加水稀释至10 mL。准确加入5%的苯酚溶液1 mL,混匀,冰水浴,再精密加入浓硫酸5 mL后98℃水浴加热20 min,自来水水浴冷却5 min,室温放置10 min,以空白溶液为对照于488 nm处测吸光度。以吸光度(A)对葡萄糖检测浓度(C)进行线性回归。
吸取10 μg/mL的样品液1 mL,测定吸光度,多次测量取平均值,通过回归方程求得相应糖浓度值,计算总糖含量。
1.2.3 蕨麻多糖紫外-可见光谱与红外光谱分析
制备0.1 mg/mL-1蕨麻多糖水溶液,在400~190 nm范围内扫描;蕨麻多糖以溴化钾压片,在波数4000~400 cm-1范围内进行红外光谱扫描。
1.2.4 蕨麻多糖水解单糖的毛细管电泳分析
NMP的标记过程:向2 mL安瓿瓶中加入200 μL(0.05 M)NMP乙腈溶液、20 μL单糖标准品混合液(0.01 M)、20 μL 17%氨水,封口后于70℃水浴中反应35 min,取出放冷后用氮气吹干,加2 mL乙腈-水(体积比为4∶1)溶解后进样分析。
毛细管电泳条件:采用58.5 cm×50 μm id毛细管(有效柱长50 cm),55 mmol/L硼酸盐缓冲溶液(pH 9.46),柱温20℃,分离电压22 kV,进样10 s,不加任何添加剂。
1.2.5 蕨麻多糖水解单糖的气相色谱-质谱分析
乙酰化过程:取10 mg蕨麻多糖经水解后,加入盐酸羟胺5.0 mg,吡啶100 μL,振荡混匀,放入90℃水浴中加热反应30 min。取出后冷却至室温,加100 μL醋酸酐,90℃下继续反应30 min进行乙酰化,冷却至室温,70℃水浴中将反应产物用N2吹干,加入800 μL氯仿重新溶解,取1 μL进行GC-MS分析。
气相色谱分析条件:载气为高纯氦气;进样口温度280℃;程序升温,起始温度100℃,以10℃/min升至170℃,再以5℃/min升至260℃,保持5 min;载气流速1.2 mL/min,分流比20∶1;EI离子源,电子能量70 eV;质荷比扫描范围55~550,离子源温度230℃,接口温度280℃。
2 结果与讨论
2.1 蕨麻多糖的提取率及总糖含量
蕨麻块根经去脂、去单糖后,利用水提醇沉法提取粗多糖,经savage法除蛋,得多糖252.0 mg。
以吸光度(A)对葡萄糖检测浓度(C)进行线性回归,得回归方程为 C=0.2137A-0.0159(r= 0.9994)。结果表明,葡萄糖检测浓度在22.31~114.03 μg/mL范围内与吸光度呈良好的线性关系。由回归方程计算得蕨麻多糖水溶性多糖的含量为98.4%
2.2 蕨麻多糖紫外-可见光谱分析
紫外光谱图中,195 nm处显示多糖的特征吸收,在260 nm和280 nm处无蛋白、核酸吸收峰[16],表明多糖中无蛋白、多肽及核酸的存在。
2.3 蕨麻多糖的红外光谱分析

图1 蕨麻多糖的红外光谱图Fig.1 The IR spectrum of polysaccharide from Potentilla anserine L.
蕨麻多糖经红外光谱分析如图1,在3600~3200、3200~2800、1400~1200 cm-1和1200~1000 cm-1,这4个谱段内都出现了典型多糖物质的吸收峰,分别为O-H键和分子内或分子间氢键的伸缩震动,C-H键的伸缩震动,C-H变角震动,C-O-H和吡喃环的C-O-C两种C-O键形成的伸缩震动,1630 cm-1附近的吸收峰为酰胺基团中乙酰基的特征吸收,表明蕨麻多糖中有氨基糖的存在;在845.45 cm-1处的吸收为α-吡喃型糖的的特征吸收,而890 cm-1附近无吸收,说明蕨麻多糖成苷的半缩醛羟基主要为α构型的吡喃糖,而没有β构型;2921 cm-1处的吸收峰不明显,提示其分子结构中甲基和亚甲基含量比较小[17],体现为分子链较短,相对分子量较小。
2.4 蕨麻多糖水解单糖的毛细管电泳分析
单糖缺乏常规的紫外生色基团,所以单糖的衍生化是获得高灵敏紫外检测的必要步骤。Suzuki等[18]以1-苯基-3-甲基-5-吡唑啉酮(PMP)为衍生试剂,利用活泼碳(C-4)和还原糖的还原端之间的缩合反应进行糖类的测定。本文以本课题组合成的1-萘基-3-甲基-5-吡唑啉酮(NMP)作柱前衍生剂,实现了蕨麻多糖水解单糖在毛细管区带电泳模式下的分离和定量,为蕨麻多糖的应用开发提供了可靠理论依据。单糖衍生反应过程见图2(以甘露糖为代表单糖)。
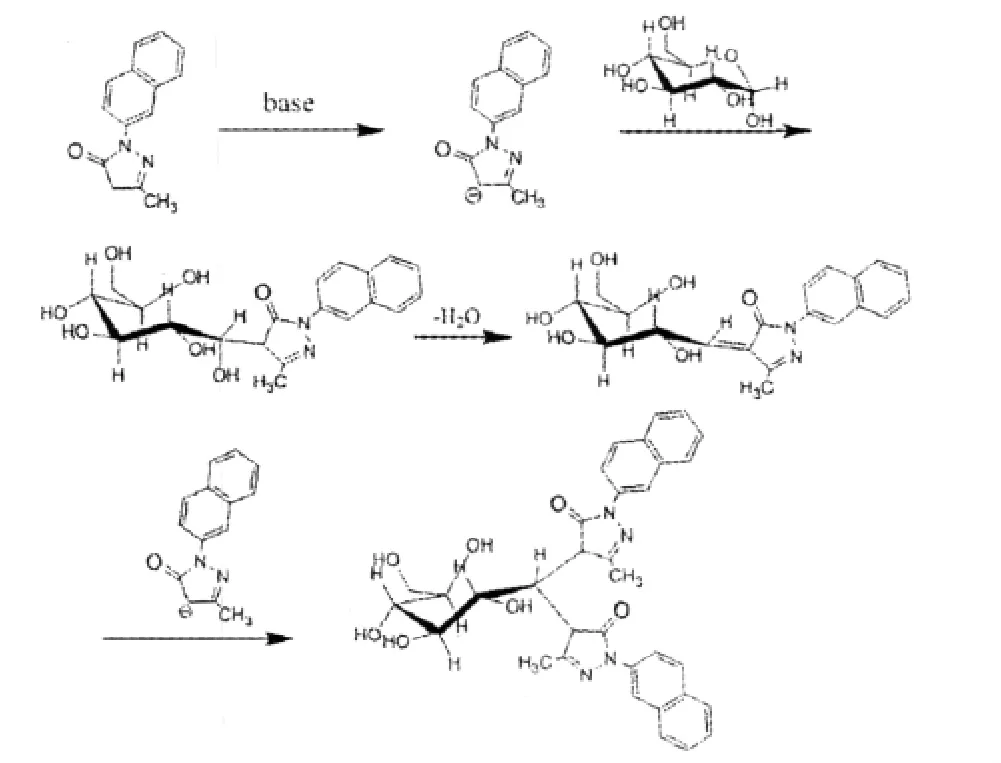
图21 -(2-萘基)-3-甲基-5-吡唑啉酮(NMP)与还原性单糖衍生反应示意图Fig.2 Derivatization scheme of 1-(2-naphthyl)-3-methyl-5-pyrazolone(NMP)with reductive saccharides
NMP标记的糖类衍生物在250~5 μmol/L范围内,依据峰面积对单糖浓度进行线性回归,所得各单糖衍生物的线性回归方程、相关系数和检出限见表1。

表1 单糖衍生物的线性回归方程、相关系数、检测限及保留时间和峰面积的重现性(n=6)Table 1 Linear regression equations,correlation coefficients,detection limits and repeatabilities for peak area and retention time of saccharide derivatives(n=6)

*Y:峰面积(peak Area),X:单糖浓度(concentration of monosaccharide),μmol/L.
蕨麻多糖水解单糖按上述方法衍生后进样分析,电泳分离见图3。用线性回归方程定量,经多次测量得单糖含量见图4。图中峰1、峰2、峰3为未知成分,推测为氨基糖。

图3 蕨麻多糖水解单糖的毛细管区带电泳分离图Fig.3 Chromatograms of saccharides from Potentilla anserine L.sample by capillary zone electrophoresis

图4 蕨麻多糖中各单糖含量Fig.4 Quantitative of saccharides separated from Potentilla anserine L.
2.5 蕨麻多糖水解单糖的气相色谱-质谱分析
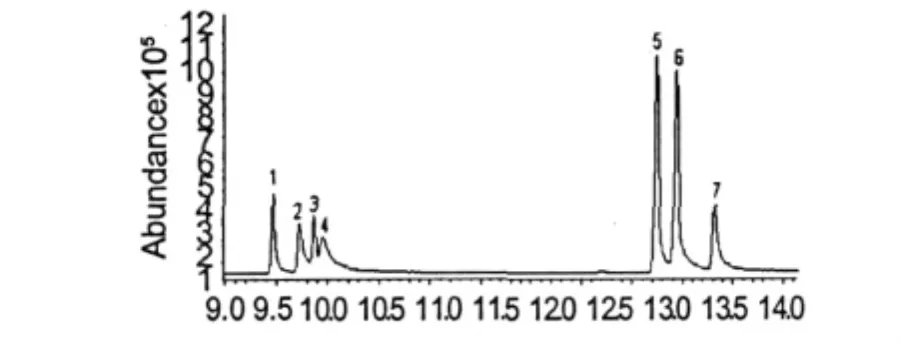
图5 蕨麻多糖水解单糖乙酰化衍生物的总离子流图Fig.5 Total ion chromatogram of acetylated derivatives of saccharides from Potentilla anserine L.sample
蕨麻多糖水解单糖经乙酰化后,用GC-MS分析其单糖组成,总粒子流图见图5。结果显示:蕨麻多糖的组成单糖主要为鼠李糖(1,Rha)、岩藻糖(2,Fuc)、阿拉伯糖(3,Ara)、木糖(4,Xyl)、甘露糖(5,Man)、葡萄糖(6,Glc)和半乳糖(7,Gal),与毛细管电泳分析结果一致。由于糖醛酸容易发生内酯化,直接乙酰化衍生非常困难[19],因此蕨麻多糖水解单糖的GC-MS分析,两种糖醛酸未能检测到。
3 结论
蕨麻多糖经提取、分离纯化后,进行总糖含量的测定,结果显示,蕨麻多糖总糖含量为98.4%;紫外光谱分析表明,在195 nm有多糖的特征吸收,而没有蛋白、多肽及核酸存在;红外光谱分析结果显示,845.45、1630 cm-1附近的吸收分别为α-吡喃型糖的的特征吸收和酰胺基团中乙酰基的特征吸收,且甲基、的特征吸收2921 cm-1不明显,因此,蕨麻多糖为分子量较小的α-吡喃糖,并含有氨基糖。毛细管电泳分析显示,蕨麻多糖的单糖组成主要是木糖、阿拉伯糖、葡萄糖、鼠李糖、甘露糖、岩藻糖、半乳糖、葡萄糖醛酸和半乳糖醛酸,含量分别为3.945、77.445、17.568、17.646、3.942、2.165、65.268、13.037 μg/ mg和33.484 μg/mg,与GC-MS的定性分析结果一致。本文对藏药多糖的单糖组成的定性定量分析为蕨麻在食品、医药和保健方面的开发应用提供可靠的科学依据。
1 Wu ZY(吴征镒).Xinhua Herbal Scheme(新华本草纲要).Shanghai:Shanghai Science and Technology Press,1990:106.
2 Qinghai institute of biology(青海生物研究所),Tongren Longwu dispensary(同仁县隆务诊疗所).Qinghai Altiplano Medicament Illustrated Handbook(青海高原药物图鉴).Xining:Qinghai People’s Press,1972.56.
3 Chen HQ(陈惠清),Zhang RX(张瑞贤),Huang LQ(黄璐琦),et al.The literature review of Potentilla anserina L.China J Chin Mat Med(中国中药杂志),2000,25:311
4 ZhaoYL,Cai GM,Hong X,et al.Anti-hepatitis B virus activities of triterpenoid saponin compound from Potentilla anserina L..J Phytomed,2008:15:253.
5 Zhang XQ(张新全),Zhao YL(赵艳玲),Shan LM(山丽梅),et al.Study on protective mechanism of JMS on chemical liver injury.Pharm J Chin PLA(解放军药学学报),2004,20:259.
6 Chu L(褚良),Wang LB(王立波),Zhang Z(张哲),et al.Studies on the chemical composition Potentilla anserina L..Mod Chin Med(中国现代中药),2008,10(3):10.
7 Hong X(洪霞),Cai GM(蔡光明),Xiao XH(肖小河).Triterpenoids from roots of Potentilla anserina L..Chin Tradit Herb Drugs(中草药),2006,37:165.
8 Pi L(皮立),Hu FZ(胡凤祖).The GC-MS analysis of the lipid compounds from Potentilla anserina L..Chin Tradit Herb Drugs(中草药),2007,38:1625.
9 Wei W(韦薇),Chen F(陈锋),Shen AH(沈爱华).Chemical composition and pharmacological research on Potentilla anserina L..Mod Med J China(中国现代医药杂志),2008,10:131.
10 Yang H(杨桦),Jia X(贾旭),Yi H(易红).Determination of polysaccharide in root of Tibetan medicine Potentilla anserina L.Chin Tradit Herb Drugs(中草药),2001,32:29.
11 Liu CL(刘春兰),Lei MK(雷美康),Deng YH(邓义红),et al.Extraction and analysis of water soluble polysaccharide of Potentilla anserine L..J Central Univ Nationalities,Nat Sci (中央民族大学学报,自科版),2007,16(1):16.
12 Tzianabos AO.Polysaccharide immunomodulators as therapeutic agents:structural aspects and biologic function.Clin Microbiol Rev,2000,3:523-533.
13 Chen HX,Zhang M,Qu ZS,et al.Antioxidant activities of different fractions of polysaccharide conjugates from green tea (Camellia Sinensis).Food Chem,2008,106:559-563.
14 Jin Y,Hang ZL,Chen L,et al.Carbohydr Res,2003,338: 1517-1521.
15 Sun ZW(孙志伟),Liu LJ(刘凌君),Hu BJ(户宝军).Preparation of 1-(2-naphthyl)-3-methyl-5-pyrazolone as precolumn derivatization reagent for separation and determination of saccharides using HPLC-MS.Chin J Chromatogr(色谱),2008,26:200.
16 Shen T(沈同),Wang JY(王镜岩).Biochemistry(生物化学).Beijing:Higher Education Press,1990.347.
17 Chen XQ(陈小强),Ye Y(叶阳),Cheng H(成浩).Spectral analysis of crude tea polysaccharides extracted by different methods.Spectr Spectr Anal(光谱学与光谱分析),2009,29:1083.
18 Suzuki S,Tanaka R,Takada K.Analysis of sialo-N-glycans in glycoproteins as 1-phenyl-3-methyl-5-pyrazolone derivatives by capillary electrophoresis.J Chromatogr A,2001,910:319-329.
19 Li B(李波),Xu SY(许时婴).Determination of uronic acidfrom polysaccharide with GC.Chin J Chromatogr(色谱)2004,22:560.
Spectral Properties and Monosaccharides Compositon Analysis of Polysaccharide from Potentilla anserina L.
XIA Lian1,2,3,SUN Zhi-wei1,3,LI Guo-liang1,3,SUO You-rui1,YOU Jin-mao1,2*1Key Laboratory of Life-Organic Analysis of Shandong Province,College of Chemistry Science,Qufu Normal University,Qufu 273165,China;2Northwest Plateau Institute of Biology,the Chinese Academy of Sciences,Xining 810001,China;3Graduate University of Chinese Academy of Sciences,Beijing,100049,China
The polysaccharide of Potentilla anserine L.was extracted and purified,and its contents was determined as 98.4%by phenyl-sulfuric acid method.The polysaccharide was identified by IR spectrum and UV scanning spectrum.The IR spectrum indicates that the characteristic absorption peaks at 3600-3200,3200-2800,1400-1200,1200-1000 cm-1,and 845 cm-1belonged the characteristic peak of α-pyranose.In addition,the peak at 1630 cm-1assigned to the C=O of acetamide moiety stretching vibration meant that amino sugars exited in the polysaccharide.A method was developed for the separation of derivatized carbohydrates of Potentilla anserine L.using 1-naphthyl-3-methyl-5-pyrazolone(NMP)as derivatization reagent by capillary zone electrophoresis,and the results shows that the monosaccharides compositions of the polysaccharide from Potentilla anserine L.are xylose,arabinose,glucose,rhamnose,mannose,fucose,galactose,glucuronic acid and galacturonic acid with contents of 3.945,77.445,17.568,17.646,3.942,2.165,65.268,13.037 μg/ mg,and 33.484 μg/mg,respectively,which are consistent with the results carried out by GC-MS.
Potentilla anserine L.;polysaccharide;spectral properties;monosaccharide composition
1001-6880(2011)03-0453-05
2009-10-15 接受日期:2010-06-12
国家自然科学基金(20075016);中国科学院“百人计划”项目(328)
*通讯作者 E-mail:jmyou6304@163.com
R284.2
A
