响应面法优化大肠杆菌表达Hyperthermus butylicus耐热醛缩酶诱导条件的研究
2011-11-22裴晓林李诚璐王秋岩谢开林傅陈露
裴晓林,李诚璐,王秋岩,谢开林,傅陈露,张 勇,谢 恬
(杭州师范大学生物医药与健康研究中心,浙江 杭州 310012)
响应面法优化大肠杆菌表达Hyperthermus butylicus耐热醛缩酶诱导条件的研究
裴晓林,李诚璐,王秋岩,谢开林,傅陈露,张 勇,谢 恬
(杭州师范大学生物医药与健康研究中心,浙江 杭州 310012)
为了提高重组耐热2-脱氧核糖-5-磷酸醛缩酶的表达水平,该文基于中心组合实验的响应面分析方法,对基因工程E.coli的诱导条件进行了优化,具体考察因素包括诱导剂(异丙基-β-D-硫代半乳糖,IPTG)浓度和诱导时机.实验结果表明该方法可以提高目标蛋白的表达量,依据回归分析确定了最佳诱导条件为:IPTG浓度0.57 mM,诱导时机OD600为0.76,理论最佳DERA的比活力为1.124 u/mg,而实际平均比活力达到1.178 u/mg,两者几乎相等,说明该模型与实际情况基本相符.
2-脱氧核糖-5-磷酸醛缩酶;响应面;中心组合;诱导条件;大肠杆菌
0 前 言
不对称醛醇缩合反应在精细化学品制备中是一类极为重要的反应,目前主要采用金属离子的催化,而由醛缩酶催化的生物方法显示出更高的环境友好性[1].2-脱氧核糖-5-磷酸醛缩酶(2-Deoxyribose-5-phophate aldolases,DERAs, EC 4.1.2.4)属于第Ⅰ类醛缩酶,催化乙醛和D-3-磷酸甘油醛之间的缩合反应,形成5-磷酸-2-脱氧核糖[2].值得注意的是,DERAs与其它醛缩酶比较,最大的区别在于其底物和产物都是醛类,因此可以催化连续的醛缩反应[3].研究表明,该酶以3分子的乙醛为底物,经过2步连续的缩合生成2,4,6-三脱氧己糖,可以作为中间体应用于抗癌药物Epothilone A和C、 Iminocyclitols,以及降血脂药物Statins类等的合成中[4-5].到目前为止,不同的DETAs已经被报道和研究,包括原核、真核和古细菌[6-7],而来源于嗜热微生物的DERAs由于其较高的热稳定性和有机溶剂耐受性更加引人关注.2007年,Sakuraba等报道了两种嗜热微生物的醛缩酶,即DERAPae和DERATma,显示出较高的连续催化效率和底物耐受性[8].Wang等也报道了不同来源的耐热DERAs,表现出良好的热稳定性和乙醛耐受性[9-10].
基因工程E.coli生产目标产物不仅与宿主自身的遗传特性有关,而且与营养环境和表达条件密切联系,其中诱导剂浓度和诱导时机对重组蛋白的表达影响最为明显[11-13].对重组蛋白诱导条件优化的经典方法是单因子法,但是当影响因素较多时需要大量的实验次数,而且可能导致不可靠的甚至错误的实验结论,尤其对具有交互作用的影响因素.响应面分析方法(Response surface methodology,RSM),包括因素设计和回归分析,依据有限的实验结果评价各种影响因素和构建模型,并考察各因素之间的交互影响,最终预测最优化的环境条件[14].该研究以实验室构建的耐热DERA重组菌株E.coliBL21(pET303-DERA008)为对象,采用中心组合设计(Central composite design,CCD)优化该酶表达过程中的诱导剂浓度和诱导时机,建立目标重组蛋白诱导条件的数学模型,并预测和验证最佳的诱导条件,提高目的活性蛋白的表达水平.
1 材料和方法
1.1 实验材料
菌种和质粒:E.coliBL21 (DE3)是重组耐热DERA的表达宿主,载体为pET303-DERA008,以T7为启动子,氨苄青霉素(Amp)作为筛选标签.该菌株于-80 ℃甘油保藏.
主要试剂:胰蛋白胨(Typtone)和酵母抽提物(Yeast extract)购自OXOID公司;2-脱氧-D-核糖-5磷酸(DRP),磷酸丙糖异构酶(Triose-phoshate isomerase)和甘油-3-磷酸脱氢酶(Glycerol-3-phosphate dehydrogenase)购自Sigma公司;十二烷基硫酸钠(SDS)、牛血清蛋白(BSA)、Amp和异丙基-β-D-硫代半乳糖(IPTG)购自Genview公司;四甲基乙二胺(TEMED)购自Aldrich公司;其它试剂均为国产分析纯.
1.2 诱导表达
基因工程E.coli的甘油保藏液在含氨苄青霉素(1 mmol/L)的LB固体平板(含15 g/L琼脂)上划线,于37 ℃过夜培养.挑取单克隆于5 mL液体LB培养基中,37 ℃和200 rpm振荡培养,当OD600大于1.5时,此培养物作为诱导实验的种子液.诱导实验在装有100 mL液体LB培养基的500 mL摇瓶中进行,接种量为3%(v/v),37 ℃振荡培养至不同的菌体密度时添加不同量的IPTG.诱导温度降为30 ℃,诱导时间为4 h.
1.3 纯化方法
诱导结束后,于4 ℃条件下,5 000×g离心5 min收集细胞,重悬于磷酸缓冲液(0.1 M, pH 7.4)中,调整最终OD600约为8.细胞破碎采用超声法(Sonicator 4000, MISONIX, USA),程序设定为6 s开/6 s关,总时间为2 min.然后,11 270×g离心20 min取上清液作为粗酶液.耐热DERA采用Ni柱亲和层析进行纯化,操作按照纯化手册进行(Ni-Sepharose HP, Amersham Biosciences, Freiburg,Germany).SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析酶蛋白表达和纯化情况,分离胶浓度为15%.蛋白浓度采用Bradford法测定,以BSA(Bovine serum albumin)作为标准蛋白.
1.4 酶活力测定
DERA活力由DRP的分解活性确定,在Triose-phoshate isomerase和Glycerol-3-phosphate dehydrogenase的耦合作用下检测NADH的氧化[8].1个酶活单位(U)定义为1 min氧化1 μmol NADH的酶量.
1.5 中心组合实验设计及数据分析

表1 响应面分析因子及水平Tab. 1 Experimental range and levels of the independent variables
综合单因子实验结果,根据Box-Behnken中心组合实验设计原理,采用全因素3水平进行设计.每个因素设定为中心点(0)和高低水平(-1和+1),13次实验用于优化E.coli表达重组DERA的诱导条件 (表1和2).实验数据的多项回归分析及数学模型的建立和评价由统计学软件SAS®V8.02 (SAS Institute Inc., Cary, NC, USA)完成.该实验平行进行3次,结果以算术平均值加减标准偏差表示.
1.6 表达条件数学模型的建立和实验验证
根据上述CCD实验的重组蛋白表达实际值计算数学模型中的变量编码值,公式如下:
xi=(Ai-A0)/ΔA
(1)
A0是Ai中心点的真实值,ΔA是变量的极差.
再利用二次方程,构建该研究中目标蛋白表达和诱导条件优化的数学模型,公式如下:
(2)
y为响应值,xi和xj是变量的编码值,β0,βi,βii,和βij是模型的回归系数,分别表示常数项、线性、平方和乘积系数.根据该模型计算获得最佳表达条件的预测值进行目标重组蛋白的表达实验,评价预测的准确性.
2 结果与讨论
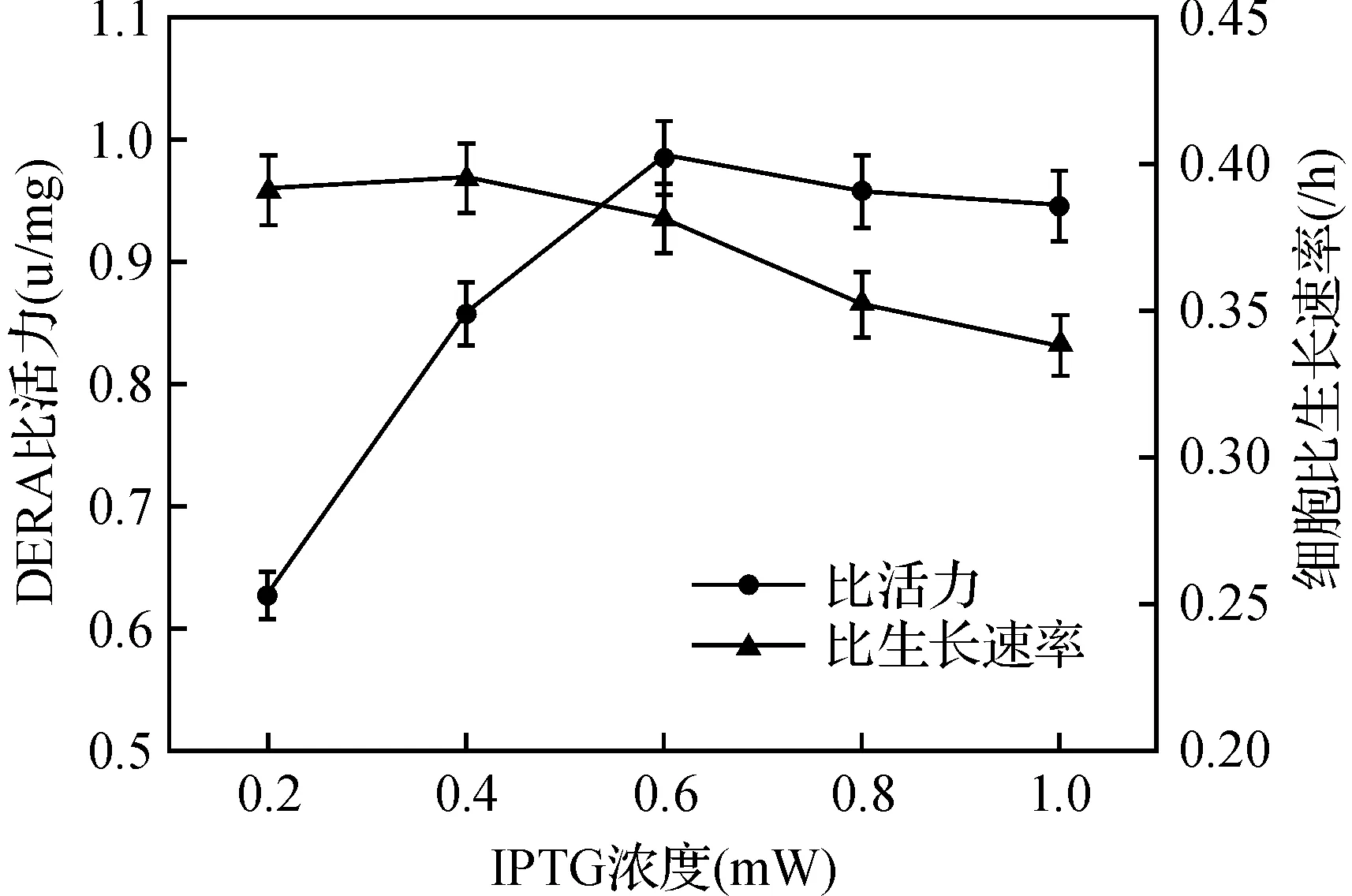
图1 IPTG浓度对重组E. coli表达耐热DERA的影响Fig. 1 The effect of IPTG concentration on expression of the recombinant thermophilic DERA in E. coli
2.1 IPTG浓度对重组DERA诱导表达的影响
由图2可知,当IPTG浓度为0.6 mM时,重组DERA的比活力达到最大值,即0.98 u/mg.当IPTG浓度低于该值时,目标蛋白的比活力下降;而高于该值时,比活力也没有增加,基本维持在0.95 u/mg以上.细胞比生长速率表现出不同的变化趋势,当IPTG浓度低于0.6 mM时,该值变化较小;而高于此临界点时,细胞比生长速率明显下降.该现象可能与细胞摄取IPTG的方式有关.乳糖透性酶(Lactose permease)参与IPTG的穿透细胞膜过程,且在较低浓度水平下可以被完全诱导[15].然而,在IPTG较高浓度下,其它非特异性途径也被激活,部分抑制了细胞的生长[16].
2.2 响应面实验设计和结果
在单因子实验结果的基础上,结合重组E.coli的生长情况,诱导时机分别设定为细胞对数生长的前期、中期和后期.响应面优化实验和结果如表2.1~9为析因实验,10~13为中心点实验,用于估计实验误差.根据表2的实验结果,通过SAS软件处理将各因素回归拟合得到回归方程,该实验的回归方程为:

y为耐热DERA的比活力,x1和x2为自变量诱导时机和IPTG浓度的编码值.

表2 响应面实验设计及重组DERA的生产Tab. 2 Three-level factorial RSM design according to two factors showing biomass and recombinant DERA production
a比活力定义为每毫克蛋白所具有的酶活力(u/mg)
2.3 回归方程的方差分析
采用SAS对表2数据进行ANOVA分析,结果见表3.该模型的R2值为92.8%,说明该回归方程具有较好的拟合程度.P值为0.000 7,说明该模型对描述实验结果十分显著.另外,失拟系数的P值为0.621,在统计学上分析其影响不显著(P>0.05),说明该模型对实验结果具有较好的可预见性.同时由表3中的P值判断,x1,x1x1和x2x2对y值的影响达到显著水平,说明实验因子对响应值不是简单的线性关系,且与二次项也有很大的关系,而交互作用的影响相对较小.
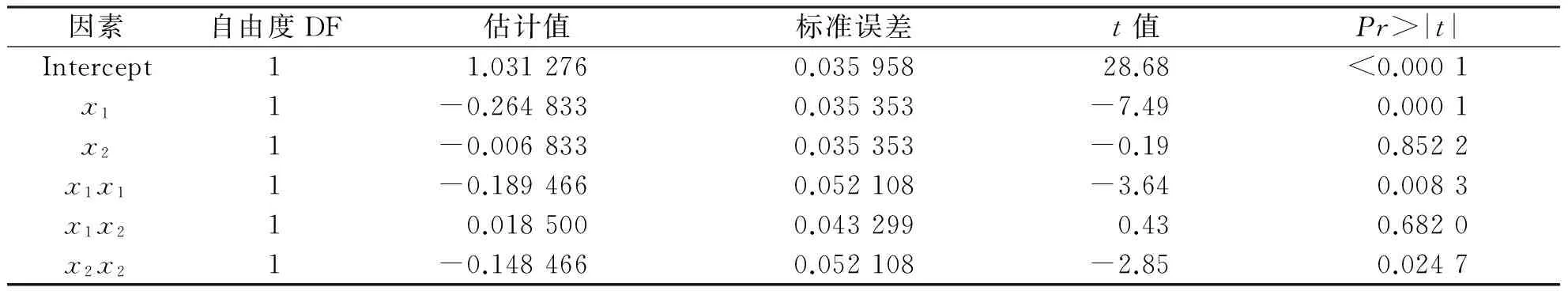
表3 重组DERA优化模型的回归分析Tab. 3 Results of regression analysis of a full second-order polynomial model for optimization of recombinant DERA production
2.4 响应面直观分析
图2直观地显示了IPTG浓度和诱导时机对目标蛋白诱导表达的交互作用.在实验中所选的范围内存在最大值,及相应面的最高点,同时也是等值线最小椭圆的中心点,而该点处于诱导时机的低水平附近,这与实际实验过程相互吻合,即在细胞对数生长期的初期进行诱导有利于目标蛋白的活性表达.
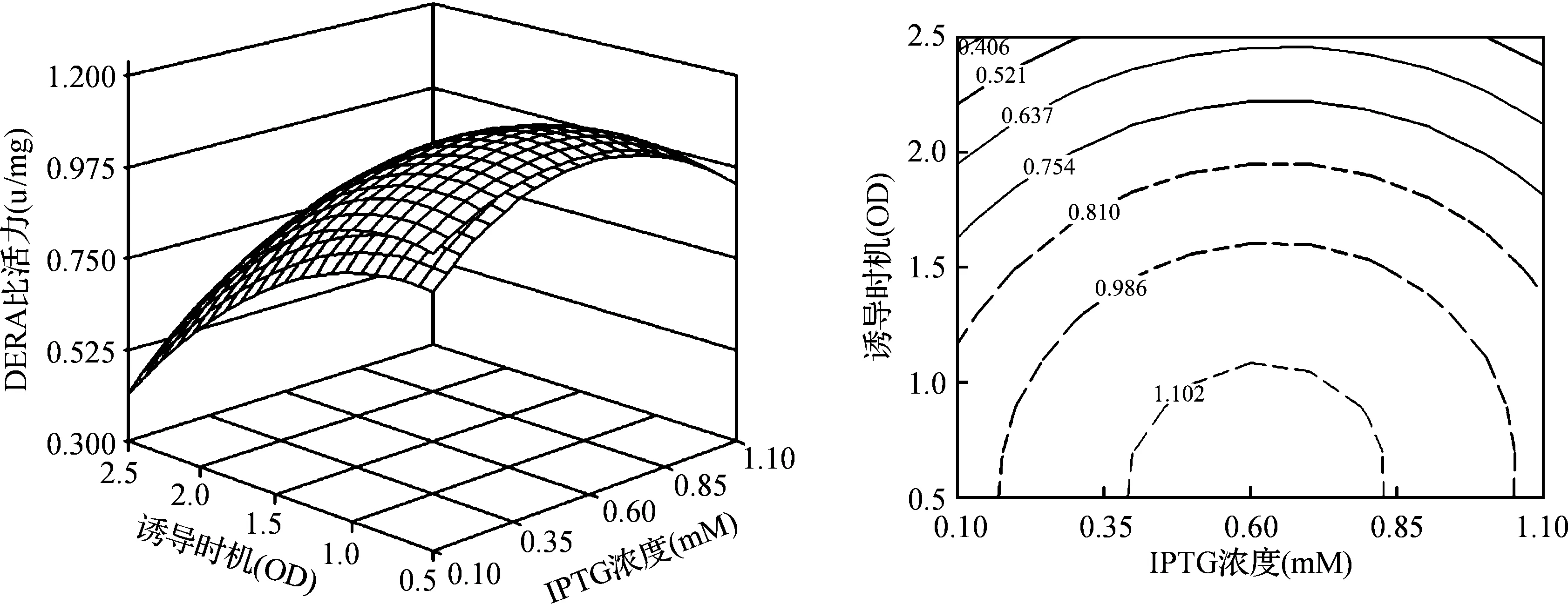
图2 IPTG和诱导时机对重组DERA表达影响的响应面和等值线图Fig. 2 Response surface plot of specific activity (u/mg) as a function of biomass at the time of induction (OD) and inducer (IPTG) concentration (mM)
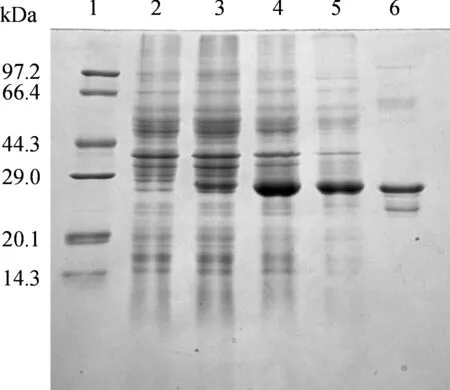
1:Protein MW Marker (TaKaRa);2:BL21(DE3)原始菌株;3:BL21(pET303-DERA008)未诱导;4:BL21(pET303-DERA008)IPTG诱导;5:诱导表达后总上清蛋白;6:Ni-柱纯化后的目的蛋白DERA图3 耐热DERA在最佳诱导条件下的表达和纯化Fig. 3 Expression and purification of the recombinant thermophilic DERA under optimized conditions
2.5 最佳诱导条件的确定
由SAS软件分析得到最大响应值,其对应的最佳诱导条件:诱导时机(OD)和IPTG浓度分别为0.76和0.57 mM,理论最佳DERA的比活力为1.124 u/mg.为了验证该模型预测的最佳条件,3次平行实验得到的实际平均耐热DERA活力为1.178 u/mg,与理论值相当,进一步说明该方程与实际情况具有较好的拟合度,验证了该模型的正确性.目标蛋白的表达与纯化如图3.
3 结 论
文章采用响应面法优化了E.coliBL21 (pET303-DERA008)表达耐热DERA的诱导条件,利用SAS软件建立了提高该酶表达的二次多项式模型,确定最佳工艺条件为:IPTG浓度0.57 mM,诱导时机OD600为0.76,理论最佳DERA的比活力为1.124 u/mg,实际平均比活力为1.178 u/mg,两者几乎相等.该方法有效优化了目标重组蛋白的诱导条件,同时也为该工程酶的中试发酵提供重要的参考依据.
[1] Dean S M, Greenberg W A, Wong C H. Recent Advances in Aldolase Catalyzed Asymmetric Synthesis [J]. Adv Synth Catal,2007,349(8/9):1308-1320.
[2] Chen L, Dumas D P, Wong C H. Deoxyribose-5-phosphate Aldolase as a Catalyst in Asymmetric Aldol Condensation [J]. J Am Chem Soc,1992,114(2):741-748.
[3] Wong C H, Garcia-Junceda E, Chen L,etal. Recombinant 2-Deoxyribose-5-phosphate Aldolase in Organic Synthesis Using of Sequential Two-substrate and Three-substrate Aldol Reactions[J]. J Am Chem Soc,1995,117(12):3333-3339.
[4] Samland A K, Sprenger G A. Microbial Aldolases as C-C Bonding Enzymes-Unknown Treasures and New Developments[J]. Appl Microbiol. Biotehnol,2006,71(3):253-264.
[5] Machajewski T D, Wong C H. The Catalytic Asymmetric Aldol Reaction[J]. Angew Chem Int Ed,2000,39(8):1352-1374.
[6] Groth D P. Deoxyribose 5-phosphate Aldolase[J]. J Biol Chem,1967,242(1):155-159.
[7] Sakuraba H, Tsuge H, Shimoya I,etal. The First Crystal Structure of Archaeal Aldolase[J]. J Biol Chem,2003,278(12):10799-10806.
[8] Sakuraba H, Yoneda K, Yoshihara K,etal. Sequential Aldol Condensation Catalyzed by Hyperthermophilic 2-Deoxy-D-Ribose-5-Phosphate Aldolase [J]. Appl Environ Microb,2007,73(22):7427-7434.
[9] Wang Qiuyan, Chen Rong, Du Pengfei,etal. Cloning and Characterization of Thermostable-deoxy-D-ribose-5-phosphate Aldolase fromHyperthermusbutylicus[J]. Afr J Biotechnol,2010,9(20):2898-2905.
[10] 李诚璐,杜鹏飞,裴晓林,等.嗜热微生物中获取耐乙醛变形醛缩酶[J].杭州师范大学学报:自然科学版,2010,9(5):373-378.
[11] Vidal L, Ferrer P,lvaro G,etal. Influence of Induction and Operation Mode on Recombinant Rhamnulose 1-Phosphate Aldolase Production byEscherichiacoliUsing the T5 Promoter[J]. J Biotechnol,2005,118(1):75-87.
[12] Tabandeh F, Khodabandeh M, Yakhchali B,etal. Response Surface Methodology for Optimizing the Induction Conditions of Recombinant Interferon Beta During High Cell Density Culture[J]. Chem Eng Sci,2008,63:2477-2483.
[13] Choi J H, Keum K C, Lee S Y. Production of Recombinant Proteins by High Cell Density Culture ofEscherichiacoli[J]. Chem Eng Sci,2006,61:876-885.
[14] Faven D D, Torre P, Aliakbarian B,etal. Response Surface Modeling of Vanillin Production byEscherichiacoliJM109pBB1[J]. Biochem Eng J,2007,36(3):268-275.
[15] Jensen P R, Westerhoff H V, Michelsen O. The Use oflac-type Promoters in Control Analysis[J]. Eur J Biochem,1993,211(1-2):181-191.
[16] Pinsach J, de Mas C, Lopez-Santin J. Induction Strategies in Fed-batch Cultures for Recombinant Protein Production inEscherichiacoli: Application to Rhamnulose 1-Phosphate Aldolase[J]. Biochem Eng J,2008,41(2):181-187.
ResponseSurfaceOptimizationforInductionConditionsonExpressionoftheThermophilicAldolasefromHyperthermusbutylicusinEscherichiacoli
PEI Xiao-lin, LI Cheng-lu, Wang Qiu-yan, XIE Kai-lin, FU Chen-lu, ZHANG Yong, XIE Tian
(Center for Biomedicine and Health, Hangzhou Normal University, Hangzhou 310012, China)
In order to improve the expression level of a recombinant thermophilic 2-Deoxyribose-5-phophate aldolase, the paper optimized the induction conditions inE.coilby the response surface methodology based on the central composite design. The factors included inducer concentration (mM, isopropyl β-D-thiogalactopyranoside, IPTG) and cell density (g/L) at the time of induction. The results show that this method can increase the expression quantity of protein, and determine the best induction condition, that is when IPIG density is 0.57 mG, and OD600is 0.76. The maximal DERA specific activity was 1.124 μ/mg which is nearly equal to the actual specific activity that is 1.178 u/mg, this result indicates that the model corresponds with the actual sistuation.
2-deoxyribose-5-phophate aldolase; response surface methodology; central composite design; induction condition;Escherichiacoli
10.3969/j.issn.1674-232X.2011.02.013
2010-11-01
浙江省科技厅重大项目(2007C01004-2).
裴晓林(1980—),男,山西运城人,研究实习员,硕士,主要从事生物化工研究.E-mail: pxl@hznu.edu.cn
*通信作者:谢 恬(1961—),男,浙江武义人,副教授,博士,主要从事中药与天然药物研发.E-mail: tianxie@hznu.edu.cn
Q819
A
1674-232X(2011)02-0153-05
