新型三唑醇类化合物的合成及抗真菌活性研究
2011-11-22王曙东陈兴东赵庆杰胡宏岗俞世冲柴晓云任海祥
王曙东,陈兴东,赵庆杰,邹 燕,胡宏岗,俞世冲,汪 亭,柴晓云,任海祥
(1.南京军区南京总医院,江苏 南京 210002;2.第二军医大学药学院,上海 200433)
·论著·
新型三唑醇类化合物的合成及抗真菌活性研究
王曙东1,陈兴东1,赵庆杰2,邹 燕2,胡宏岗2,俞世冲2,汪 亭2,柴晓云2,任海祥1
(1.南京军区南京总医院,江苏 南京 210002;2.第二军医大学药学院,上海 200433)
目的以氟康唑为先导化合物,设计合成新的三唑醇类化合物,并研究其抗真菌活性。方法引入较大基团的N,N-二取代侧链结构,合成一系列目标化合物,所有化合物结构均经MS、1H NMR等谱确证;选择8种真菌为实验菌株,测定其体外抗真菌活性。结果合成了18 个未见文献报道的目标化合物,化合物对所选真菌均表现出了一定的抑菌活性。结论引入较大基团的N,N-二取代侧链结构对抗真菌活性影响较大。
三唑衍生物; 合成;抗真菌活性
1 前言
真菌感染主要分为浅部和深部感染两类,深部感染严重时可危及人的生命。由于近年来临床上抗生素、化疗药物、免疫抑制剂的大量使用,以及艾滋病的流传,使深部真菌感染率急剧上升[1]。但目前氮唑类抗真菌药物具有肝、肾毒性等缺陷[2]。以及在长期大量使用过程中,耐药性问题日益突出,因而迫切需要开发新一代低毒、高效的氮唑类抗真菌药物。
羊毛甾醇14α-去甲基化酶为真菌中一重要的酶。本研究根据羊毛甾醇14α-去甲基化酶的活性位点[3]特征,结合本教研室前期的研究工作[4~7],以氟康唑为先导化合物,保留基本药效团三唑环,叔醇羟基和2,4-二氟苯基,引入酯及各种苄基三唑侧链结构。设计合成了18个目标化合物。合成路线见图1。
2 合成实验
熔点用YRT-3熔点测定仪(温度未校正)测定,质谱用安捷伦1100型质谱仪测定,1H NMR用Bruker spectmspin AC-P300和INNOVA-400型核磁共振仪(CDCl3为溶剂,TMS为内标)测定,所用试剂均为市售分析纯。
2.12-氯-2′,4′-二氟苯乙酮(3)的制备 参照文献[8]方法合成,收率77.1%。mp 47~48 ℃(文献[8]:46.5℃)。
2.22′,4′-二氟-2-(1H-1,2,4-三唑-1-基)苯乙酮(4)的制备 参照文献方法[8]合成,收率42.2%。mp 104~105℃(文献[8]:103~105 ℃)。
2.31-[(2,4-二氟苯基)-2,3-环氧丙基]-1H-1,2,4-三唑甲烷磺酸盐(5)的合成 参照文献[8]方法合成,收率56.0%,mp 131~133 ℃(文献[8]:128~129 ℃)。
2.4化合物(6)的合成 取1-[(2,4-二氟苯基)-2,3-环氧丙基]-1H-1,2,4-三唑甲烷磺酸盐(5) 20 g,甘氨酸乙酯盐酸盐15 g,和三乙胺20 ml加入300 ml无水乙醇中,搅拌、加热回流12 h,反应结束。蒸干溶剂,加乙酸乙酯300 ml萃取,依次以水100 ml×3,饱和食盐水100 ml×3洗涤,无水硫酸钠干燥。浓缩乙酸乙酯,通氯化氢气体,得白色固体13.9 g,收率61.2%。
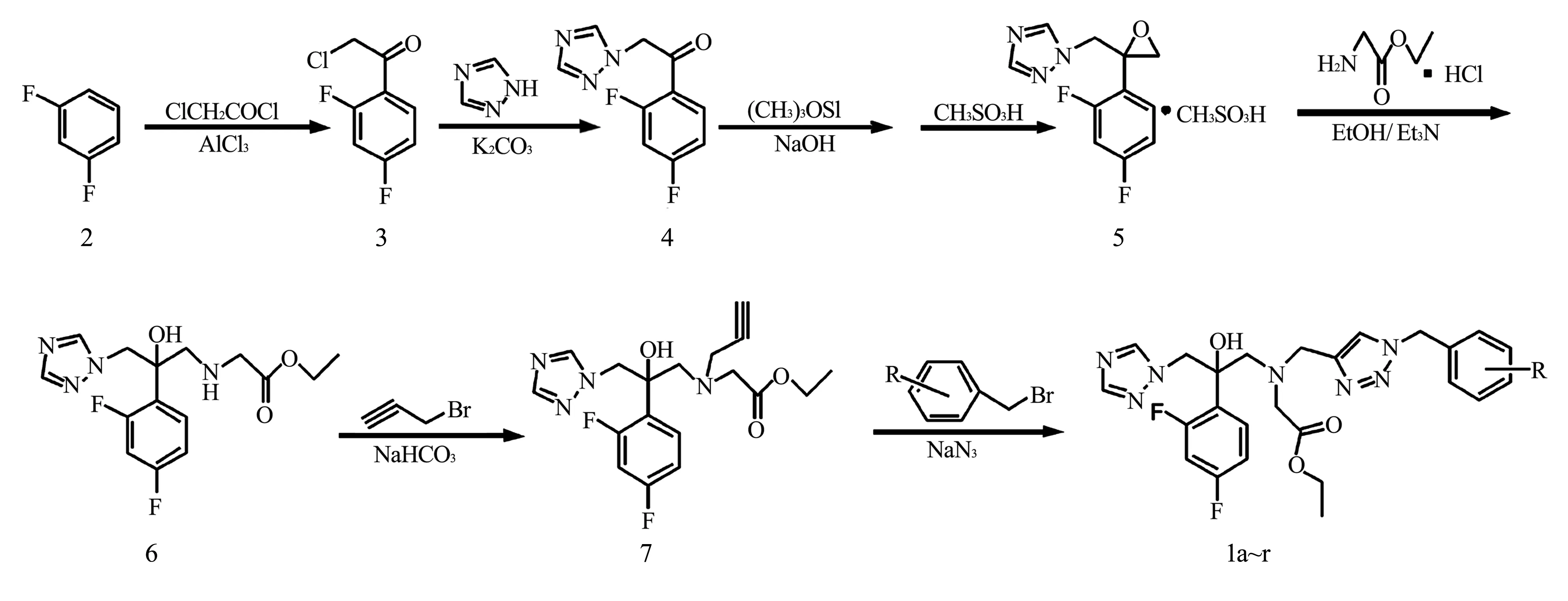
图1 目标化合物的全合成路线
2.5化合物(7)的合成 取化合物(6) 3.0 g(8 mmol),碳酸氢钠2.02 g(24 mmol) 于茄形瓶中,加入50 ml乙腈,搅拌10 min,然后加热回流,分批加入400 mg×3溴丙炔,TCL监测直到反应结束。蒸干反应溶剂,加乙酸乙酯100 ml萃取,依次水100 ml×3,饱和食盐水50 ml×3洗涤,无水硫酸钠干燥,浓缩乙酸乙酯,柱层析纯化(展开剂:乙酸乙酯:石油醚=3∶1),得黄色油状物2.2 g,收率72.9%。
2.6目标化合物1a~r 取NaN370 mg(1.08 mmol)于15 ml DMSO的茄形瓶中,加入邻氟溴苄250 mg(1.32 mmol),常温搅拌过夜,次日,称取化合物(7) 350 mg(0.93 mmol)溶入少量DMSO中,并快速加入抗坏血酸钠20 mg和无水硫酸铜25 mg(用1 ml水溶解),其它条件保持不变。TLC监测,常温搅拌至反应结束。反应完毕,反应液倒入稀NH3·H2O中,乙酸乙酯(30 ml×3)萃取,合并乙酸乙酯层,无水NaSO4干燥,过滤,浓缩,柱层析纯化(展开剂为CHCl3∶CH3OH=5:1)得黄色油状目标化合物1a。其他目标化合物1b~1s均按此法合成。结构、产率、MS和1H NMR数据见表1。
表1目标化合物的结构、性状及光谱数据



3 药理实验
体外抑菌实验 8种实验真菌菌株:白念珠菌SC5314(Candidaalbicans,C.alb2)、新生隐球菌ATcc56992(Cryptococcusneoformans,C.neo)、近平滑念珠菌(Candidaparapsilosis,C.par)、热带念珠菌(Candidatropicalis,C.tro)、红色毛癣菌(Trichophytonrubrum,T.rub)、克柔念珠菌(Candidakefyr,C.kef)、白念珠菌Y0109(Candidaalbicans,C.alb1)和薰烟曲霉菌(Aspergillusfumigatus,A.fum)。对照药物:氟康唑(Fluconazole, FCZ)、伊曲康唑(hraconazole, ICZ)、和特比萘酚(Terbinafine,TRB)。
采用美国NCCLS推荐的标准化抗真菌敏感性实验方法[9]测试其体外抗真菌活性,以目标化合物抑制所选真菌80%生长率的浓度作为判断终点( MIC80)。当药物的MIC80值超过测定浓度范围时,按以下方法进行统计:MIC80值高于最高浓度64 mg/L时,计为“>64 mg/L”;MIC80值为最低浓度或在最低浓度以下时,不作区别,均计为“≤24×10-5mg/L”。体外抑菌活性测试数据见表2。
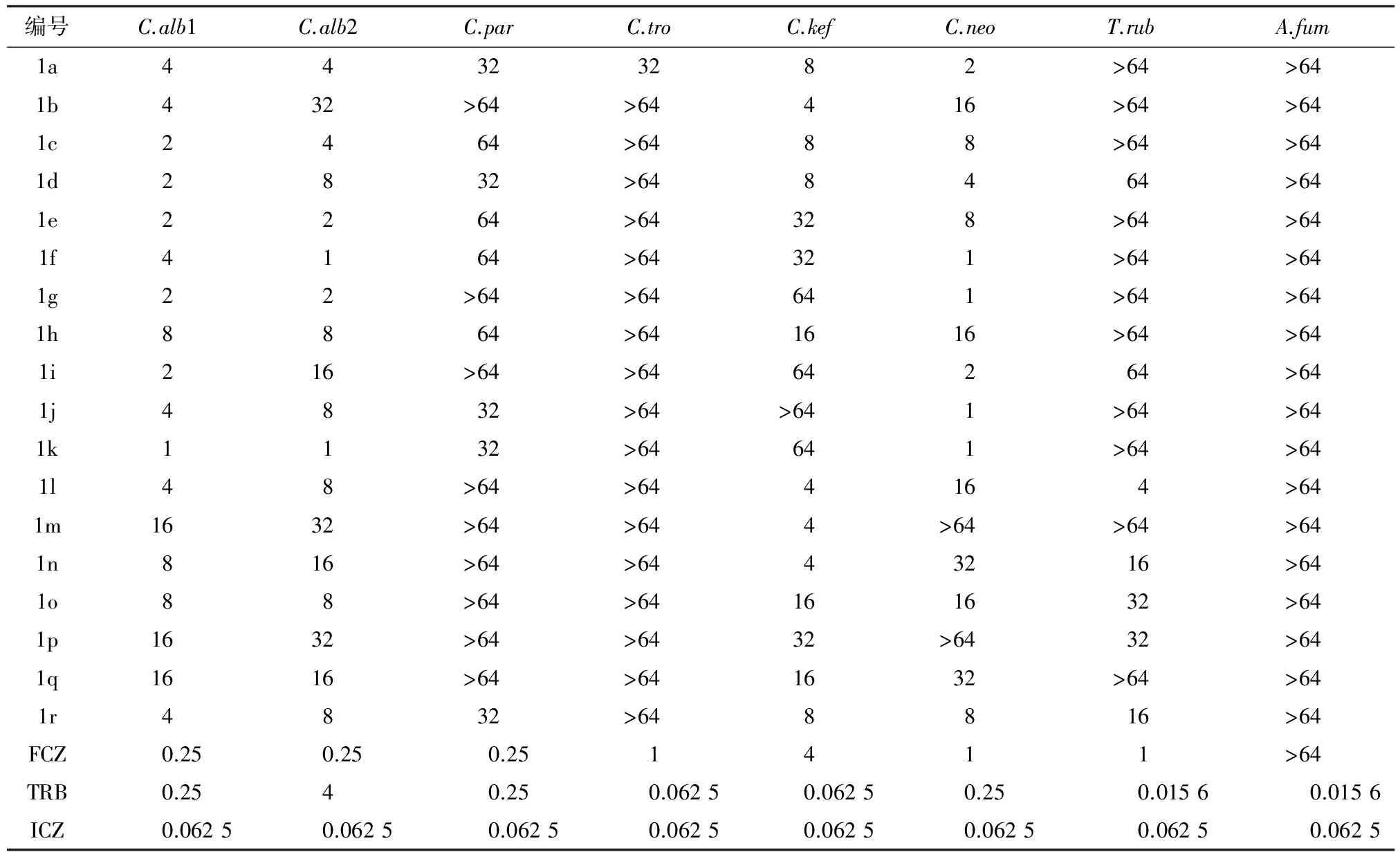
表2 目标化合物的体外抗真菌活性[MIC80( μg/ml)]
4 结果与讨论
初步体外抗真菌活性测试结果(表2)表明,所有目标化合物均对白念珠菌(Candidaalbicans)Y0109和白念珠菌(Candidaalbicans)SC5314有一定的抑制活性,同时部分化合物对克柔念珠菌(Candidakefyr)或新生隐球菌(Cryptococcusneoformans)也有一定抑制作用。其中化合物1f和1k对白念珠菌(Candidaalbicans)SC5314的抑菌活性较好,为特比萘酚(TRB)的4倍。化合物1f、1g、1j和1k对新生隐球菌(Cryptococcusneoformans)的抑菌活性同氟康唑(Fluconazole,FCZ)相当。侧链同时引入乙酸乙酯和芳环N,N-二取代侧链,其抗菌活性相比引入较小基团[4~8]差,可能是由于酯与芳环的N,N-二取代侧链空间位阻较大,不利于化合物同靶酶活性位点的结合,从而影响了化合物的抗菌活性。由于化合物类型有限,抗菌活性同N,N-二取代侧链的构效关系还有待进一步研究。
[1] Nuccil M, Marr KA. Emerging fungal diseases[J]. Clin Infect Dis, 2005, 41: 521.
[2] ODDS FC. Resistance of yeasts to azole-derivative antifungals[J]. J Antimicrob Chemother,1993, 31(4): 46.
[3] Vanden Bossche H, Koymans L, Cytochromes P450 in fungi[J]. Mycoses, 1998,41: (Suppl. l): 32.
[4] Zhao QJ, Song Y, Hu HG,etal. Design, synthesis and antifungal activity of novel triazole derivatives[J]. Chinese Chemical Letters, 2007, 18: 670.
[5] Zhao QJ, Hu HG, Li Yw,etal. Design, Synthesis, and antifungal activities of novel 1H-triazole derivatives based on the structure of the active site of fungal lanosterol 14a-demethylase(CYP51)[J]. Chemistry &Biodiversity, 2007, 4: 1472.
[6] Chai XY, Zhang J, Yu SC,etal. Design, synthesis, and biological evaluation of novel 1-(1H-1,2,4-triazole-1-y1)-2-(2,4-difluoropheny1)-3-substituted benzylamino-2-propanols[J]. Bioorg Med Chem Lett, 2009, 19(6): 1811.
[7] 章杰兵, 但志刚, 柴晓云, 等. 1-(1H-1,2,4-三唑-1-基)-(2,4-二氟苯基)-3-[N-环丙基-N-(4-取代苄基)]-2-丙醇的合成及抗真菌活性[J]. 药学实践杂志, 2009, 27(2): 107.
[8] 赵庆杰, 宋 琰, 胡宏岗, 等. 1-(1H-1,2,4-三唑-1-基)-(2,4-二氟苯基) -3-取代-2-丙醇类化合物的合成及其抗真菌活性[J]. 中国药物化学杂志, 2006, 16(3): 150.
[9] National committee for clinical laboratory standards. Reference method for broth dilution antifungal susceptibility testing of yeasts,approved standard document M27-A2[S], PA: Wayne: 2002.
2010-07-07
[修回日期] 2011-03-04
Synthesisandantifungalactivityofthenoveltriazolecompounds
WANG Shu-dong1, CHEN Xing-dong1, ZHAO Qing-jie2, ZOU Yan2, HU Hong-gang2, YU Shi-chong,WANG Ting2,CHAI Xiao-yun2, REN Hai-xiang1
(1.The Nanjing General Hospital of Nanjing Military Command, Nanjing 210002, China; 2.School of pharmacy, Second Military Medical University, Shanghai, 200433, China)
ObjectiveTo design the synthesis and evaluate the antifungal active of the novel triazole compounds based on the structure of fluconazole.MethodsThe bigN,N-disubstituted group was introduced and a series of compounds were synthesized, all of them were confirmed by MS and1H NMR,etal. The antifungal activity were also evaluated against the eight common pathogenic fungi.ResultsEighteen compounds were synthesized,which exhibited activity against fungi tested.ConclusionThe bigN,N-disubstituted group introduced to the side chain could affected the antifungal activity.
triazole derivatives; synthesis; antifungal activity
国家自然科学基金资助项目(20772153),上海市重点学科资助项目 (B906).
王曙东(1963-),男,医学博士.
任海祥. E-mail:renhaixiang@126.com.
R914.5
A
1006-0111(2011)06-0426-05
