有氧训练对高温环境下运动大鼠免疫机能及抗氧化能力的影响
2011-11-22仇乃民郭成吉赵光高马思远
仇乃民 郭成吉 赵光高 马思远
(江苏省盐城工学院 体育部,江苏 盐城 224003)
有氧训练对高温环境下运动大鼠免疫机能及抗氧化能力的影响
仇乃民 郭成吉 赵光高 马思远
(江苏省盐城工学院 体育部,江苏 盐城 224003)
目的:探讨有氧训练对机体运动热应激下免疫机能与自由基代谢的影响及其可能机制。方法:健康雄性SD大鼠51只,随机选取45只分为对照组(A组)、热应激组(B组)、6周有氧训练组(C组)、1次有氧运动加热应激组(D组)与6周有氧训练末次加热应激组(E组),其余6只用于乳酸阈强度的测定。各组实验后取血清测定IL-2、SOD、MDA水平。结果:(1)B、D、E组经高温暴露后,大鼠肛温迅速升至39.65±0.25℃、41.02±0.14℃与39.97±0.29℃,均表现出呼吸急促、流汗、烦躁不安等,为典型的热应激症候。(2)B组血清IL-2、SOD、SOD/MDA均显著低于A组,MDA高于A组;D组血清IL-2、SOD、SOD/MDA均显著低于A组(P<0.01)与B组(P<0.05),MDA显著高于A组(P<0.01)与B组(P<0.05)。(3)C组血清IL-2、SOD(P<0.05)、SOD/MDA(P<0.05)高于A组,MDA显著低于A组;E组血清IL-2、SOD(P<0.05)、SOD/MDA(P<0.05)均高于D组,MDA显著低于D组。结论:运动热应激可导致自由基生成增多,加重组织细胞膜结构与功能的损害,导致温度调节的信号通路中断,体温失衡,可能通过调节神经—内分泌—免疫系统,抑制IL-2的分泌。IL-2可作为评价机体运动热应激下免疫机能变化的重要指标。有氧训练可拮抗运动热应激对免疫系统的损害。
有氧运动;热应激;白细胞介素-2;超氧化物歧化酶
机体在高温环境下进行有氧运动,受有氧代谢产热和环境热两种因素的共同作用,使机体处于运动热应激状态,易引起脱水、热痉挛、热衰竭与中暑等多种运动性病症,从而影响机体的运动能力与健康状况。近年来,运动热应激问题逐渐引起了国内外学者的关注,但对运动热应激所致免疫机能下降的防治手段的研究尚不多见。本研究旨在通过对比分析热应激、6周有氧运动、1次运动热应激与6周有氧运动末次热应激对大鼠血IL-2与自由基指标的影响,探讨有氧训练对运动热应激大鼠免疫机能的影响及其可能机制,为相关后续研究提供实验依据。
1 研究对象与方法
1.1研究对象
健康雄性SD大鼠51只(徐州医学院动物实验中心提供),体重196.39±18.17g。大鼠按组别分笼饲养,自然光照,通风条件良好,实验室温度为18-25℃,相对湿度50-55%,自由进食(国家标准啮齿类动物固体混合饲料),自由饮水。实验前,所有动物均未进行过跑台运动。
1.2研究方法
1.2.1动物分组及处理因素
随机选取大鼠45只(其余的6只用于乳酸阈强度的测定)分为对照组(A组,n=9)、热应激组(B组,n=9)、6周有氧训练组(C组,n=9)、1次有氧运动加热应激组(D组,n=9)与6周有氧训练末次加热应激组(E组,n=9)5组。其中,A组既不运动也不加热应激;B组不运动,取样前加热应激;C组在常温环境下进行6周有氧训练;D组在高温环境下进行一次有氧运动;E组进行6周有氧训练,末次训练在高温环境下进行。
运动方案的制定:随机选取6只大鼠,进行逐级递增负荷的跑台运动,起始跑速为25m/min,每级运动5min,逐级递增跑速3m/min,至40m/min。安静时和各级运动后即刻取大鼠尾血测定血乳酸。根据各级负荷血乳酸浓度,采用Beaver等的对数转换法(Log-Log法),[1]计算出的乳酸阈跑速为30.2m/min。本研究采用跑台运动方式,大鼠常规喂养3天后,进行2天、每天1次的适应性跑台运动(运动时间为5min,第1天与第2天的跑速分别为10m/min与15m/min)。之后大鼠休息2天,第3天进行正式有氧训练。正式训练的运动强度依据乳酸阈强度的实验结果,参考其他大鼠跑台渐增负荷运动模型[2],采用:第1周10m/min×15min,第2周15m/min×20min,第3周18m/min×30min,第4周21m/min×40min,第5~6周24m/min×60min。每周训练5天。D组采用24m/min×60min进行一次高温环境下运动。
热应激方案的制定:参考以往研究结果[3],设定高温室(热应激室)干球温度为38.5±0.5℃,湿球温度35±1℃;常温室(空调室)干球温度为25±0.5℃,湿球温度21±1.0℃。将1间8m2的密封房间设计为热应激室,内置取器暖4只(功率为500-3000W)。通过调控取暖器的开放数量和功率,使热应激室保持在指定温度。B、D、E组在称重、测量肛温后放入热应激室,热应激时间为60min,实验后重测1次肛温。
1.2.2测试样品的采集
各组大鼠实验后即刻腹腔注射20%氨基甲酸乙酯(1.5-2克/公斤体重)麻醉,摘除眼球取血5ml,静置30min后,3000r/min离心15min,分离血清用于测定IL-2、SOD、MDA水平。
1.2.3指标检测方法
IL-2采用酶联免疫吸咐法(ELISA),SOD采用黄嘌呤氧化酶法,MDA采用硫代巴比妥酸法(TBA),血乳酸采用酶电极法。
1.2.4数据处理
2 研究结果
2.1热应激下大鼠基本状态变化
B、D、E组大鼠受热后肛温(B组:39.65±0.25℃,D组:41.02±0.14℃,E组:39.97±0.29℃)均明显高于受热前(B组:37.13±0.16℃,D组:37.58±0.34℃,E组:37.43±0.22℃),其中受热后肛温D组>E组>B组。三组大鼠受热60min后均表现出呼吸急促、流汗、烦躁不安等,为典型的热应激症候。B组还表现出活动减少,D组出现逃避行为、神情萎靡、运动能力下降等现象。
2.2血清IL-2、SOD、MDA、SOD/MDA水平的比较
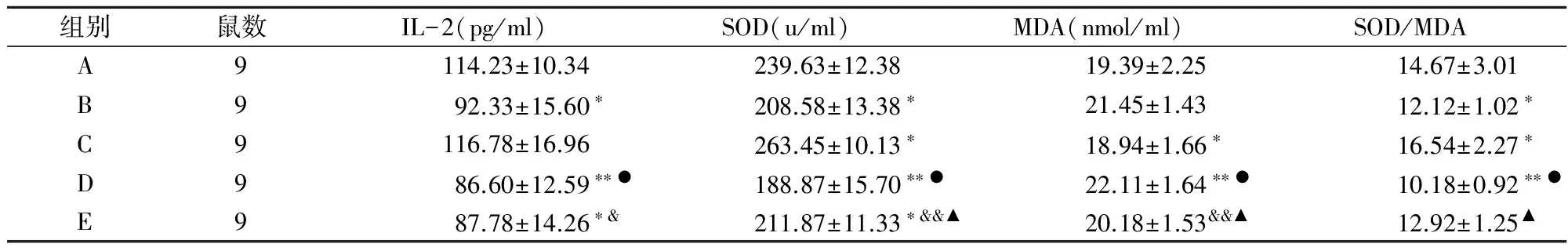
表1 各组大鼠血清指标的比较(x±s)
注:*P<0.05,**P<0.01 vs group A;●P<0.05 vs group B;&P<0.05,&&P<0.01 vs group C,▲P<0.05 vs group D
B组血清IL-2、SOD、SOD/MDA均显著低于A组,而MDA高于A组,但差异无显著性。C组血清IL-2、SOD、SOD/MDA高于A组,其中SOD、SOD/MDA指标呈显著性差异,而MDA显著低于A组。D组血清IL-2、SOD、SOD/MDA均显著低于A组(P<0.01)与B组(P<0.05),而MDA显著高于A组(P<0.01)与B组(P<0.05)。E组血清IL-2(P<0.05)、SOD(P<0.05)、SOD/MDA均低于A组,而MDA高于A组;血清SOD、SOD/MDA均高于低于B组,而IL-2、MDA均低于B组,但均无显著性差异;血清IL-2(P<0.05)、SOD(P<0.01)、SOD/MDA均低于C组,而MDA非常显著地高于C组;血清IL-2、SOD(P<0.05)、SOD/MDA(P<0.05)均高于D组,而MDA显著低于D组。(表1)
3 分析与讨论
3.1大鼠热应激模型的建立
热应激是指在环境温度超过机体的适温区上限的影响下,因机体体内产热与散热失衡而导致的一系列生理机能与行为上的负面反应。热应激症候群常分为热衰竭、热射病(含日射病)和热痉挛三种病症。本研究参考以往研究结果[3],将热应激环境设定为干球温度38.5±0.5℃,湿球温度35±1℃。结果显示,B、D、E组经高温暴露后,大鼠肛温迅速至39.65±0.25℃、41.02±0.14℃与39.97±0.29℃。前人实验结果表明,大鼠的致死温度一般为肛温43℃以上,本研究中大鼠最高肛温为41℃左右,连续暴露60 min后不会导致其严重衰竭或死亡。而热应激后三组大鼠均表现出呼吸急促、流汗、烦躁不安等,为典型的热应激症候。B组还表现出活动减少,D组出现逃避行为、神情萎靡、运动能力下降等现象。表明本研究设计的热应激方案能够满足研究设计要求,大鼠热应激模型建立成功。
3.2有氧训练对运动热应激大鼠免疫机能与自由基代谢的影响及可能机制
1976年,Morgen等发现加入植物血凝素(PHA)、ConA等丝裂原的小鼠脾细胞培养液上清液中含有一种能刺激胸腺细胞生长的可溶性物质,称为T细胞生长因子(TCGF),并1979年定名为IL-2。IL-2的识别受体称为IL-2R。IL-2具有调节局部免疫、间接抗肿瘤活性、间接抗病毒活性与免疫佐剂作用等。其中,IL-2在T细胞的增殖与分化过程中起着重要作用。IL-2是由Th1、Th0等细胞分泌,而Th2细胞不分泌。[4,5]近年来,许多学者常用IL-2水平评价机体运动性免疫抑制。众多研究中,常将SOD、MDA与SOD/MDA作为评定机体运动过程中的自由基损伤程度的重要指标。[6,7]SOD活性的变化情况可间接反映出运动中自由基的平衡状态以及体内的物质代谢;MDA水平可反映脂质过氧化程度,间接反映出细胞的损伤情况;SOD和MDA为反映脂质过氧化程度的一对指标,SOD/MDA值可反映自由基所导致的脂质过氧化与清除速率,有利于深入客观分析自由基的代谢情况。
3.2.1热应激与运动热应激对大鼠血清IL-2、SOD、MDA、SOD/MDA水平的影响
本研究中,B组血清IL-2、SOD、SOD/MDA均显著低于A组,而MDA高于A组;D组血清IL-2、SOD、SOD/MDA均显著低于A组(P<0.01)与B组(P<0.05),而MDA显著高于A组(P<0.01)与B组(P<0.05)。其可能机制是:在长时间的热应激或运动热应激环境中,机体的体温调节无法有效纠正机体的产热与散热失衡,当体温达到某一水平时,体温调节失衡和水盐代谢紊乱引起心血管和中枢神经等系统的功能障碍,机体出现热损伤。在这一过程中,下丘脑体温调节中枢的温度调定点保持不变,遭受热损伤的原因可能是自由基损伤破坏了组织细胞膜结构与功能的完整性,从而使温度调节的信号传导通路中断。自由基的产生增多的原因可能是:热应激与体温的升高引起体内儿茶酚胺分泌增加,机体可能出现严重的组织缺氧、缺血,细胞的能量消耗大于合成,为自由基的大量生成提供了条件。[8-10]此外,在缺血状态下,血液和组织中的SOD等抗氧化酶的活性下降且消耗增多,细胞清除自由基的能力下降。同时,机体产生的过量MDA又可氧化细胞膜中的多不饱和脂肪酸(PUFA),破坏细胞膜结构,导致细胞膜严重损伤。
体温的升高可通过“下丘脑-垂体-肾上腺素(HPA)”通路,引起的糖皮质激素(GC)、肾上腺素(E)和去甲肾上腺素(NE)分泌增多,这些激素通过抑制抗原递呈细胞(APC)分泌IL-12,下调T细胞和NK细胞表达IL-12R等作用,抑制JAK2/STAT4通路,抑制Th0细胞向Th1细胞分化,导致Th1/Th2失衡,引起运动性免疫抑制。[11-16]而IL-2是由分化抑制的Th1细胞分泌,Th2细胞不分泌,从而影响IL-2的生成。此外,IL-2和IL-1等细胞因子被认为是T细胞活化中除T细胞受体(TCR)识别MHC/抗原肽复合物(第一信号)与CD28结合其配体B7-1/2(第二信号)之外的第三信号分子,热应激或热应激加运动应激可通过抑制APC对IL-2的分泌作用而影响T细胞的增殖与分化。IL-2与T细胞表面IL-2R的结合是T细胞活化的重要标志,本研究提示,其水平可作为评价机体运动热应激下免疫机能变化的重要指标。D组非常显著地低于B组的研究结果提示:有氧运动加热应激相比单纯热应激表现出更强的运动性免疫抑制效应。
3.2.2有氧训练对运动热应激大鼠血清IL-2、SOD、MDA、SOD/MDA水平的影响
许多研究表明,有氧训练可提高机体SOD活性,降低MDA水平,提高机体的抗自由基能力。[17,18]本研究结果也显示,C组血清SOD、SOD/MDA显著高于A组,MDA显著低于A组。机体的体温调节是由神经内分泌系统的活动来完成,在热应激或运动热应激环境中,下丘脑体温调节中枢的温度调定点保持不变,视前区-下丘脑前部的热敏神经元(调定点神经元)发放冲动的增多,通过相应的神经联系,一方面促进汗腺的分泌,另一方面控制交感神经的活动,使交感神经紧张性减弱,皮肤血管扩张,散热增加,体温回降。在这一过程中,内分泌活动也对下丘脑体温调节中枢发挥着重要的负反馈调节作用。然而,自由基损伤则可能破坏了组织细胞膜结构与功能的完整性,使温度调节的信号通路中断。本研究中,6周的有氧训练显著降低了血MDA水平,提高了机体酶促体系中SOD等抗氧化酶的活性,通过与其它抗氧化物质的协同作用,增强了清除自由基的能力,保护细胞膜和生物大分子不受氧自由基的攻击,维持了信号通路的有效性。大鼠受热后的肛温也显示,E组(39.97±0.29℃)低于D组(41.02±0.14℃)。而E组血清SOD、SOD/MDA均显著高于D组,MDA显著低于D组的实验结果也佐证了这一机制。
许多研究发现,有氧训练能有效提升机体血IL-2水平,提高机体的免疫机能。[19,20]本研究中,C组血清IL-2水平也高于A组。如上所述,运动热应激导致的体温失衡可能通过调节HPA通路,GC、E、NE的分泌,IL-12分泌与IL-12R表达,JAK2/STAT4通路,Th1/Th2平衡,Th1分泌IL-2的作用;以及抑制APC对IL-2的分泌作用等,引起运动性免疫抑制。此外,IL-2作为T细胞活化中第三信号分子,运动热应激可通过抑制APC对IL-2的分泌作用而影响T细胞的增殖与分化。许多激素的分泌对长期运动训练具有适应性。儿茶酚胺表现为随着运动训练水平升高,对同一种负荷方式,其分泌量的增高幅度越来越小。有研究表明,7周相比1周运动训练后,NE跌幅达50%,E高达75%。[1]在GC方面,Sutton等发现[21]:和没有经过训练的人相比,耐力训练水平较高的人经过一次亚极量运动后,血浆促肾上腺皮质激素(ACTH)和皮质醇(C)含量要低得多。运动训练对GC、E、NE分泌的影响,可能提高机体APC的生物学功能。Ho CS与Upham JW研究发现[22,23]:运动训练可以增加外周血中树突状细胞(DC)的数量;中等强度运动过程中,DC的应答使得Th1/Th2平衡向Th1漂移,表现为IL-12、IL-2、IFN-γ等升高。同样,运动训练提高脾巨噬细胞(Mφ)功能的作用也得到了实验的证实[24]。在本研究中,经过6周有氧训练后,大鼠可能通过机体内以上生理生化变化,提高机体的免疫机能,拮抗末次运动热应激对免疫系统的损害,表现为:E组(87.78±14.26)血清IL-2高于D组(86.60±12.59)。
4 结论
1)本研究中B、D、E组经高温暴露后,大鼠肛温迅速至39.65±0.25℃、41.02±0.14℃与39.97±0.29℃,三组均表现出呼吸急促、流汗、烦躁不安等,为典型的热应激症候。B组还表现出活动减少,D组出现逃避行为、神情萎靡、运动能力下降等现象,表明本研究的大鼠热应激模型建立成功。
2)B组血清IL-2、SOD、SOD/MDA均显著低于A组,而MDA高于A组;D组血清IL-2、SOD、SOD/MDA均显著低于A组(P<0.01)与B组(P<0.05),而MDA显著高于A组(P<0.01)与B组(P<0.05)。这表明:热应激或运动热应激引起机体出现严重的组织缺氧、缺血,自由基生成增多,造成组织细胞膜结构与功能的损害,温度调节的信号传导通路中断,体温调节失衡。通过HPA通路,促进GC、E、NE等的分泌,影响APC分泌IL-12,下调T细胞和NK细胞表达IL-12R等,抑制JAK2/STAT4通路,抑制Th0细胞向Th1细胞分化,导致IL-2分泌减少;以及通过抑制APC对IL-2的分泌作用等,引起运动性免疫抑制。而有氧运动加热应激相比单纯热应激表现出更强的运动性免疫抑制效应。IL-2可作为评价机体运动热应激下免疫机能变化的重要指标。
3)C组血清IL-2、SOD(P<0.05)、SOD/MDA(P<0.05)高于A组,MDA显著低于A组;E组血清IL-2、SOD(P<0.05)、SOD/MDA(P<0.05)均高于D组,MDA显著低于D组。说明:有氧训练可通过提高机体酶促体系中SOD等抗氧化酶的活性,增强清除自由基的能力,抑制运动中GC、E、NE分泌的增高幅度,提升DC、Mφ等APC的数量与功能等作用,拮抗运动热应激对免疫系统的损害。
[1] 王瑞元.运动生理学[M].北京:人民体育出版社,2002.
[2] Bedford.T G,Tipton C M,Wilson W C,et al.Maximum oxygen consumption of rats and its changes with varions experimental procedures[J].J Appl physiol,1979,47(6):1278-1283.
[3] 谭志鑫,廖艳华.热应激对大鼠在体心肌缺血/再灌注性心律失常及抗氧化酶的影响[J].中国应用生理学杂志,2009,25(3):360-361,427.
[4] 赵武述.免疫平衡研究及其临床意义[M].北京:科学出版社,2005.
[5] 周光炎.免疫学原理[M].上海:上海科学技术出版社,2007.
[6] Finaud,Julien,Lac,et al.Oxidative Stress: Relationship with Exercise and Training[J].Sports Medicine,2006,36(4): 327-358.
[7] I Aksu,A Topcu,U M Camsari,et al.Effect of acute and chronic exercise on oxidant-antioxidant equilibrium in rat hippocampus,prefrontal cortex and striatum[J].Neuroscience Letters,2009,452(3):281-285
[8] NKJ Oksala,H Paimela,E Alhava,et al.Heat Shock Preconditioning Induces Protein Carbonylation and Alters Antioxidant Protection in Superficially Injured Guinea Pig Gastric Mucosa In Vitro[J].Digestive Diseases and Sciences,2007,52(8):1897-1905
[9] Ziya Akcetin,Reinhard Pregla,Alexander Busch,et al.Lipid Peroxidation and the Expressional Regulation of the Heat-Shock Response during Ischemia-Reperfusion of Rat Kidney[J].Urol Int,2000;65:32-39.
[10] 尹华祺.褪黑素对热应激小鼠抗氧化性能和免疫功能影响的研究[D].雅安:四川农业大学,2009.
[11] 黄文林,朱孝峰.信号传导[M].北京:人民卫生出版社,2005.
[12] R A Daynes,B A Araneo.Contrasting effects of glucocorticoids on the capacity of T cells to produce the growth factors interleukin 2 and interleukin 4[J].European Journal of Immunology,1989,19(12):2319-2325.
[13] A Cao,JI Ramos Martinez,R Barcia.Implication of PKA and PKC in the activation of the haemocytes of Mytilus galloprovincialis Lmk.by LPS and IL-2[J] Molecular Immunology,2004,41(1):45-52 .
[14] I J Elenkov,G P Chrousos.Stress Hormones,Th1/Th2 patterns,Pro/Anti-inflammatory Cytokines and Susceptibility to Disease[J].Trends in Endocrinology and Metabolism,1999,10(9):359-368.
[15] C S Hsieh,S E Macatonia,C S Tripp,et al.Development of TH1 CD4+ T cells through IL-12 produced by Listeria-induced macrophages[J].Science,1993,260(5107):547-549.
[16] Jonathan Peake.Heat,Athletes,and Immunity[J].American Journal of Lifestyle Medicine,2010,4(4):320-326.
[17] N Oztasan,S Taysi,K Gumustekin,et al.Endurance training attenuates exercise-induced oxidative stress in erythrocytes in rat[J].European Journal of Applied Physiology,2004,91(5):622-627.
[18] NA Güzel,H Sayan,D Erabas.Effects of Moderate Altitude on Exhaled Nitric Oxide,Erythrocytes Lipid Peroxidation and Superoxide Dismutase Levels[J].The Japanese Journal of Physiology,2000,50(2):187-190.
[19] SG Rhind,PN Shek,S Shinkai,et al.Effects of moderate endurance exercise and training on in vitro lymphocyte proliferation,interleukin-2 (IL-2) production,and IL-2 receptor expression[J].European Journal of Applied Physiology and Occupational Physiology,1996,74(4):348-360.
[20] 周萍.不同时相观察心理及运动因素影响健康的动物实验研究[D].南昌: 江西师范大学,2008.
[21] Sutton,J.R.Hormonal adaptations to exercise[M].Exercise fitness,and health: A consensus of current knowledge.1990: 217-257.
[22] Ho CS,Lopez JA,Vuckovic S,et al.Surgical and physical stress increases circulating blood dendritic cell countsindependently of monocyte counts[J].Blood,2001,98(1):140-145.
[23] Upham JW,Lundahl J,Liang H,et al.Simplified quantitation of myeloid dendritic cells in peripheral blood using flow cytometry[J].Cytometry,2000(10):50-59.
[24] LU Q,Ceddia MA,Price EA,et al.Chronic exercise increases macrophage-mediated anti-tumor cytolytic function in young and old mice[J].Am J Physiol,1999,276(2):482-489.
AerobicTrainingonImmuneFunctionandAntioxidantAbilityofRatsMovingonHighTemperatureEnvironment
Qiu Naimin,Guo Chengji,Zhao Guanggao,Ma Siyuan
(PE.Dept.of Yancheng Institute of Technology,Yancheng,224003,Jiangsu,China)
Objective: To investigate influences of aerobic exercise training on body immune function and free radical metabolism under heat stress and its possible mechanism.Methods: 45 of 51 healthy male SD rats were randomly selected and divided into control group (group A),heat stress group (group B),6 weeks of aerobic training group (group C),a bout of aerobic exercise and heat stress group (group D) and 6 weeks of aerobic training and heat stress group (group E),and the remaining six for the determination of lactate threshold intensity.IL-2,SOD,MDA levels of each group were measured in serum obtained after experiment.Results:(1) after high temperature exposure,in group B,D,E rat rectal temperature rapidly to 39.65±0.25 ℃,41.02±0.14 ℃ and 39.97±0.29 ℃ respectively ,with rapid breathing,sweating,irritability,etc.,which are typical symptoms of heat stress.(2) levels of serum IL-2,SOD,SOD/MDA in group B were significantly lower than that in group A,MDA was higher than that in group A; D serum levels of IL-2,SOD,SOD/MDA were significantly lower than that in group A (P<0.01) and group B (P<0.05),MDA was significantly higher than that in group A (P<0.01) and group B (P<0.05).(3) In group C,serum levels of IL-2,SOD (P<0.05),SOD/MDA (P<0.05) were higher than that in group A,MDA was significantly lower than that in group A; In group E,serum levels of IL-2,SOD (P<0.05),SOD/MDA (P<0.05) were higher than that in group D,MDA was significantly Lower than that in group D.Conclusion:Exercise heat stress may cause more free radicals,and increase damage of cell membrane structure and function of tissue,leading to interruption of the signaling pathways regulating the temperature,and imbalance of temperature,Possibly through regulation of nerve-endocrine-immune function and inhibition of IL-2 secretion.IL-2 can be used as an important indicator of immune function changes after body movement under heat stress.Aerobic exercise training could reverse damage of immune system by heat stress.
aerobic exercise;heat stress;interleukin-2;SOD
G804.7
A
1672-1365(2011)06-0001-04
2011-07-02;
2011-08-23
江苏省高校自然科学基础研究项目(08KJB340001)
仇乃民(1971-),男,江苏盐城人,博士研究生,研究方向:运动生理学、运动训练学理论与实践。
