HSV-TK逆转录病毒包装细胞系建立及病毒滴度测定
2011-11-21井宏宇钱东华吉林大学第一医院呼吸内科吉林长春3002
李 洋 钱 明 井宏宇 钱东华 (吉林大学第一医院呼吸内科,吉林 长春 3002)
HSV-TK逆转录病毒包装细胞系建立及病毒滴度测定
李 洋 钱 明1井宏宇 钱东华 (吉林大学第一医院呼吸内科,吉林 长春 130021)
目的 建立HSV-TK逆转录病毒包装细胞系并获得高产病毒的细胞株。方法 将TK基因与逆转录表达载体PLEGFP-N1连接后转染到包装细胞PA317中,经G418及荧光蛋白双重筛选得到高产病毒的细胞株。结果 经酶切鉴定成功构建PlEGFP-N1-TK重组载体,含HSV-TK基因重组逆转录病毒包装细胞PA317成功建立,经病毒滴度测定获得高产病毒的PA317/TK细胞株。结论 制备的重组病毒具有感染靶细胞的活性,为进一步应用HSV-TK基因进行肺癌的自杀基因治疗研究奠定基础。
HSV-TK;逆转录病毒;包装细胞PA317
恶性肿瘤的基因治疗是现代医学领域的研究热点,其中自杀基因疗法已经成为极富希望的肿瘤治疗新方法。自杀基因有多种,其中研究较多的主要有单纯疱疹病毒胸苷激酶基因/丙氧鸟苷(HSV-TK/GCV)和大肠杆菌胞嘧啶脱氨酶基因/5-氟胞嘧啶(CD/5-FC)两种自杀基因系统。本实验应用HSV-TK/GCV系统将TK基因与逆转录表达载体PLEGFP-N1连接后转染到包装细胞PA317中,经筛选得到高产病毒的细胞株,为HSV-TK/GCV自杀基因系统治疗肺癌奠定基础。
1 材料与方法
1.1 材料
1.1.1 载体、菌种和细胞株 pGEM-5Zf-HSV-TK,日本东京大学医学部苏肃博士慧赠;PLEGFP-N1,吉林大学第一医院中心研究室保存;PA317细胞,购自Clontech公司;小鼠成纤维细胞(NIH3T3)细胞,购自中国科学院细胞库;大肠杆菌DH5α,由东北师范大学遗传病研究所实验室保存。
1.1.2 主要试剂 脂质体转染试剂盒,凯基生物公司;高纯度质粒提取试剂盒,TIANGE公司;DNA片段凝胶回收试剂盒、T4 DNA连接酶、限制性内切酶、DNA-Marker,TaKaRa公司;DNA测序,上海生工生物技术有限公司。
1.1.3 主要试剂的配制 LB液体培养基:胰蛋白胨10 g/L、酵母抽提物5 g/L、NaCl 10 g/L、pH7.0;LA液体培养基:在LB培养基中加入氨苄青霉素80 μg/ml。LB平板:LB培养基中按15 g/L浓度加入琼脂粉;LA平板:LA培养基中按15 g/L浓度加入琼脂粉;以上均需高压灭菌(15磅、20 min)。溶液Ⅰ:25 mmol/L Tris-Cl(pH 8.0),10 mmol/L EDTA.2Na(pH 8.0),高压灭菌30 min,4℃冰箱中备用;溶液Ⅱ:0.2 mol/L NaOH,10%十二烷基硫酸钠(SDS),室温保存,现用现配(0.2 mol/L,1%为终浓度);溶液Ⅲ:5 mol/L乙酸钾 300 ml,冰醋酸57.5 ml,无菌水142.5 ml,室温下混匀,4℃冰箱中备用。
1.1.4 主要仪器 CO2培养箱,SANYO日本;高速低温离心机、PCR仪,美国Bio-Rad公司;DYY-Ⅲ稳亚稳流电泳仪、电泳槽,美国Bio-Rad公司;凝胶成像系统,美国IBM公司;ZF型紫外透射反射分析仪、GNP型隔水式恒温培养箱,上海精宏实验技术有限公司;快速恒温数显水箱,常州国华电器有限公司。
1.2 方法
1.2.1 真核表达载体pLEGFP-N1-TK的构建与鉴定 将载体pGEM-5Zf-HSV-TK、PLEGFP-N1 1 μl加入一管已制备好的感受态细胞中〔1,2〕进行细菌转化;含有 pGEM-5Zf-HSV-TK、PLEGFPN1转化细菌大量培养及质粒的提取与纯化;质粒的提取与纯化,按照试剂盒说明操作。对pLEGFP-N1和pGEM-5Zf-HSVTK质粒DNA用BglⅡ和HindⅢ分别进行双酶切,酶切后的plEGFP质粒和目的DNA片段TK按1∶5摩尔比进行连接,反应体系10 μl:T4 DNA 连接酶1 μl,16 ℃ 过夜反应。将连接产物进行转化和筛选,之后进行重组载体的提取和鉴定,得到pLEGFP-N1-TK并进行重组质粒DNA的大量提取与纯化。
1.2.2 PLEGFP-N1-TK重组质粒的转染、克隆细胞株的转移和扩增 用Lipofectamine2000将PLEGFP-N1-TK重组质粒转染PA317细胞中,G418和倒置荧光显微镜下观察绿色荧光蛋白双重筛选;将筛选出的克隆细胞株转移并扩增,转移的细胞克隆生长相互融合达80%时,用胰酶消化后,将其转移入25 ml培养瓶中继续培养,维持G418浓度在300 μg/ml。待细胞生长良好后,挑取生长良好的细胞株进行传代扩增,用于病毒滴度测定。提取PA317和PA317/TK细胞DNA,用PCR检测HSVTK基因整合情况。
1.2.3 重组逆转录病毒滴度的测定 取对数生长期的NIH3T3细胞,加含10%的小牛血清高清DMEM培养液,调整细胞浓度为2×105/ml,按1 ml/孔加入24孔板中,37℃ 5%CO2培养至细胞达60%融合。将收集到的含HSV-TK基因PA317 克隆细胞的病毒上清液分别作 10-1,10-2,10-3,10-4倍稀释;倒去NIH3T3细胞培养孔内液体,分别吸取1.5 ml稀释的病毒液(含polybrene 8 μg/ml)加入培养孔内,不同稀释度病毒各加 2孔,置 37℃,5%CO2条件下培养 3 d;更换含800 μg/ml G418的培养液,继续培养7~10 d,其间每3~4 d换液一次。未感染病毒的NIH3T3细胞在加入等量的G418后,一般第3~5天开始死亡,第7~10天基本完全死亡;而感染病毒的NIH3T3细胞仍有细胞存活,并逐渐会有新的细胞开始生长。约2 w细胞克隆基本完成;统计细胞克隆数,计算病毒滴度。
病毒滴度(CFU/ml)=2瓶细胞克隆数的平均数×病毒稀释液倍数(其中CFU为colony forming units)。
2 结果
2.1 重组载体pLEGFP-TK构建 将pLEGFP-N1质粒和pGEM-5Zf-HSV-TK分别以HindⅢ和BglⅡ进行酶切,经回收纯化和连接反应,构建成功PlEGFP-N1-TK重组载体,行凝胶电泳。见图1,图2。
2.2 重组载体pLEGFP-N1-TK的酶切鉴定结果 重组质粒分别进行HindⅢ和BglⅡ双酶切,将酶切产物进行1%琼脂糖凝胶电泳,在紫外灯下观察,结果在预期位置出现阳性条带与实验预想一致。见图3。
2.3 含HSV-TK基因重组逆转录病毒包装细胞PA317的建立
用脂质体转染法将载体pLEGFP-N1-TK导入PA317细胞,用400 μg/ml的G418筛选2 d后,细胞开始死亡;在4~5 d内死亡达高峰;5 d后有少数细胞贴壁生长;1 w后细胞逐渐形成阳性克隆细胞团;培养14 d后,筛选得到阳性克隆细胞。挑取其中生长较好的抗G418及带有绿色荧光的细胞克隆,再用含G418 800 μg/ml的低糖DMEM培养液进一步选择培养,最后形成的阳性克隆细胞命名为PA317/TK。见图4,图5。
2.4 PCR检测HSV-TK基因在PA317中整合情况 经PCR鉴定在PA317/TK细胞中检测到完整的约1.1 kb TK基因,而未转染TK基因的PA317细胞没有检测到TK基因。
2.5 PA317/TK细胞产病毒的滴度测定 用最终浓度800 μg/ml的G418筛选到的PA317/TK扩大培养后,收集病毒液,感染NIH3T3测定病毒滴度,结果为4×104cfu/ml。
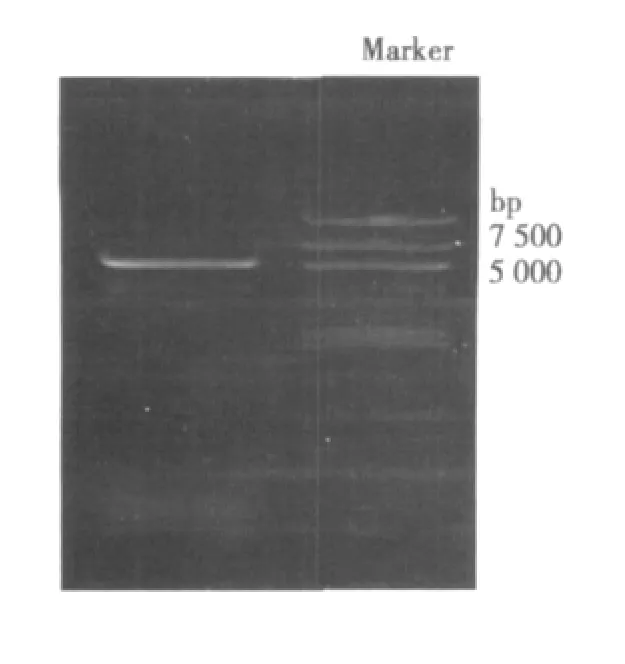
图1 pLEGFP质粒双酶切图

图2 pGEM-5Zf-HSV-TK双酶切
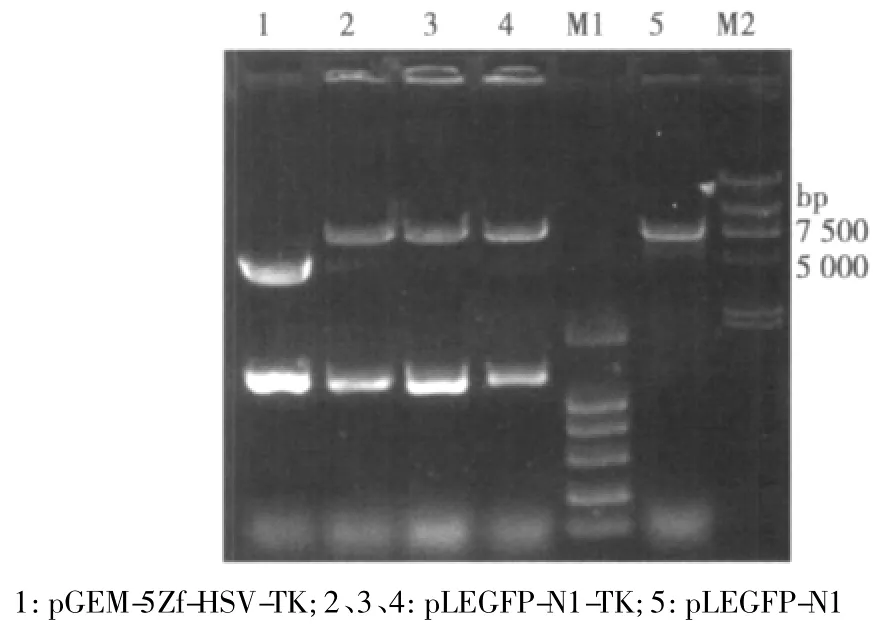
图3 重组载体pLEGFP-N1-TK双酶切结果
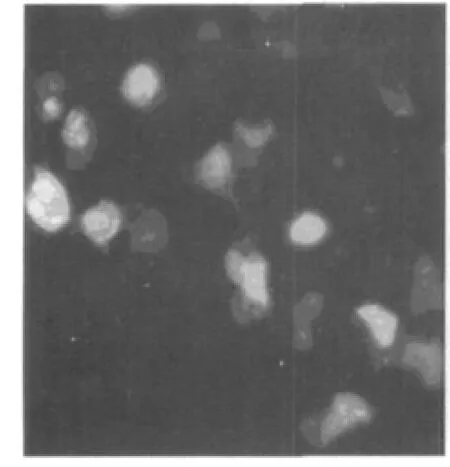
图4 PA317/TK细胞在荧光纤维镜下表现(×400)
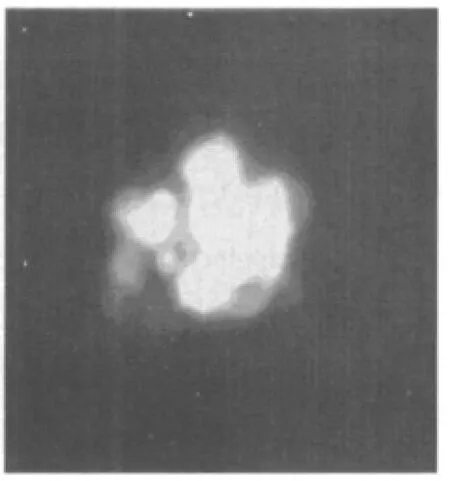
图5 经筛选形成阳性克隆细胞团(×400)
3 讨论
在目前的众多基因治疗实验中,逆转录病毒载体是被广泛采用的载体之一〔3〕,经过人工构建去除其中的3个功能基因(pol,gag,env),保留了其中的长末端重复序列(LTR)和包装序列ψ的复制缺陷型病毒,因此它不具备感染细胞的能力。它必需与一种经过改造的含有辅助病毒基因组的包装细胞相互重组,将病毒RNA包装进去,才产生具有感染能力的完整病毒颗粒,此病毒颗粒能感染靶细胞,但不能复制〔4〕。PA317是逆转录病毒的包装细胞,其内有逆转录病毒的辅助病毒基因组。因此,本文通过把带有TK基因的逆转录病毒载体PLEGFP-N1导入PA317中,建立含HSV-TK重组逆转录病毒包装细胞。
逆转录病毒载体PLEGFP-N1包含一个选择标记新霉素磷酸转移酶基因(neo),此外还有一个加强绿色荧光蛋白基因(green fluorescent protein,GFP)。当PLEGFP-N1-TK导入PA317后通过G418及GFP筛选得到细胞阳性克隆,在抗生素G418存在的培养基中,没有被导入PLEGFP-N1-TK的PA317细胞逐渐死亡,而导入PLEGFP-N1-TK的PA317细胞存活并逐渐生长,从而得到阳性细胞克隆PA317/TK。在G418筛选之前应做预实验,找出G418最适宜浓度,在最初筛选时应注意G418的浓度不能过高,待细胞生长稳定,neo基因在细胞中的表达达到一定程度时再改换高浓度的G418,以维持细胞克隆的筛选。本实验G418的初始筛选浓度为400 μg/ml,维持细胞克隆筛选浓度为800 μg/ml。由于逆转录病毒载体PLEGFP-N1含有GFP,所以通过倒置的荧光纤维镜观看被转染的PA317发出绿色荧光来进一步筛选阳性细胞克隆〔5〕。再通过病毒滴定度的测定挑选出产病毒较高的细胞株。
本实验将HSV-TK基因克隆至逆转录病毒表达载体PLEGFP-N1,经测TK基因序列正确后,用脂质体法将重组质粒导入逆转录病毒包装细胞PA317,包装后筛选出一株产感染性重组病毒细胞系PA317/TK,收集PA317/TK细胞培养上清液,再感染NI3T3细胞,测得病毒滴定度为4×104cfu/ml,从而证实了本实验制备的重组病毒具有感染靶细胞的活性,为进一步应用HSV-TK基因进行肺癌的自杀基因治疗研究奠定基础。
1 Culver KW,Ram Z,Wallbridge S,et al.In vivo gene transfer with retroviral vector-producer cells for treatment of experimental brain tumors〔J〕.Science,1992;256(5063):1550-2.
2 Vitek JA.Reliability of the“kiss of death”method for evaluation of intercellular communication:effect of cloning and culture technique〔J〕.Folia Biol(Praha),1989;35(3):171-6.
3 Jolly D.Viral vector systems for gene therapy〔J〕.Cancer Gene Ther,1994;1(1):51-64.
4 Reeves L,Smucker P,Cornetta K.Packaging cell line characteristics and optimizing retroviral vector titer:the National Gene Vector Laboratory Experience〔J〕.Hum Gene Ther,2000;11(15):2093-103.
5 Chalfie M,Tu Y,Euskirchen G,et al.Green fluorescent protein as a marker for gene expression〔J〕.Science,1994;263(5148):802-5.
Q344+.13
A
1005-9202(2011)16-3101-03
吉林省卫生厅资助项目(No.1021Z031);吉林大学研究生创新基金(No.医学704053)
1 吉林大学口腔医院
钱东华(1965-),女,副教授,硕士生导师,主要从事肺癌及肺部感染性疾病研究。
李 洋(1979-),女,主治医师,博士,主要从事肺癌和哮喘的研究。
〔2011-01-29收稿 2011-03-25修回〕
(编辑 袁左鸣/徐 杰)
