H. polygyrus感染对T细胞介导的炎症性肠病的影响及其作用机制研究*
2011-11-20李旺林吴小剑饶本强何晓生吴现瑞邹一丰WALKERAllan石海宁
李旺林, 兰 平, 吴小剑, 饶本强, 何晓生, 吴现瑞, 邹一丰, WALKER Allan, 石海宁△
(1中山大学附属第六医院结直肠外科, 广东 广州 510655; 2哈佛大学医学院麻省总医院黏膜免疫实验室,美国马萨诸塞州 查尔斯镇 02129;3广州医学院附属广州市第一人民医院,广东 广州 510180)
H. polygyrus感染对T细胞介导的炎症性肠病的影响及其作用机制研究*
李旺林1,2,3, 兰 平1△, 吴小剑1, 饶本强1, 何晓生1, 吴现瑞1, 邹一丰1, WALKER Allan2, 石海宁2△
(1中山大学附属第六医院结直肠外科, 广东 广州 510655;2哈佛大学医学院麻省总医院黏膜免疫实验室,美国马萨诸塞州 查尔斯镇 02129;3广州医学院附属广州市第一人民医院,广东 广州 510180)
目的研究多形螺旋线虫(H.polygyrus)感染对CD4+辅助性T细胞介导的小鼠炎症性肠病(IBD)的影响及其作用机制。方法用卵清蛋白(OVA)特异性的CD4+辅助性T细胞转入重度联合免疫缺陷(SCID)小鼠中制作IBD模型。将IBD小鼠感染H.polygyrus,14 d后处死小鼠,观察结肠的组织学变化,用ELISA法和流式细胞术检测肠系膜淋巴结中干扰素-γ(IFN-γ)和白细胞介素-4(IL-4)的表达。另外,对感染H.polygyrus的IBD小鼠注射IL-4单克隆抗体以阻断IL-4的分泌,9 d后处死小鼠,观察相同的指标。结果与无感染组相比,感染H.polygyrus的IBD小鼠结肠病损明显加重,肠系膜淋巴结中IL-4水平明显增高,IFN-γ水平明显降低(均Plt;0.05)。在IL-4阻断实验中,与无IL-4阻断组相比,IL-4阻断组结肠病损明显减轻,IL-4水平明显降低,IFN-γ水平明显增高(均Plt;0.05)。结论H.polygyrus感染在CD4+T细胞介导的IBD模型早期加重了炎症反应,其作用可能是通过诱导Th2细胞因子的分泌、抑制Th1细胞因子的分泌来实现的,提示用蠕虫治疗IBD时需谨慎。
炎性肠疾病; 多形螺旋线虫; T淋巴细胞,辅助性
炎症性肠病(inflammatory bowel diseases, IBD)是一组病因不明的慢性肠道炎症性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD)[1]。它是广泛影响健康的疾病之一,病理特征是结肠的黏膜及黏膜下层存在大量的炎症细胞浸润以及激活CD4辅助T细胞,自主免疫过度激活,导致严重的透膜性肠道黏膜炎症,产生大量炎症因子和趋化因子[2,3]。
近年来,我们已经观察到免疫介导性疾病(包括IBD)的发病率和寄生虫感染之间呈负相关关系[4]。据估计,全世界30亿人感染蠕虫。蠕虫感染的重要性不仅包括直接的蠕虫致病作用,而且对宿主的免疫系统起调节作用,这可能会改变宿主对其它抗原的反应,并导致另外的免疫病理性损伤。因此,我们构建了CD4+T细胞介导的IBD动物模型,并进一步研究蠕虫感染与炎性肠病之间的关系及其作用机制。
材 料 和 方 法
1动物
选择6-8周的雌性重度联合免疫缺陷(severe combined immunodeficiency,SCID)小鼠(SPF 级), 以高压蒸汽消毒的食物和水喂养。
2卵清蛋白(ovalbumin,OVA)特异性CD4+T细胞(KJT细胞)的提取
用CO2吸入法处死DO11.10小鼠(OVA特异性 T 细胞的转基因小鼠),取出小鼠的外周淋巴结和脾脏。将外周淋巴结和脾脏分组研磨(溶液为完全DMEM),用70 μm的滤器过滤。脾脏组加入2 mL红细胞裂解液,混合、孵育5 min。制备淋巴细胞悬液,以CD4+T细胞提纯柱提纯CD4+T细胞。
3炎性肠病模型的制作及其监测
用已经制备好的来自DO11.10小鼠的OVA特异性CD4+辅助性T细胞经尾静脉注射转移进入SCID小鼠(5-8×106/鼠)。在蠕虫感染和细胞转入的前1 d,用链霉素(267 g/L,75 μL/鼠)处理小鼠。24 h后,口服OVA特异性表达的E.coli(EOVA,5×109/鼠)。其后,每隔1 d喂养EOVA。将小鼠分为2组,一组感染多形螺旋线虫(Heligmosoidespolygyus,H.polygyrus200/鼠),记为HP+KJ+EOVA组;另外一组不感染,记为KJ+EOVA组。每天监测临床症状、粪便和体重的变化。评估结肠炎严重程度。
4处死SCID鼠
实验14 d后,所有小鼠吸入CO2处死。
5结肠组织HE病理染色
打开腹腔,游离结肠,再沿纵轴将结肠切开并在生理盐水中漂洗,观察各组大鼠结肠的大体改变。沿纵轴在近侧结肠分别剪取3段(上、中、下各1段);以包埋液包埋,5 μm 连续切片,苏木素/伊红(haematoxylin and eosin, HE)染色。结肠病理变化采用改进的组织学评分系统进行评分[5]。
6淋巴细胞细胞因子ELISA检测
打开腹腔,取出肠系膜淋巴结(mesenteric lymph node, MLN)。将外周淋巴结分组研磨(溶液为cDMEM),用70 μm的滤器过滤。4 ℃、1 500 r/min离心8 min。离心后弃除上清。加入2 mL 完全DMEM溶液,将细胞震荡溶解。取出1×107细胞数,将之调成5×109cells/L 完全DMEM。分别以CD3单克隆抗体和OVA孵育,置于CO2培养箱内, 5% CO2、37 ℃静置培养。72 h后,收集培养液上清。置于-20 ℃冻存。以ELISA法检测Th1细胞因子[干扰素-γ(interferon-gamma, IFN-γ)]和Th2细胞因子[白细胞介素4 (interleukin-4,IL-4)]的表达量。
7淋巴细胞细胞因子流式细胞仪检测
处死小鼠,取出肠系膜淋巴结。研磨组织,制备淋巴细胞悬液。取出1×107细胞数,溶解于2 mL 完全DMEM中(5×109cells/L)。加入PMA, 3 μL(200 mg/L)、ionomycin 4 μL (2 g/L),混匀,37 ℃孵育2 h,再加入brefeldin A 4 μL (5 g/L)孵育2 h。以cytochrome标记的CD4单克隆抗体进行表面染色,然后用甲醛溶液固定。再加入破膜剂,冰上孵育20 min,然后用PE标记的IL-4单克隆抗体、FITC标记的IFN-γ单克隆抗体染色。最后再用甲醛固定。以流式细胞仪(fluorescence activated cell sorter,FACS)检测染色标本。分析数据,得出各个细胞因子的比例数据。
8抗IL-4阻断实验
分为3组,分别为:KJ+EOVA组(无H.polygyrus感染),HP+KJ+EOVA(no anti-IL-4)组(有H.polygyrus感染、无抗IL-4阻断),HP+KJ+EOVA(anti-IL-4)组(有H.polygyrus感染、有抗IL-4阻断)。前面2组按前面实验进行处理。HP+KJ+EOVA(anti-IL-4)组,在第1、4、7 d分别用抗IL-4单克隆抗体(50 μg/鼠)进行腹腔注射。第9 d将小鼠处死。将结肠组织进行HE病理染色,观察结肠病理变化的情况。取出肠系膜淋巴结,制作淋巴细胞悬液,以CD3单克隆抗体进行孵育,培养48-72 h。收集上清,ELISA检测细胞因子含量。
9统计学处理

结 果
1非IL-4阻断实验结果
1.1KJ+EOVA组SCID鼠大便偶有稀烂、体重增加、毛发有光泽,饮食、活 动、精神状态均基本正常。HP+KJ+EOVA组在5 d后部分小鼠可出现活动减少、体重减轻、毛发无光泽、饮食减少、黏液稀便等。所有实验小鼠在14 d处死解剖,实验期间所有小鼠均未死亡。实验 14 d时,KJ+EOVA组小鼠体重增加(0.47±0.56)g;HP+KJ+EOVA组小鼠体重增加(0.45±0.57)g;2组比较无显著差异,Pgt;0.05。
1.2结肠组织病理结果 HP+KJ+EOVA组结肠黏膜固有层细胞浸润增多,结肠上皮破损增加,病理评分明显高于对照组(KJ+EOVA组),分别为(5.4±0.5)分和(2.1±0.7)分,差异显著(Plt;0.05),见图1、2。

Figure 1. Histological changes of the colon in IBD mice(HE staining,×200). A: KJ+EOVA group; B: HP+KJ+EOVA group.

Figure 2. Histological scores of colons in IBD mice.
1.3MLN细胞因子ELISA检测结果 CD3单克隆
抗体刺激的HP+KJ+EOVA组IFN-γ为(2.57±1.28)μg/L,KJ+EOVA组为(12.66±6.32)μg/L,Plt;0.05。 OVA刺激的HP+KJ+EOVA组IFN-γ为(6.47 ±1.57)μg/L,KJ+EOVA组为(12.39±4.10)μg/L,Plt;0.05。 CD3单克隆抗体刺激的HP+KJ+EOVA组IL-4为(0.08±0.09)μg/L,KJ+EOVA组为(0.02 ±0.02)μg/L,Plt;0.05。OVA刺激的HP+KJ+EOVA组IL-4为(0.14 ±0.14)μg/L,KJ+EOVA组未检出,Plt;0.05,见图3。
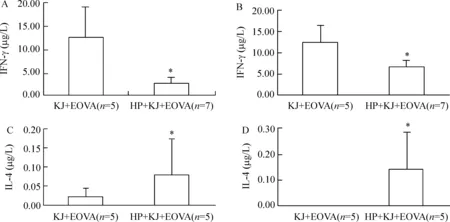
Figure 3. Cytokine production of MLN in IBD mice. A: anti-CD3-stimulated IFN-γ production;B:OVA-stimulated IFN-γ production; C: anti-CD3-stimulated IL-4 production;D:OVA-stimulated IL-4 production±s. *Plt;0.05 vs KJ+EOVA.
1.4MLN细胞因子流式细胞仪检测结果 KJ+EOVA组IFN-γ(Th1) 的比率为(28.50±0.86)%,HP+KJ+EOVA组为(26.66±0.39)%,2组比较差异显著(Plt;0.01)。KJ+EOVA组IL-4(Th2) 的比率为(3.26±0.18)%,HP+KJ+EOVA组为(5.70±0.49)%,2组比较差异显著(Plt;0.01)。KJ+EOVA组中,Th1/Th2 的比率为(8.76±0.43),HP+KJ+EOVA组为(4.71±0.45),2组比较差异显著(n=5,Plt;0.01),见图4。
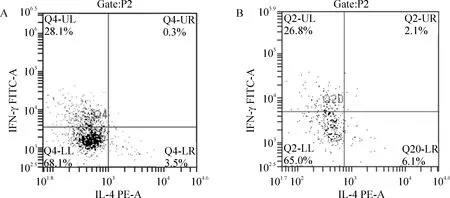
Figure 4. FACS results of MLN cytokine production . A: KJ+EOVA group; B: HP+KJ+EOVA group.
2IL-4阻断实验结果
2.1KJ+EOVA组SCID鼠大便偶有稀烂、体重增加、毛发有光泽,饮食、活动、精神状态均基本正常。HP+KJ+EOVA(no anti-IL-4)组在5 d后部分小鼠可出现活动减少、体重减轻、毛发无光泽、饮食减少、黏液稀便等。HP+KJ+EOVA(anti-IL-4)组SCID鼠大便偶有稀烂、体重增加、毛发有光泽,饮食、活 动、精神状态均基本正常。所有实验小鼠在9 d处死解剖,实验期间所有小鼠均未死亡。实验第9 d时,KJ+EOVA组小鼠体重增加(-0.08±0.85)g;HP+KJ+EOVA(no anti-IL-4)组小鼠体重增加(-0.90±0.80)g;HP+KJ+EOVA(anti-IL-4) 组小鼠体重增加(-0.80±0.45)g;3组之间两两比较均无显著差异,Pgt;0.05。
2.2结肠组织病理结果 HP+KJ+EOVA(anti-IL-4)组结肠与HP+KJ+EOVA(no anti-IL-4)组比较,固有层细胞浸润减少,黏膜上皮破损好转,炎症情况明显减轻,差异显著(Plt;0.05),见图5、6 。
2.3MLN细胞因子ELISA检测结果 CD3单克隆抗体刺激的HP+KJ+EOVA(no anti-IL-4)组IFN-γ为(0.32 ±0.28) μg/L, HP+KJ+EOVA(anti-IL-4)组为(2.74±1.16) μg/L,KJ+EOVA组为(3.52 ±2.44) μg/L。KJ+EOVA 组和HP+KJ+EOVA(no anti-IL-4)组比较,差异显著(Plt;0.05);HP+KJ+EOVA(anti-IL-4)组和HP+KJ+EOVA(no anti-IL-4)组比较,差异显著(Plt;0.05);KJ+EOVA组和HP+KJ+EOVA(anti-IL-4)组比较,差异无统计学意义(Pgt;0.05)。OVA刺激的HP+KJ+EOVA(no anti-IL-4)组IFN-γ为(0.34 ±0.12) μg/L, HP+KJ+EOVA(anti-IL-4)组为(1.82±1.75) μg/L,KJ+EOVA组为(2.53 ±2.19) μg/L。KJ+EOVA 组和HP+KJ+EOVA(no anti-IL-4)组比较,差异显著(Plt;0.05);HP+KJ+EOVA(anti-IL-4)组和HP+KJ+EOVA(no anti-IL-4)组比较,差异显著(Plt;0.05);KJ+EOVA组和HP+KJ+EOVA(anti-IL-4)组比较,差异无显著(Pgt;0.05),见图7A、B。

Figure 5. HE staining of the mouse colon section in IL-4 blocking experiment(×200). A: KJ+EOVA group ; B: HP+KJ+EOVA(no anti-IL-4) group; C: HP+KJ+EOVA(anti-IL-4) group.

Figure 6. Histological scores of colons in mice in IL-4 blocking experiment.n=4.
CD3单克隆抗体刺激的HP+KJ+EOVA(no anti-IL-4)组IL-4为(0.07 ±0.06) μg/L, HP+KJ+EOVA(anti-IL-4)组为(0.02±0.01) μg/L,KJ+EOVA组为(0.01 ±0.01) μg/L。KJ+EOVA 组和HP+KJ+EOVA(no anti-IL-4)组比较,差异有统计学意义(Plt;0.05);HP+KJ+EOVA(anti-IL-4)组和HP+KJ+EOVA(no anti-IL-4)组比较,差异有统计学意义(Plt;0.05);KJ+EOVA组和HP+KJ+EOVA(anti-IL-4)组比较,差异无统计学意义(Pgt;0.05)。OVA刺激的HP+KJ+EOVA(no anti-IL-4)组IL-4为(0.08 ±0.04) μg/L, HP+KJ+EOVA(anti-IL-4)组IL-4为(0.01±0.02)μg/L,KJ+EOVA组IL-4为(0.00 ±0.00) μg/L。KJ+EOVA 组和HP+KJ+EOVA(no anti-IL-4)组比较,差异显著(Plt;0.05);HP+KJ+EOVA(anti-IL-4)组和HP+KJ+EOVA(no anti-IL-4)组比较,差异显著(Plt;0.05);KJ+EOVA组和HP+KJ+EOVA(anti-IL-4)组比较,无显著差异(n=4,Pgt;0.05),见图7C、D。

Figure 7. Cytokine production of MLN in IL-4 blocking experiment.A:anti-CD3-stimulated IFN-γ production;B:OVA-stimulated IFN-γ production;C:anti-CD3-stimulated IL-4 production;D:OVA-stimulated IL-4 prodution±s.n=4.*Plt;0.05 vs HP+KJ+EOVA(no anti-IL-4).
讨 论
IBD的发生由易感基因、环境因素与免疫系统之间复杂的交互作用所致,引起非特异性炎症细胞激活,产生炎症细胞因子和介质,引起肠黏膜组织炎症及病理损害。随着遗传因素、环境因素、异常的免疫反应和机制的进展,IBD的治疗发生了很大改变,肠道微环境的改善越来越重要。在动物模型和人体寄生虫感染的研究,有大量的信息支持寄生虫感染在炎症肠病中的免疫调节作用。
蠕虫是精妙的多细胞有机体,伴有复杂的生活史和发育史。它们多存在于温热气候、拥挤、脏乱、食品卫生条件差的环境中。在这种环境中IBD的发生率却很低[4]。宿主通过接触土壤、食物和被污染的水而感染不同的蠕虫。儿童更容易感染蠕虫是因为他们经常会接触土壤并且较少注意卫生习惯。蠕虫能刺激宿主机体产生Th2型免疫反应[6],以此来促进排虫或限制寄生程度。许多蠕虫可以在宿主肠道、胆道系统、肠系膜静脉中生存多年。因此,从儿童时期感染寄生虫开始,这些蠕虫或它们的卵释放的各种因子长年作用于肠黏膜表面,持续产生Th2型细胞因子。
在动物实验中发现,感染寄生虫可以阻止或延缓免疫失调动物模型的病情。用三硝基苯磺酸(TNBS)给动物灌肠制作Th1型结肠炎模型,其肠道黏膜炎症的特点是产生大量IFN-γ及IL-12,在许多以T细胞介导的免疫反应性小鼠结肠炎模型中,通过应用IL-10、IL-4或IL-1中和抗体的治疗取得了较好的效果[7-9]。这些都表明结肠炎动物模型与免疫调节异常之间有着密切关系。
估计全球30亿人感染有寄生虫[10]。在宿主免疫学研究中,H.polygyrus是一种自然界中的小鼠线虫,大多寄生于十二指肠。研究结果表明,H.polygyrus能够诱发剧烈的Th2型免疫反应[11],并作为黏膜佐剂,改变宿主对口服蛋白抗原的反应[12,13]。因此,该蠕虫感染引起了Th2型反应的升高,在有H.polygyrus感染小鼠中减少食物抗原的过敏性反应[14]。此外,蠕虫感染驱动的Th2细胞极化的T细胞反应,与一些Th1细胞介导的疾病的改善是相关的,如Th1型糖尿病与幽门螺杆菌引起的胃炎[15-17]。也有证据支持:当并发病毒、细菌和寄生虫感染时,蠕虫感染引起的免疫反应加重[18-21]。虽然蠕虫感染后导致的Th1/Th2免疫反应失衡被认为在免疫反应中发挥免疫调节作用,然而当多重感染或者疫苗出现在寄生虫感染的个体中时,寄生虫和其它病原体之间的相互关系是比较复杂的,目前并没有得到充分的了解。
目前认为,结肠的黏膜及黏膜下层存在大量的炎症细胞浸润以及激活CD4+辅助T细胞,由于自主免疫过度激活,导致了IBD的发生。CD4+T细胞在炎性肠病的发病中起着重要作用。我们将OVA特异性的CD4+T细胞转入SCID小鼠体内,由此诱发的肠炎更能模拟临床IBD的发病过程。目前国内尚未见相关报道。我们的模型系统包括两个能够诱导自身免疫性疾病和Th反应的小鼠肠道感染因素:(1)H.polygyrus-OVA特异性E.coli-KJ T细胞SICD小鼠模型,其中寄生虫能诱导强烈的Th2反应;(2)OVA特异性E.coli-KJ T细胞SCID小鼠模型,能产生自体免疫疾病。E.coli是一种革兰阴性杆菌,是正常小鼠的细菌,能诱导肠道上皮表面病变。这种E.coli具有OVA特异性的抗原,而KJ T细胞有OVA特异性的受体,这将导致自身免疫性的肠炎。
我们在探讨H.polygyrus干预CD4+T细胞诱导肠炎的效应性时发现,感染H.polygyrus的小鼠加重了CD4+T细胞诱导的肠炎小鼠结肠的病理学损伤。体重变化无明显差异,可能与我们研究炎性肠病早期阶段的变化、实验时间较短有关。ELISA检测细胞因子的表达,感染H.polygyrus组表现为IL-4升高和IFN-γ降低。通过流式细胞仪检测细胞因子在CD4+T细胞中的分泌比率,感染H.polygyrus组亦表现为IL-4升高和IFN-γ降低。H.polygyrus感染的SCID小鼠肠炎模型中,肠系膜淋巴结Th1细胞分泌受抑,Th2细胞的分泌增加,说明H.polygyrus的感染可诱导它向Th2方向分化,而抑制它向Th1方向分化。Th1细胞分泌的细胞因子IFN-γ在炎症早期对结肠组织有保护作用。H.polygyrus可以诱导强烈的Th2反应,通过Th1/Th2平衡,抑制Th1反应,降低了IFN-γ的分泌,从而导致IFN-γ对结肠组织保护性的减低,加重了结肠病理性损伤。本实验结果与其它一些实验结果不太一致,可能跟我们研究炎性肠病早期阶段的变化、实验时间较短有一定关系。但我们的实验结果同样可以提醒我们,在用寄生虫对炎症性肠病治疗时,需要谨慎。对蠕虫在炎性肠病中的效应作用和机制还需要进行进一步研究。
[1] Moreels TG, Pelckmans PA. Gastrointestinal parasites potential therapy for refractory inflammatory bowel disease[J]. Inflamm Bowel Dis,2005,11(2):178-184.
[2] Fiorucci S, Mencarelli A, Palazzetti B, et al. Proteinase -activated receptor 2 is an anti - inflammatory signal for colonic lamina propria lymphocytes in a mouse model of colitis[J]. Proc Natl Acad Sci USA, 2001, 98 ( 24) : 13936 -13941.
[3] 王 辉,黄美近,康 亮,等.蛋白酶激活受体在炎性肠病大鼠模型迷走神经背侧运动核的表达及作用[J]. 中国病理生理杂志,2009 , 25 ( 5 ) : 998 - 1003.
[4] Hang L, Setiawan T, Blum AM,et al.Heligmosomoidespolygyrusinfection can inhibit colitis through direct interaction with innate immunity[J]. J Immunol, 2010,185(6):3184-3189.
[5] Loher F,Schmall K, Freytag P, et al. The specific type-4 phosphodiesterase inhibitor mesopram alleviates experimental colitis in mice[J]. J Pharmacol Exp Ther, 2003, 305(2): 549-556.
[6] Wang LJ,Cao Y,Shi HN. Helminth infections and intestinal inflammation[J]. World J Gastroenterol, 2008 ,14(33): 5125-5132.
[7] Barbara G,Xing Z,Hogaboam CM,et al.Interleukin 10 gene transfer prevents experimental colitis in rats[J].Gut,2000,46(3):344-349.
[8] Fuss IJ,Marth T,Neurath MF,et al.Anti-interleukin 12 treatment regulates apoptosis of Th1 T cells in experimental colitis[J].Gastroenterology,1999,117(5):1078-1088.
[9] Hogaboam CM,Vallance BA,Kumar A,et al.Therapeutic effects of interleukin-4 gene transfer in experimental inflammatory bowel disease[J].J Clin Invest,1997,100(11):2766-2776.
[10]Summers RW, Elliott DE, Urban JF Jr, et al.Trichurissuistherapy for active ulcerative colitis: a randomized controlled trial[J]. Gastroenterology, 2005,128(4):825-832.
[11]Finkelman FD, Shea-Donohue T, Goldhill J, et al. Cytokine regulation of host defense against parasitic gastrointestinal nematodes: lessons from rodent models [J]. Annu Rev Immunol, 1997, 15:505-533.
[12]Shi HN, Ingui CJ, Dodge I, et al. A helminth induced mucosal Th2 response alters nonresponsiveness to oral administration of a soluble antigen [J]. J Immunol, 1998, 160(5):2449-2455.
[13]Shi HN, Liu HY, Nagler-Anderson C. Enteric infection acts as an adjuvant for the response to a model food antigen [J]. J Immunol, 2000, 165(11):6174-6182.
[14]Bashir ME, Andersen P, Fuss IJ, et al. An enteric helminth infection protects against an allergic response to dietary antigen [J]. J Immunol, 2002, 169(6):3284-3292.
[15]Fox JG, Beck P, Dangler CA, et al. Concurrent enteric helminth infection modulates inflammation and gastric immune responses and reduces helicobacter-induced gastric atrophy [J]. Nat Med, 2000, 6(5):536-542.
[16]Imai S, Tezuka H, Fujita K. A factor of inducing IgE from a filarial parasite prevents insulin-dependent diabetes mellitus in nonobese diabetic mice [J]. Biochem Biophys Res Commun, 2001, 286(5):1051-1058.
[17]Zaccone P, Fehérvári Z, Jones FM, et al. Schistosoma mansoni antigens modulate the activity of the innate immune response and prevent onset of type 1 diabetes [J]. Eur J Immunol, 2003, 33(5):1439-1449.
[18]Araujo MI, Bliss SK, Suzuki Y, et al. Interleukin-12 promotes pathologic liver changes and death in mice coinfected withSchistosomamansoniandToxoplasmagondii[J]. Infect Immun, 2001, 69(3):1454-1462.
[19]Brady MT, O’Neill SM, Dalton JP, et al.Fasciolahepaticasuppresses a protective Th1 response againstBordetellapertussis[J]. Infect Immun, 1999, 67(10):5372-5378.
[20]Mansfield LS, Gauthier DT, Abner SR, et al. Enhancement of disease and pathology by synergy ofTrichurissuisandCampylobacterjejuniin the colon of immunologically na?ve swine [J]. Am J Trop Med Hyg, 2003, 68(1):70-80.
[21]Marshall AJ, Brunet LR, van Gessel Y, et al.ToxoplasmagondiiandSchistosomamansonisynergize to promote hepatocyte dysfunction associated with high levels of plasma TNF-α and early death in C57BL/6 mice [J]. J Immunol, 1999, 163(4):2089-2097.
TheeffectandmechanismofH.polygyrusinfectioninT-cell-mediatedinflammatoryboweldiseaseinmice
LI Wang-lin1,2,3, LAN Ping1, WU Xiao-jian1, RAO Ben-qiang1, HE Xiao-sheng1, WU Xian-rui1, ZOU Yi-feng1, WALKER Allan2, SHI Hai-ning2
(1DepartmentofColorectalSurgery,TheSixthAffiliatedHospital,SunYat-senUniversity,Guangzhou510655,China;2MucosalImmunologyLaboratory,MassachusettsGeneralHospital,HarvardMedicalSchool,CharlestownMA02129,USA;3FirstMunicipalPeople’sHospital,GuangzhouMedicalCollege,Guangzhou510180,China.E-mail:LWL3132008@sina.com)
AIM: To investigate the effect and mechanism ofHeligmosomoidespolygyrus(H.polygyrus) infection in mouse inflammatory bowel disease (IBD) mediated by CD4+helper T-cells.METHODSOvalbumin (OVA) -specific CD4+helper T-cells were transferred into SCID (severe combined immunodeficiency) mice to establish an IBD model. The IBD mice were infected byH.polygyrusand sacrificed 14 days later. The histological changes of the colon were observed, and the expression of interferon-gamma (IFN-γ) and interleukin-4 (IL-4) in mesenteric lymph nodes was detected by ELISA and flow cytometry. Additionally, IL-4 monoclonal antibody was intraperitoneally injected into theH.polygyrus-infected IBD mice to block the secretion of IL-4. The IL-4-blocking IBD mice were sacrificed 9 days later and the above indexes were also determined.RESULTSCompared with the non-infection group, theH.polygyrus-infected IBD mice had more severe colonic lesions, higher level of IL-4 and lower level of IFN-γ in mesenteric lymph nodes (allPlt;0.05). Compared with the non-blocking group, theH.polygyrus-infected IBD mice with IL-4 blockage had less colonic lesions, lower IL-4 level and higher IFN-γ level (allPlt;0.05).CONCLUSIONH.polygyrusinfection in CD4+T-cell-mediated IBD model promotes inflammation in the early stage probably by inducing the secretion of Th2 cytokine and inhibiting the secretion of Th1 cytokine. The finding suggests that using worms for treatment of IBD needs to be cautious.
Inflammatory bowel diseases;Heligmosomoidespolygyrus; T-lymphocytes, helper-inducer
1000-4718(2011)04-0732-07
R363
A
10.3969/j.issn.1000-4718.2011.04.021
2010-12-10
2011-02-23
国家自然科学基金资助项目(No. 30872461) ;广东省自然科学基金资助项目 (No. 8151008901000107)
△通讯作者 Tel:020-81085322;E-mail: LWL31312008@sina. com
