还脑益聪方组分对APP转基因小鼠脑组织炎症因子和氧化应激的影响*
2011-11-20刘剑刚刘明芳蔡琳琳
官 杰, 李 浩, 刘剑刚△, 刘明芳, 蔡琳琳, 胡 佳, 魏 芸
(1中国中医科学院西苑医院, 北京 100091;2北京化工大学分析化学系, 北京 100029)
还脑益聪方组分对APP转基因小鼠脑组织炎症因子和氧化应激的影响*
官 杰1#, 李 浩1, 刘剑刚1△, 刘明芳1, 蔡琳琳1, 胡 佳2, 魏 芸2
(1中国中医科学院西苑医院, 北京 100091;2北京化工大学分析化学系, 北京 100029)
目的研究中药复方-还脑益聪方(HNYCF)组分对阿尔茨海默病(AD)动物模型脑组织炎症因子和氧化应激相关指标的影响,探讨其治疗AD的作用机制。方法选用3月龄APP695V717I转基因小鼠AD模型,随机分成4组:模型组、盐酸多奈哌齐组、HNYCE组分大剂量组和HNYCF组分小剂量组。另设立正常对照组(相同遗传背景的C57BL/6J小鼠)。各组小鼠按相应处理连续灌胃6个月后进行相关指标检测。采用Morris水迷宫和跳台实验观测小鼠学习记忆能力,采用免疫组织化学法检测脑组织核因子κB(NF-κB)和过氧化物酶体增殖物激活受体γ(PPARγ)的表达水平,放射免疫法测定脑组织皮层和海马白细胞介素-6(IL-6)和高敏C-反应蛋白(hs-CRP)的含量,比色法检测血清超氧化物歧化酶(SOD)活性,硫代巴比妥酸法测定血清丙二醛(MDA)含量。结果HNYCF小鼠在Morris水迷宫中穿越平台次数、第4象限游泳时间和路程均较模型组显著增多(Plt;0.05或Plt;0.01);HNYCF大剂量组小鼠在跳台实验中潜伏期较模型组显著延长(Plt;0.01);HNYCF小鼠脑组织NF-κB表达下调,PPARγ表达上调,IL-6含量减少,与模型组比较有显著差异(Plt;0.05或Plt;0.01);HNYCF小鼠血清SOD活性较模型组显著升高(Plt;0.05或Plt;0.01)。结论HNYCF可以改善APP转基因小鼠的学习记忆能力,其作用机制可能与抗炎、抗氧化作用有关。
阿尔茨海默病; 还脑益聪方; APP转基因小鼠; 细胞因子类; 氧化性应激
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的以进行性认知功能减退为特征中枢神经系统的变性疾病,其特征性组织病理学改变主要包括老年斑(senile plaque,SP)、神经纤维缠结(neurofibrillary tangles,NFTs)、神经细胞和突触的丢失等。国内外学者对AD的研究已逾百年,提出了多种假说,并针对其开发出多类药物,但迄今为止,其发病机制尚不十分清楚[1,2],理想的治疗手段和药物仍然缺乏。近年来,随着对β淀粉样蛋白(beta amyloid protein,Aβ)级联学说的深入研究,对免疫炎症学说和氧化应激学说的日益重视及对三者相互作用导致神经毒性作用增强的认识,开发具有抗炎、抗氧化等多途径作用特点的中药复方,在防治AD方面将极具优势和前景。遵循中医辨证理念组成的中药复方还脑益聪方(Huannaoyicongfang,HNYCF)已取得较好的前期临床效果[3],现应用现代工艺技术提取HNYCF的复方组分,观察其对AD动物模型β-淀粉样前体蛋白(β-amyloid precursor protein,APP)转基因小鼠脑组织炎症因子和氧化应激的影响。
材 料 和 方 法
1材料
1.1动物 清洁级(SPF),3月龄APP695V717I转基因小鼠60只,雌雄各半,体重17-23 g;SPF,同月龄相同遗传背景C57BL/6J小鼠15只,体重17-23 g,均购自中国医学科学院实验动物研究所,动物许可证为SCXK(京)2005-0013。
1.2药物 HNYCF由北京化工大学提取其组分。盐酸多奈哌齐(商品名称:安理申),5 mg/片,由卫材(中国)药业有限公司提供(批号为081121A)。
1.3主要药品与试剂 过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)抗体,批号为100411;过氧化物酶标记的链霉卵白素(streptavidin peroxidase,SP)免疫组化染色试剂盒,批号为100113;3,3-二氨基联苯胺盐酸盐(diaminobenzidine,DAB)染色试剂盒,批号为100119;由北京博奥森生物技术有限公司提供。浓缩型多克隆(效价1∶100)核转录因子(nuclear transcription factor-κB p65,NF-κB p65)抗体,批号:100422;二步法免疫组化试剂盒(通用性Ⅱ抗-生物素标记的羊抗兔),批号为100410,购自北京中杉金桥生物技术有限公司。白细胞介素6(interleukin-6,IL-6)和高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)放射免疫试剂盒由北京北方生物科技有限公司提供。超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号为100412)和丙二醛(malondialdehyde,MDA)试剂盒(批号为100410)由南京建成生物工程研究所提供。
1.4主要仪器 DMS-2型Morris水迷宫系统由中国医学科学院药物研究所生产;DTT-2型小鼠跳台仪由中国医学科学院药物研究所生产;BH-2型生物显微镜(Olympus);DpxView Pro型计算机彩色图像处理系统(Delta Pix);γ-911型全自动放射免疫计数仪由中国科技大学实业总公司生产;Multiskan MK3型酶标仪由雷勃生物医学有限公司生产;7020型全自动生化仪由日立公司生产。
2方法
2.1HNYCF组分的制备 HNYCF由何首乌、人参、川芎、石菖蒲和黄连组成,将5种药材分别过筛后,按比例混合均匀,经正交实验取得最佳提取条件,采用高效液相色谱(HPLC)对提取液中的二苯乙烯苷、阿魏酸、盐酸小檗碱3种成分进行含量测定,分别为3.58%、0.32%、1.83%,同时测量浓缩干燥后每组实验浸膏得率。按最佳正交条件提取的药液中,上述各药材的有效成分经测定转移率均超过50%。采用紫外可见分光光度法(比色法)测定浸膏中组分的含量,分别为:总黄酮14.19%,总皂苷25.98%,总酚酸2.27%,总生物碱5.20%,多糖(沉淀部分)51.36%。
2.2分组与给药 将APP695V717I转基因小鼠随机分为模型组、HNYCF组分大剂量组(2.8 g·kg-1·d-1)、HNYCF组分小剂量组(1.4 g·kg-1·d-1)和盐酸多奈哌齐组(0.65 mg·kg-1·d-1),每组15只;同月龄相同遗传背景的C57BL/6J小鼠15只作为正常对照组。所试药物稀释相同体积灌胃给药,正常组和模型组给予等体积蒸馏水灌胃,均每天1次。连续灌胃6个月,第6月前1周进行行为学实验。灌胃过程中HNYCF组分小剂量组死亡1只;跳台实验中盐酸多奈哌齐组有1只触电死亡。
2.3行为学测试
① Morris水迷宫实验 参照Morris实验方法进行。实验时将水池以4个等距离点均分为4个象限区,在第4象限位于池壁和圆心中间放置有机玻璃站台。向水池中加水,水温(25±1)℃,注入奶粉,混匀,使水成不透明的乳白色,并使计算机能成功跟踪小鼠的活动。从第2象限池壁选择并标记1个入水点,将小鼠面向池壁放入水中,记录小鼠从入水至寻找并爬上平台所需时间(即逃避潜伏期)以及游泳距离。如小鼠在3 min内未找到平台,将其引导至平台停留10 s,逃避潜伏期记为180 s。每天进行1次,连续训练5 d。第5 d下午撤去平台,任选1个入水点,将小鼠面向池壁放入水池中,摄像系统自动记录小鼠3 min内进出原平台区的次数及在原平台所在第4象限游泳时间和路程作为评价小鼠学习记忆成绩的指标。
② 跳台实验 跳台仪实验箱为有机玻璃箱,底面铺有铜栅并与电源相连,电流控制在36 V。铜栅上靠箱内一角置一绝缘台作为动物回避电击的安全区。实验装置与计算机自动记录系统相连。将小鼠放入跳台仪实验箱内,适应环境5 min,之后将小鼠轻放于跳台上,并将铜栅通电,当小鼠从台上跳下四肢接触铜栅时会受到电击,正常回避反应是跳上跳台返回安全区逃避电击,如此学习5 min。24 h后进行记忆能力测试。记录小鼠从停留在跳台上至第1次跳下受电击的时间即潜伏期和5 min内的错误次数(小鼠四肢同时接触铜栅触电的次数),以此作为记忆功能的评价指标。
2.4脑组织样品处理 小鼠于末次行为学测试后,禁食12 h,不禁水。第2 d,进行脑组织及血清取材。各组小鼠麻醉后眼眶取血,分离血清(3 000 r/min离心,20 min),置-80 ℃冰箱保存,备用于指标检测。其中,模型组有1只未能取血。快速断头取全脑,在低温下取动物脑组织,用滤纸吸干,称重。每组随机选取6只小鼠脑组织放入4%多聚甲醛溶液中固定24 h以上(4 ℃),之后换后固定液,待脑组织下沉后即可行石蜡包埋、切片,进行免疫组化染色。其余小鼠分别迅速分离皮层和海马(冰砖上进行),各加入2 mL生理盐水匀浆,低温高速离心机离心(3 000 r/min,20 min),分离上清液,用于组织含量测定。
2.5免疫组化法测定NF-κB和PPARγ的表达 采用免疫组织化学方法检测小鼠海马CA1区NF-κB和PPARγ的表达。病理免疫组织化学染色根据二步法免疫组化试剂盒说明书操作,每组随机选取4只动物的脑组织切片,常规脱蜡,封闭内源性过氧化物酶,10%正常山羊血清封闭。滴加Ⅰ抗,即抗NF-κBp65蛋白多克隆抗体,NF-κB的浓度为1∶50,4 ℃过夜;PPARγ的浓度为1∶30。37 ℃孵育1 h,PBS溶液冲洗;滴加Ⅱ抗生物素化山羊抗小鼠IgG,室温20 min,PBS溶液冲洗;滴加SP复合物,室温20 min,PBS溶液冲洗;DAB-H2O2显色,苏木素轻度复染;乙醇脱水、透明、中性胶封片,选取同批染色切片进行显微镜观察。免疫组化染色结果图像分析:每组随机选取4只小鼠,每只动物取相同位置2张脑片,在40倍物镜下,以胞浆染成棕褐色为阳性细胞标志,记数小鼠海马CA1区内NF-κB和PPARγ染色阳性细胞数目。
2.6脑组织IL-6和hs-CRP含量测定 采用放射免疫法检测。
2.7氧化应激指标测定 血清SOD活性测定,采用比色法;血清MDA含量测定,采用硫代巴比妥酸(thibabituric acid, TBA)法。
2.8海马、皮层总蛋白含量的测定 采用双缩脲法。
3统计学处理
结 果
1HNYCF组分对APP转基因小鼠空间学习记忆能力的影响
与正常组比较,模型组在Morris水迷宫中穿越原平台位置次数、第4象限游泳时间和路程均显著减少(Plt;0.05或Plt;0.01)。各给药组治疗后,在Morris水迷宫中穿越原平台位置次数、第4象限游泳时间和路程均较模型组显著增多(Plt;0.05或Plt;0.01),见表1。

表1 HNYCF组分对APP转基因小鼠空间学习记忆能力的影响
2HNYCF组分对APP转基因小鼠一次性回避反应记忆功能的影响
各组小鼠在跳台实验中的错误次数组间比较无显著差异(Pgt;0.05),但模型组呈现错误次数增高的趋势。与正常组比较,模型组的潜伏期明显缩短(Plt;0.01);与模型组比较,盐酸多奈哌齐组潜伏期明显延长(Plt;0.05),HNYCF组分大剂量组潜伏期显著延长(Plt;0.01),小剂量组潜伏期亦有延长趋势,但无显著差异(Pgt;0.05),见表2。

表2 HNYCF组分对APP转基因小鼠一次性回避反应记忆功能的影响
3HNYCF组分对APP转基因小鼠海马CA1区NF-κB和PPARγ表达的影响
APP转基因小鼠海马CA1区均可见棕褐色阳性表达,主要分布于神经元胞浆和胞膜,其中PPARγ在胞核上亦有少许表达。与正常组比较,模型组NF-κB阳性细胞数显著增多(Plt;0.01),PPARγ阳性细胞数无明显差异(Pgt;0.05)。各给药组治疗后,NF-κB阳性细胞数较模型组显著减少(Plt;0.05或Plt;0.01),PPARγ阳性细胞数目较模型组显著增多(Plt;0.05),见表3、图1、2。

表3 HNYCF组分对APP转基因小鼠海马CA1区NF-κB和PPARγ表达的影响
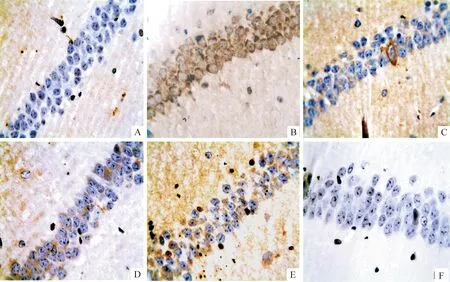
Figure 1. The expression of NF-κB in hippocampus CA1 region of mice in each group was detected by immunohistochemistry with image analysis (×400).A: normal group; B: model group; C: donepezil group; D: HNYCF high-dose group; E: HNYCF low-dose group; F: negative control.

Figure 2. The expression of PPARγ in hippocampus CA1 region of mice in each group was detected by immunohistochemistry with image analysis (×400) . A: normal group; B: model group; C: donepezil group; D: HNYCF high-dose group; E: HNYCF low-dose group; F: negative control.
4HNYCF组分对APP转基因小鼠海马和皮层IL-6含量的影响
与正常组比较,模型组海马和皮层的IL-6含量均显著增多(Plt;0.01);与模型组海马IL-6含量比较,盐酸多奈哌齐组和HNYCF组分小剂量组均显著减少(Plt;0.01或Plt;0.05),HNYCF组分大剂量组较模型组亦有所减少,但无显著差异(Pgt;0.05);与模型组皮层IL-6含量比较,HNYCF组分大、小剂量组均显著减少(Plt;0.01或Plt;0.05),盐酸多奈哌齐组较模型组亦有所减少,但无显著差异(Pgt;0.05),见表4。

表4 HNYCF组分对APP转基因小鼠海马和皮层IL-6含量的影响
5HNYCF组分对APP转基因小鼠海马和皮层hs-CRP含量的影响
与正常组比较,模型组海马和皮层的hs-CRP含量均呈增多趋势,但无显著差异(Pgt;0.05);与模型组海马hs-CRP含量比较,各给药组均呈减少趋势,但无显著差异(Pgt;0.05);与模型组皮层hs-CRP含量比较,正常组和各给药组亦均呈减少趋势,但无显著差异(Pgt;0.05),见表5。

表5 HNYCF组分对APP转基因小鼠海马和皮层hs-CRP含量的影响
6HNYCF组分对APP转基因小鼠血清SOD活性和MDA含量的影响
与正常组比较,模型组小鼠血清SOD活性和MDA含量均无显著差异(Pgt;0.05);与模型组血清SOD活性比较,HNYCF组分大、小剂量组均有显著升高(Plt;0.05或Plt;0.01),盐酸多奈哌齐组无显著差异(Pgt;0.05);与模型组血清MDA含量比较,各给药组均无显著差异(Pgt;0.05),见表6。

表6 HNYCF组分对APP转基因小鼠血清SOD活性和MDA含量的影响
讨 论
“Aβ级联学说”认为Aβ是AD发病的中心环节[4,5],其中,APP基因突变增加了Aβ42的产生和聚集,Aβ42寡聚体沉积形成斑块,导致炎症反应、氧化损伤、NFTs、轴突损伤和突触丢失等级联反应,最终导致神经元凋亡和痴呆。APP转基因小鼠脑部表达人APP基因,并通过APP蛋白在大脑中过量表达,Aβ产生增加,导致神经毒害作用,损伤小鼠学习记忆能力,并聚集和沉积形成老年斑。
NF-κB是介导许多免疫和炎症反应的中心物质,与AD的免疫炎性机制密切相关[6],它主要是通过调节一系列参与免疫、炎症反应及凋亡的基因转录来发挥作用。在AD大脑中,Aβ通过激活NF-κB[7]介导炎症反应,增加的NF-κB在AD脑中弥漫的Aβ斑块附近的神经元细胞和胶质细胞中均有表达。PPARγ与NF-κB控制的炎症基因转录关系密切,也是AD免疫炎症相关的核转录因子[6], PPARγ激活后可以抑制NF-κB的表达,在转录水平抑制某些促炎介质的基因转录从而抑制炎症因子的释放,发挥抗炎作用,参与调节AD神经炎症反应;PPARγ并能调节细胞APP水平和Aβ的产生,减少淀粉样斑块形成,改善认知和记忆功能障碍等[8,9]。IL-6基因可由NF-κB调控表达,IL-6在脑内主要由神经元和胶质细胞活化后生成[10],是一种炎症性细胞因子,可以介导中枢神经系统免疫应答和炎症反应,可诱导急性相反应蛋白在神经炎性斑块中聚集,也可激活补体损伤神经细胞,并对APP的表达具有直接调控作用,可以促进APP产生,进而导致Aβ沉积。hs-CRP是一种敏感的非特异性炎症标志物,在心脑血管疾病诊断与治疗中发挥着重要作用,但目前就其在AD中的含量变化尚存不同看法[11,12]。研究结果表明,9月龄APP695V717I转基因小鼠脑组织NF-κB的表达明显升高,皮层和海马的IL-6含量显著增多、hs-CRP含量呈增高趋势,表明其脑内存在炎症反应,这可能与其脑内Aβ生成增多诱发中枢神经系统免疫炎症级联反应有关。HNYCF具有显著上调APP转基因小鼠脑组织PPARγ的表达,降低NF-κB的表达,减少脑组织皮层和海马IL-6含量的作用,提示抗炎是HNYCF改善模型小鼠学习记忆能力的作用机制之一。
氧化应激发生于AD疾病进程的早期,显著早于NFTs和SP病理特点的形成[13],氧化应激学说在AD的发生发展中起举足轻重的作用。SOD是一类生物体内天然存在的氧自由基清除剂,其活性的高低间接反映了机体清除氧自由基的能力。MDA是脂质过氧化的主要降解产物,具有细胞毒性,其含量的多少间接反映了机体细胞受自由基攻击的严重程度。有研究[14]报道用放射免疫法测定9月龄APP695V717I转基因小鼠脑皮质SOD活性较正常对照组显著降低(Plt;0.05),脑皮质MDA含量显著升高(Plt;0.05),提示9月龄该模型小鼠脑内存在一定程度的氧化应激损伤。本研究中模型组小鼠血清SOD活性和MDA含量与正常组相比均无显著差异,这可能是因为其SOD活性和MDA含量在脑组织和血清中可能存在不一致性,脑内的氧化应激在血清中可能反应不明显,或者9月龄该模型小鼠尚未衰老及病变至强烈氧化应激反应状态。HNYCF能够明显提高APP转基因小鼠机体清除氧自由基的能力,可以通过抗氧化应激改善模型小鼠的学习记忆能力,这可能是其防治AD的作用机制之一。
HNYCF是以AD虚损为主,兼顾痰浊、瘀毒的复杂中医病机特点而组成的中药复方,在中医理论指导下,经现代工艺提取该方的复方组分,探讨其对AD动物模型脑组织炎症反应和氧化应激相关指标的影响。HNYCF由何首乌、人参、川芎、石菖蒲、黄连组成。其中,首乌具有补肝肾、益精血、乌须发、强筋骨功能,其有效成分二苯乙烯苷具有抗痴呆药理作用,其多糖也具有抗氧化、抗痴呆及提高学习记忆能力的作用。人参是传统滋补药,人参皂苷是其主要成分,可直接或间接抑制炎性因子的分泌达到抗炎功效,并具有清除自由基,抗氧化作用等。川芎具有活血行气之功,有效成分川芎嗪可通过提高SOD活性、降低MDA含量、降低乙酰胆碱酯酶活性、降低脑组织中Aβ、NF-κB的表达等途径提高AD模型小鼠的学习记忆能力[15]。石菖蒲是中医益智方中的常用药,其水提取液及其挥发油具有镇静、抗惊厥、开窍醒神、促进学习记忆等药效。黄连性寒、味苦,有清热燥湿、泻火解毒等功效,现代药理研究证实[16],黄连的作用主要与其根茎所含的生物碱(约占根茎的4%-8%)有关,具有广泛的药理活性,可通过作用于某些炎症细胞和炎症介质发挥抗炎作用,并具有免疫调节作用和抗氧化作用。
所提取HNYCF组分由总黄酮、总皂苷和总酚酸等组成,最大限度保留了中药的有效组分。研究结果表明,该复方组分可以通过抗炎症反应和抗氧化作用改善APP转基因小鼠的学习记忆能力,表明抑制炎症反应和抗氧化应激作用是HNYCF治疗AD的有效途径之一。
(致谢:实验免疫组织化学部分承首都医科大学北京宣武医院张丽老师指导,谨致谢忱!)
[1] 韩振蕴,苏 芮,范吉平.β淀粉样蛋白(1-40)对痴呆老龄大鼠海马MARCKS mRNA表达及学习记忆的影响[J].中国病理生理杂志,2010,26(7):1404-1406.
[2] 杨 雁,张晓洁,王玉萍,等.噻唑烷二酮通过Wnt通路程改善2型糖尿病大鼠海马阿尔茨海默病样病变[J].中国病理生理杂志,2010,26(12):2421-2427.
[3] 李 浩,姚明江,赵文明,等.还脑益聪胶囊治疗老年轻度认知损害的双盲随机对照研究[J].中西医结合学报,2008,6(1):25-31.
[4] Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer disease: progress and problems on the road to therapeutics[J]. Science, 2002, 297(5580): 353-356.
[5] Pimplikar SW. Reassessing the amyloid cascade hypothesis of Alzheimer’s disease[J]. Int J Biochem Cell Biol,2009,41(6):1261-1268.
[6] Granic I, Dolga AM, Nijholt IM, et al. Inflammation and NF-κB in Alzheimer’s disease and diabetes[J].J Alzheimer Dis,2009,16(4):809-821.
[7] Paris D, Patel N, Quadros A, et al. Inhibition of Aβ production by NF-κB inhibitors[J]. Neurosci Lett,2007,415(1):11-16.
[8] Jiang Q, Heneka M, Landreth GE. The role of peroxisome proliferator-activated receptor-γ (PPARγ) in Alzheimer’s disease:therapeutic implications[J].CNS Drugs,2008,22(1):1-14.
[9] 张慧灵,顾振纶,秦正红.PPARs与神经退行性疾病[J].中国药理学通报,2006,22(4):397-402.
[10]Sokolova A, Hill MD, Rahimi F, et al. Monocyte chemoattractant protein-1 plays a dominant role in the chronic inflammation observed in Alzheimer’s disease[J].Brain Pathol,2009,19(3): 392-398.
[11]Nilsson K,Gustafson L,Hultberg B.C-reactive protein: vascular risk marker in elderly patients with mental illness[J].Dement Geriatr Cogn Disord,2008,26(3):251-256.
[12]O’Bryant SE, Waring SC, Hobson V, et al. Decreased C-reactive protein levels in Alzheimer disease[J]. J Geriatr Psychiatry Neurol,2010,23(1):49-53.
[13]Moreira PI, Santos MS, Oliveira CR, et al. Alzheimer disease and the role of free radicals in the pathogenesis of the disease:therapeutic implications[J].CNS Neurol Disord Drug Targets,2008,7(1):3-10.
[14]李 梅,林来祥,徐淑梅.H102对APP转基因小鼠胆碱能系统及自由基的影响[J].中国新药与临床杂志,2009,28(2):106-109.
[15]赵 琳,魏敏杰,何 苗,等.川芎嗪对阿尔采末病模型小鼠学习记忆能力的影响及其机制初探[J].中国药理学通报,2008,24(8):1088-1092.
[16]李彩虹,周克元.黄连活性成分的作用及机制研究进展[J].时珍国医国药,2010,21(2): 466-468.
EffectsofChineseherbalcompoundHuannaoyicongfangoninflammatorycytokinesandoxidativestressinbrainofAPPtransgenicmice
GUAN Jie1, LI Hao1, LIU Jian-gang1, LIU Ming-fang1, CAI Lin-lin1, HU Jia2, WEI Yun2
(1XiyuanHospitalofChinaAcademyofChineseMedicalSciences,Beijing100091,China;2FacultyofSciences,BeijingUniversityofChemicalTechnology,Beijing100029,China.E-mail:liujiangang2002@sina.com)
AIM: To study the effects of Chinese herbal compound Huannaoyicongfang (HNYCF) on inflammatory reaction and oxidative stress in the brain of Alzheimer’s disease (AD) animal model, and to explore its role in treating AD.METHODSAPP695V717I transgenic mice (3 months old),as an AD model in this study, were randomly divided into model group, donepezil group, HNYCF high-dose group and HNYCF low-dose group. C57BL/6J mice, which were of the same age and genetic background as the transgenic mice, were used as controls. The animals were administered intragastrically with the drug or water from 3 months old to 9 months old. Morris water maze test was performed to measure the spatial learning and memory ability. Step-down test was performed to observe the learning and memory ability of single passive avoidance response. The expression of nuclear factor kappa B (NF-κB) and peroxisome proliferator-activated receptor γ (PPARγ) in hippocampus CA1 region was detected by immunohistochemistry with image analysis. The levels of interleukin-6 (IL-6) and high sensitivity C-reactive protein (hs-CRP) in the brain cortex and hippocampus homogenate were measured by radioimmunoassay. The activity of superoxide dismutase (SOD) in serum was detected by colorimetry. The content of malondialdehyde (MDA) in serum was detected by thibabituric acid method.RESULTSMorris water maze test showed that the times of crossing platform, and the swimming time and distance in the fourth quadrant in HNYCF groups were much more than those in model group. The step-down test manifested that the escape latency in HNYCF high-dose group was significantly longer than that in model group. Compared with model group, the expression of NF-κB obviously decreased, the expression of PPARγ significantly increased and the content of IL-6 was lower in HNYCF groups. The activity of serum SOD in HNYCF groups was significantly higher than that in model group.CONCLUSIONHNYCF evidently ameliorates the learning and memory ability in APP transgenic mice, which may be related to the anti-inflammatory and anti-oxidation effects of HNYCF.
Alzheimer disease; Huannaoyicongfang; APP transgenic mice; Cytokines; Oxidative stress
1000-4718(2011)04-0711-07
R363
A
10.3969/j.issn.1000-4718.2011.04.017
2010-10-18
2011-01-17
国家自然科学基金资助项目(No.30873338);国家“重大新药创制”科技重大专项课题资助项目(No.2009ZX09103-391)
△ 通讯作者 Tel: 010-62835630; E-mail: liujiangang2002@sina.com
# 现工作单位:山东省青岛市海慈医疗集团内分泌科,山东 青岛 266033
