乳腺癌术后胸壁低分割放疗的长期疗效观察
2011-11-15谢丛华周云峰
王 科 张 弓 谢丛华 周云峰
乳腺癌是女性最常见恶性肿瘤之一,胸壁放射治疗作为有放疗指征患者(改良)根治术后局部区域放疗的一部分,对局部控制率乃至远期生存率的改善已经多项研究证实[1~5]。现术后胸壁放疗普遍实施常规分割分割方式,总 DT50Gy,2Gy/次,5 次/周,总疗程约5周。但此方案治疗周期长,工作量大。有研究显示,应用单次高剂量、低分割方式以缩短放疗时间,可减轻患者的治疗负担,同时可减轻治疗机的工作负荷,更好的利用资源。1993年2月至1998年5月,我们对106例乳腺癌术后患者行胸壁低分割放射治疗,迄今随访已逾10年,结果报告如下。
1 资料与方法
1.1 一般资料
106例乳腺癌患者均为女性;年龄24~72岁,中位年龄 43岁。病理类型:浸润性导管癌87例(82.1%),其他 19 例(17.9%)。临床分期(UICC,1989):Ⅱ期 65 例(61.3%),Ⅲ期 41 例(39.7%),T2期58 例(54.7%%),T3期 48 例(45.3%);腋窝淋巴结转移数目:0个 25例(23.6%),1~3个 61例(57.5%),≥4个20例(18.9);行改良根治术 81 例(76.4%),行根治术 25 例(23.6%);放疗前有化疗史97 例(91.5%)。
1.2 治疗方法
97(91.5%)例术后先行化疗3个周期,续行放疗,最后再行2~3个周期化疗。手术与化疗间隔2~3周,放、化疗间隔2周左右。另76例患者于上述治疗结束后行内分泌治疗(三苯氧胺:10 mg,Bid)。
1.2.1 化疗方案 CMF方案:CTX 600 mg/m2,静脉推注,第1天;MTX 40 mg/m2,静脉推注,第 1、8 天;5-Fu 600 mg/m2,静脉滴注,第 1、8天;每 3周重复。CAF方案:CTX 500 mg/m2,静脉推注,第1天;ADM 50 mg/m2,静脉推注,第1天;5-Fu 500 mg/m2,静脉滴注,第1天;每3周重复。
1.2.2 放疗 胸壁照射采用6MeV电子线,3.6 Gy/次,隔日照射,3 次/周,总剂量为39.6 Gy,分 11 次,近4周完成。
1.3 观察指标
5年胸壁复发率、无瘤生存率、总生存率;10年胸壁复发率、无瘤生存率、总生存率及放疗不良反应,其中急性放射损伤观察皮肤Ⅱ度反应(湿性反应)的发生率,晚期观察受照肺组织纤维化的发生率[按美国肿瘤放射治疗协作组(RTOG)放射反应标准评分(1992)]。
2 结果
随访截止日期为2007年12月31日,全组随访时间为61~160个月,中位随访时间为106.7个月。失访3例,随访率为97.2%。
2.1 胸壁复发情况
本组患者低分割放射治疗后5年胸壁复发7例(6.6%),见表 1。
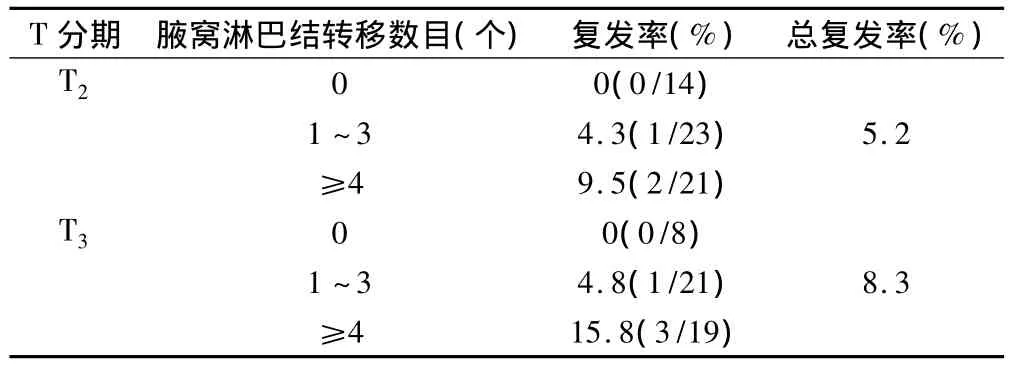
表1 TNM分期患者胸壁复发率情况
2.2 生存率
全部病例5年无瘤生存率为67.9%(72/106),5年总生存率为74.5%(79/106)。10年无瘤生存率为67.9%(72/106),10 年总生存率为 74.5%(79/106)。
2.3 放疗不良反应
本组急性皮肤湿性反应发生率为4.7%(5/106),5年内行胸片复查的病例有78例,其中中上肺部局部放射性纤维化发生率为5.1%(4/78)。
3 讨论
乳腺癌治疗是手术为主,辅以放疗、化疗和内分泌治疗等的综合治疗,其中术后放疗对生存率的影响尚无一致结论。目前多数学者认为乳腺癌术后普遍接受辅助性化疗或内分泌治疗的前提下,术后放疗主要适用于局部和区域淋巴结复发高危的患者[2,4,6](即 T3或腋窝淋巴结阳性≥4个的患者,或1~3个淋巴结阳性但腋窝淋巴结检测不彻底者),其中尤以胸壁术后放疗对局部控制率和生存率的提高最为肯定。因此,乳腺原发灶>5 cm,皮肤有水肿、破溃、红斑或与胸肌固定;腋窝淋巴结转移>20%或>4个者,根治术或改良根治术后应常规加照胸壁。
Fletcher等的研究指出乳腺癌亚临床灶的控制率与照射剂量有关,常规分割照射时剂量在35 Gy控制率为60% ~70%;40 Gy时接近80%;50 Gy时可达95%以上[7]。其他临床研究亦显示出相近的结果,故目前主张根治术或改良根治术术后放疗剂量以50 Gy/5 w为宜。尽管术后放疗剂量较为明确,但对于放射治疗的剂量分割对比研究却较少,低分割方案尤甚。通常认为低分割放疗的晚期后遗症明显高于常规分割组,这是其少为使用与研究的主要原因。然而,这些早期的实践和观点实则主要来自5 Gy或6 Gy/次、2次/周、共3~4周的分割方式,与本研究所采用的方案有着很大的不同。
低分割放射治疗方案源于法国学者Baillet在1986年11月巴黎癌症患者生存质量国际研讨会上介绍的治疗骨转移的临床研究,他从X片上骨钙化情况证实,23 Gy/4次/17d方案的临床效应相当于常规分割的45 Gy,以后他又在1989年3月的日内瓦癌症与疼痛治疗会议上证实,该方法在口腔、乳腺等肿瘤的单纯或术后放疗中以及非小细胞肺癌(NSCLC)术后非随机研究中也取得了满意的效果。Blomqvist等[8]亦曾报道针对Ⅱ期、腋窝淋巴结阳性病例采取4 500 cGy/15f/5周的剂量分割,可获得与常规分割相近的局部控制率。从本研究结果来看,我们的疗效和国内外同类研究类似[9,10],与常规分割无显著差异;而急性皮肤湿性反应和晚期肺纤维化发生率与常规分割相较亦无明显增加。
为了便于本低分割方案与常规分割方案比较,我们还通过线性-平方模式(L-Q模式)计算其实际的生物等效剂量(BED)值,BED=nd[1+d/(α/β)]。根据文献报道,乳腺癌细胞的α/β值取为4 Gy,正常组织的早反应组织和晚反应组织的α/β值分别取10 Gy和 3 Gy[11,12],计算后我们发现,本低分割方案与常规分割相比,总剂量(DT)减少到39.6 Gy,但乳腺肿瘤细胞和早反应组织、晚反应组织的BED值均与常规分割相似,这与我们的统计结果和临床经验是一致的。
严谨可行的低分割方案在保证患者治疗有效性不降低,同时放射治疗引起的并发症没有显著增加的前提下,有着以下三方面优势:①减少照射次数,缩短全部疗程,降低患者费用;②通过缩短放疗时间来与术后化疗更好地衔接;③在国内放疗设备与人力资源均有限的情况下,通过减少治疗次数来减轻机器与人员的负荷,合理配置资源。本研究方案即充分体现了上述前提与优点:隔日照射,每周治疗次数和总的治疗时间均减少,而局控率和远期生存率并无下降,早、晚期放射治疗毒性反应也无显著增加。这对于患者、家属和设备资源来说都殊为有益,既为高危患者尽早开始化疗赢得了宝贵的时间,又减少了患者的住院天数或门诊放疗的往来不便。
综上所述,我们认为本低分割方案适用于放疗资源较为紧张的单位,是常规照射方案的1种有效替代方法。
[1]王淑莲,李晔雄,余子豪.早期乳腺癌根治术后放射治疗靶区的确定〔J〕.中华放射肿瘤学杂志,2001,10:223.
[2]Overgaard M,Jensen MB,Overgaard J.Postoperative radiotherapy in high-risk postmenopausal breast-cancer patients given adjuvant tamoxifen:danish breast cancer cooperative group DBCG 82c randomised trial〔J〕.Lancet,1999,353:1641.
[3]Anquier A,Rutqvist LE,Host H,et al.Postmast ectomy megavoltage radiotherapy:the Osb and Stockholm trial〔J〕.Eur J Cancer,1992,28:433.
[4]Winer EP,Morrow M,Osborne CK,et al.Malignant tumors of the breast〔M〕.In Cancer:Principles and practice of oncology,6 th edition,eds.2001.
[5]殷蔚伯,谷铣之.肿瘤放射治疗学〔M〕.第3版.北京:中国协和医科大学出版社,2002:1059.
[6]Steene JVD,Soete G,Storme G.Adjuvant radiotherapy for breast cancer significantly improve overall survival:the missing link〔J〕.Radiother Oncol,2000,55(3):263.
[7]Montague ED,Fletcher GH.Local regional effectiveness of surgery and raditation therapy in the treatment of breast cancer〔J〕.Cancer,1985,55:2266.
[8]Blomqvist C,Tiusanen K,Elomaa I,et al.The combination of radiotherapy,adjuvant chemotherapy and tamoxifen in stageⅡbreast cancer:Long-term follow-up results of a randomized trial〔J〕.Br J Cancer,1992,66:1171.
[9]吴君心,惠周光,李晔雄,等.早期乳腺癌根治术后不同剂量分割方案的放射治疗〔J〕.中华肿瘤杂志,2003,25(3):285.
[10]D A L Morgan,J Berridge,R W Blamey.Postoperative radiotherapy following mastectomy for high-risk breast cancer:a randomised trial〔J〕.Eur J of Cancer,2002,38:1107.
[11]Yoshiya Y,Ackerman I,Franssen E,et al.Dose the dose fractionation schedule influence local control of adjuvant radiotherapy for early stage breast cancer?〔J〕.Int J Radiat Oncol Biol Phys,1999,44:99.
[12]Matthews JHL,Meeker BE,Chapman JD.Response of human tumor cell lines in vitro to fractionated irradiation〔J〕.Int J Radiat Oncol Biol Phys,1989,16:133.
